Отношение аминокислот к индикаторам
1.
Индика́тор — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH
| Индикатор | Окраска/кислая форма | Окраска/щелочная форма | Интервалы pH |
| Лакмус (азолитмин) | красный | синий | 5,0 — 8,0 |
| Метиловый красный | красный | желтый | 4,4 — 6,2 |
| Метиловый оранжевый | розовый, желтый | желтый | 3,0 — 4,4 |
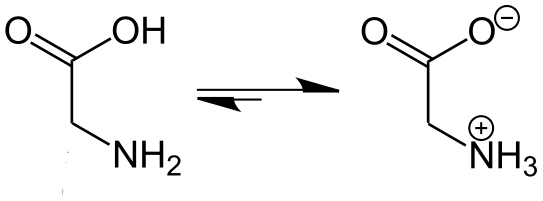
Цвиттер-ион — молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот)
Глицин в нормальной форме и в виде внутренней соли — цвиттер-иона
2.
Внутрикомплексные соединения (хелаты) — образуются, при взаимодействии ионов металлов с молекулами некоторых органических веществ.
Комплексные соединения проявляют окислительно–восстановительные свойства за счет окислительно–восстановительных превращений комплексообразователя.
-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета.
Практическая часть.
Отношение аминокислот к индикаторам.
В пробирку помещаем 3 капли 1%-ого раствора глицина и добавляем 1 каплю индикатора (лакмус, метилоранж, метиловый красный)
| ЛАКМУС | МЕТИЛОРАНЖ | МЕТИЛОВЫЙ КРАСНЫЙ | |
| ГЛИЦИН NH2 —CH2 —COOH | фиолетовая окраска | оранжевая окраска | оранжево-желтая окраска |
Окраска растворов не изменилась(кроме случая с метиловым красным, что объясняется погрешностью эксперимента) . Аминокислоты обладают как кислотными, так и основными свойствами: кислотная — карбоксильная группа, основная — аминогруппа. Они взаимно нейтрализуют друг друга, образуя биполярные ионы. Поэтому аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Отношение аминокислот к индикаторам.
Отчет по биохимии
Теоретическая часть.
Аминокислоты — структурные элементы, из которых построены белки. Представляют собою карбоновые кислоты, содержащие одну или две аминогруппы. Общим признаком аминокислот, входящих в состав белка, является наличие свободной карбоксильной группы и свободной незамещенной аминогруппы у альфа- углеродного атома. Наиболее рациональная классификация аминокислот основана на различиях в полярности R-групп. R-группы подразделяются на четыре основных класса:
1) неполярные, или гидрофобные ;
Эти аминокислоты более растворимы в воде, чем гидрофобные аминокислоты, так как их полярные R-группы могут образовывать водородные связи с молекулами воды. Глицин трудно отнести к какому-либо определенному классу аминокислот; однако его R-группа представляющая собою просто атом водорода, слишком мала для того, чтобы повлиять на высокую полярность альфа-аминогруппы и альфа-карбоксильной группы.
2) полярные, но незаряженные ;
Эти аминокислоты более растворимы в воде, чем гидрофобные аминокислоты, так как их полярные R-группы могут образовывать водородные связи с молекулами воды.
3) положительно заряженные ;
Основные аминокислоты, R-группы которых несут суммарный положительный заряд при pH7 ,и кислоты, содержащие положительно заряженную аммонийную группу (NH3,NH2).
4) отрицательно заряженные (при pH 6-7)
Основные аминокислоты, R-группы которых несут суммарный отрицательный заряд, при pH7.
Индика́тор — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH
| Индикатор | Окраска/кислая форма | Окраска/щелочная форма | Интервалы pH |
| Лакмус (азолитмин) | красный | синий | 5,0 — 8,0 |
| Метиловый красный | красный | желтый | 4,4 — 6,2 |
| Метиловый оранжевый | розовый, желтый | желтый | 3,0 — 4,4 |
Цвиттер-ион — молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на несоседних атомах. К цвитер-ионным соединениям зачастую относят и внутримолекулярные соли (например, внутримолекулярные соли аминокислот)
Глицин в нормальной форме и в виде внутренней соли — цвиттер-иона
Внутрикомплексные соединения (хелаты) — образуются, при взаимодействии ионов металлов с молекулами некоторых органических веществ.
Комплексные соединения проявляют окислительно–восстановительные свойства за счет окислительно–восстановительных превращений комплексообразователя.
-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета.
Практическая часть.
Отношение аминокислот к индикаторам.
В пробирку помещаем 3 капли 1%-ого раствора глицина и добавляем 1 каплю индикатора (лакмус, метилоранж, метиловый красный)
| ЛАКМУС | МЕТИЛОРАНЖ | МЕТИЛОВЫЙ КРАСНЫЙ | |
| ГЛИЦИН NH2 —CH2 —COOH | фиолетовая окраска | оранжевая окраска | оранжево-желтая окраска |
Окраска растворов не изменилась(кроме случая с метиловым красным, что объясняется погрешностью эксперимента) . Аминокислоты обладают как кислотными, так и основными свойствами: кислотная — карбоксильная группа, основная — аминогруппа. Они взаимно нейтрализуют друг друга, образуя биполярные ионы. Поэтому аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
2. Образование медной и железной солей глицина.
В две пробирки помещают по 2 мл CuSO4 и затем в одну из них добавляют 1 мл 1%-ного раствора глицина. Затем приливают по 1 мл разбавленного раствора щелочи и наблюдают образование Cu(OH)2 в одной из пробирок.
В третью пробирку помещают 1 мл 5%-ого раствора глицина, добавляют несколько капель 3%-ного раствора FeCl3.
1) Cо свободным сульфатом меди реакция с глицином не пойдет. Нужно образовать гидроксид.
 |
Аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Лиганд NH2CH2COO − (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем — через атом кислорода карбоксильной группы и через атом азота аминогруппы.
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) β2равна 1,8·10 15 .
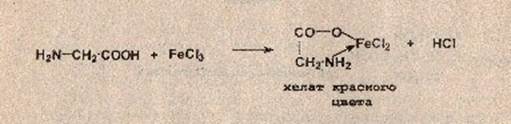 |
Реакция с хлоридом железа (III). От прибавления раствора хлорида железа (III) к аминокислоте жидкость приобретает сине-фиолетовую окраску. Состав и окраска комплексов, образующихся при взаимодействии аминокислоты с ионами железа, зависит от рН среды. При рН=1,8. 2,5 образуется моносалицилатный комплекс , имеющий сине-фиолетовую окраску. При рН = 4. 8 образуется дисалицилатный комплекс , имеющий красно-бурую окраску. Комплекс железа , имеющий желтую окраску, образуется при рН = 8. 11.
3. Действие азотистой кислоты на аминокислоты.
В пробирку помещают 2 капли 0,2 н раствора глицина, 2 капли раствора азотокислого натрия и 2 капли соляной кислоты. При встряхивании содержимого пробирки выделяются пузырьки газа.
NaNO2 + HCl → NaCl + HNO2
NH2 – CH2 – COOH + HNO2 → HOCH2 – COOH + N2 ↑ + H2O
Оксиуксусная кислота
Вывод:В результате проведения эксперимента, в первом опыте мы убедились, что аминокислота нейтральна и индикатор никак на нее не реагирует.
Второй опыт пказал нам процессы образования медной и железной солей глицина.
В третьем опыте мы наблюдали процессы влияния азотистой кислоты на аминокислоту.
Отношение аминокислот к индикаторам уравнение

Аминокислоты – твердые вещества, хорошо растворимые в воде. К раствору аминоуксусной кислоты прильем немного лакмуса. Окраска раствора не изменилась. Раствор аминоуксусной кислоты имеет нейтральную реакцию. Аминокислоты обладают как кислотными, так и основными свойствами: кислотная — карбоксильная группа, основная — аминогруппа. Они взаимно нейтрализуют друг друга, образуя биполярные ионы. Поэтому аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Опыт безопасен.
Постановка опыта и текст – к.п.н. Павел Беспалов.
http://poisk-ru.ru/s576t7.html
http://files.school-collection.edu.ru/dlrstore/aa73fec2-768f-fe6d-52c7-8195d6878a68/index.htm