Отношение кислоты к индикатору лакмус уравнение реакции

Для определения реакции среды используют индикаторы лакмус, метилоранж, фенолфталеин. Как индикаторы реагируют на кислую среду? Приготовим пробирки с раствором соляной кислоты. Лакмус и метилоранж в кислой среде изменяют цвет – растворы становятся соответственно красным и розовым. Фенолфталеин в кислой среде остается бесцветным .
НС I 
Оборудование: пробирки, держатель для пробирок.
Следует соблюдать правила работы с кислотами.
Постановка опыта – Елена Махиненко , текст – Павел Беспалов.
Практическая работа «Получение соляной кислоты и изучение ее свойств»
Разработка практической работы по теме «Получение соляной кислоты и изучение ее свойств» может быть использована при проведении уроков 9 класса. Включает в себя задания и вариант оформления отчета о работе.
Просмотр содержимого документа
«Практическая работа «Получение соляной кислоты и изучение ее свойств»»
ПРАКТИЧЕСКАЯ РАБОТА № 2 9 класс
ПОЛУЧЕНИЕ СОЛЯНОЙ КИСЛОТЫ И ИЗУЧЕНИЕ ЕЕ СВОЙСТВ
Цель работы: Получить соляную кислоту. Изучить ее свойства, научиться отличать соляную кислоту и ее соли от других кислот и солей.
Оборудование: лабораторный штатив с лапкой, спиртовка, спички, пробирки, газоотводная трубка, вата.
Реактивы: NaCl (крист.), H2SO4 (конц.), AgNO3 (р-р), Mg, NaCl (р-р), CaCl2 (р-р), CuO (тв.), CuSO4(р-р), NaOH (р-р), СaCO3(тв.), вода, лакмус.
I. Инструктаж по технике безопасности перед началом работы
II. Выполнение работы
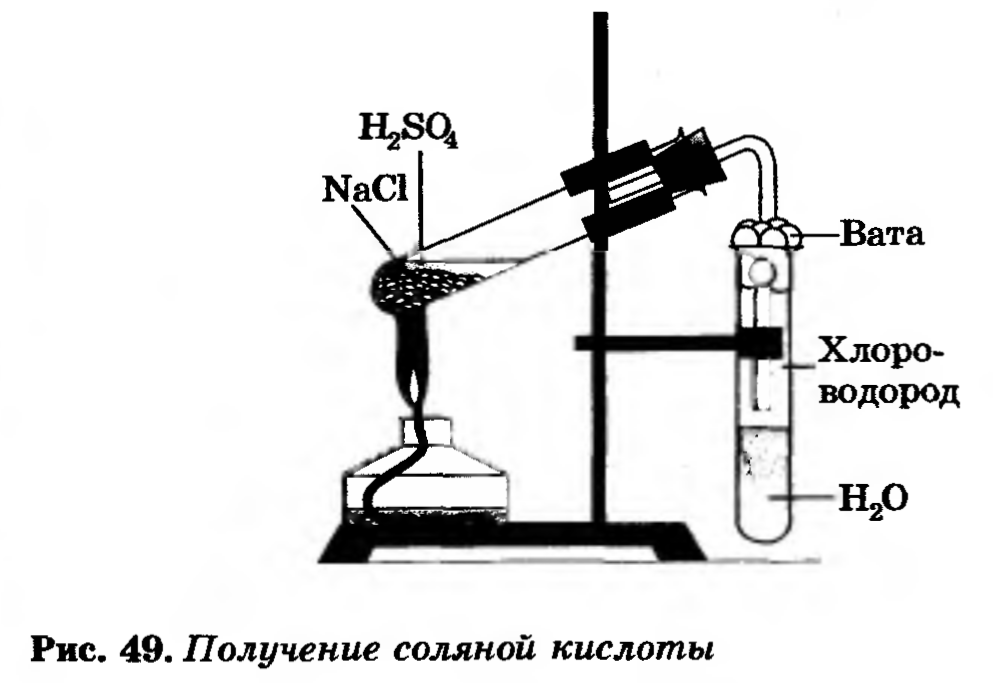
1. Получение соляной кислоты
В пробирку насыпать немного поваренной соли и прилить концентрированную серную кислоту так, чтобы кислота смочила соль. Закрыть пробирку газоотводной трубкой. Укрепить пробирку в лапке штатива (смотри рисунок). Конец газоотводной трубки опустить в пробирку с водой так чтобы он был на расстоянии 0,5 – 1 см от поверхности воды. Затем смесь соли и кислоты осторожно нагреть.
Следите за тем, чтобы газоотводная трубка не касалась воды!
Иначе воду перебросит в горячую пробирку-реактор и стекло лопнет
Наблюдайте за происходящим в пробирке с водой
2. Исследование свойств соляной кислоты
1). Отношение кислоты к индикатору
В пробирку с раствором соляной кислоты HCl добавить лакмус
2). Взаимодействие с металлами
В пробирку с раствором соляной кислоты HCl добавить Mg
Уравнение реакции: Mg + HCl =
3). Взаимодействие с оксидами металлов
В пробирку с раствором соляной кислоты добавить горошину оксида меди CuO
Пробирку немного нагреть (не кипятить!).
Уравнение реакции: CuO + HCl =
4). Взаимодействие с основаниями
В пробирку со свежеосаденным гидроксидом меди (II) Cu(OH)2 1 – 2 мл раствора соляной кислоты (до растворения осадка)
5). Взаимодействие с солями
В пробирку с CaCO3 добавить раствор соляной кислоты HCl
3. Распознавание соляной кислоты и ее солей (качественная реакция на хлориды)
В пробирки с р-ром соляной кислоты и хлорида натрия добавить несколько капель раствора нитрата серебра AgNO3 (качественная реакция на ион хлора Cl — )
Уравнения реакций: HCl + AgNO3 =
Выполните отчет по работе
(Результаты исследования занести в таблицу)
(молекулярное, сокращенное ионное)
1. Получение соляной кислоты
Выделение газа и растворение его в воде. От поверхности воды вниз опускаются струйки тяжелой жидкости
В лаборатории соляную кислоту можно получить при взаимодействии _______ и ________.
2. Исследование свойств соляной кислоты
1). Отношение кислоты к индикатору
При диссоциации соляной кислоты образуется ион _______(катион) и хлорид ион (________).
2). Взаимодействие с магнием
Растворение металла и выделение газа
Активные металлы вытесняют _______ из раствора соляной кислоты.
3). Взаимодействие с оксидом меди (II)
Растворение оксида меди (II) и образование раствора _____ цвета.
Основный Оксид и кислота при взаимодействии образуют ________ и воду.
4). Взаимодействие с гидроксидом меди (II)
Растворение осадка и образование голубого раствора
При взаимодействии кислоты с основаниями образуется растворимая ________ и вода.
5). Взаимодействие с карбонатом кальция
При взаимодействии соли и кислоты в одном сосуде – происходит обмен ионами. Реакция между солью и кислотой происходит тогда, когда может образоваться осадок или выделиться газ.
3. Распознавание соляной кислоты и ее солей
Выпадает __________ осадок
Реактивом на хлорид ион является раствор ____________ .
Урок химии по теме «Кислоты. Действие кислот на индикаторы. Взаимодействие кислот с металлами»
Разделы: Химия
- продолжить формирование спец. умений (выделять существенные признаки реакций) и навыков (в написании уравнений реакций);
- обеспечить усвоение учащихся понятия «кислота» как частного случая вещества.
- Развивать логическое мышление;
- Развивать умение проводить сравнение, сопоставление, вести наблюдения;
- Развивать умение выявлять причинно-следственные связи в химических процессах, делать выводы, обобщения;
- Развивать речь учащихся;
- Развивать любознательность и интерес к учению.
- Продолжать формирование основ диалектико-материалистического мировоззрения через живое созерцание к абстрактному мышлению и практике через познание отдельных фактов и закономерностей к обобщениям;
- Прививать навыки коллективного труда.
Тип урока: Урок изучения и первичного закрепления новых знаний.
Оборудование урока: мультимедиа, индикаторы, пробирки, штатив для пробирок, лучина, химические стаканы, растворы кислот HCl, H2SO4, металлы: Fe, Cu.
Ход урока
| Формы организации познавательной деятельности | содержание |
| I. Организация урока. Подготовка учащихся к работе | |
| Беседа. Индивидуальных, групповых и фронтальных форм работы уч-ся |
Письменная работа
1. Выявить качественный уровень выполнения д/з (осмысленность, прочность, осознанность.
2. Выявить типичные ошибки в знаниях учащихся, акцентировать на них внимание класса и показать пути их устранения.
3. Составить представление об уровне развития мышления.
Содержание этапа:
Общие
1. Как в лаборатории можно получить водород? (на уровне воспроизведения)
I-й уровень
Из данного перечня формул выбрать формулы оксидов:
1) Ca(OH)2
2) SO2
3) HCl
4) BaCl2
5) CaO
6) H2SO4
III-й уровень
Составьте уравнение реакций, в результате которых можно получить водород.
Mg + HCl=
H2+ PbO =
Ca + H2O =
Постановка проблемы
Актуализировать ведущие знания уч-ся, необходимые для адекватного включения в УПД.
Содержание этапа:
1) Состав кислот
2) Физические свойства соляной и серной кислот
3) Изменение окраски индикаторов в кислой среде
4) Взаимодействие кислот с металлами
5) Постановка проблемы
Дорогие ребята, вы любите фрукты,ягоды? (слайд №4)?
Какой вкус у фруктов? (слайд)
Как видите, здесь есть представители растений и животных. А что между ними общего? Лимон, яблоко, муравей?
Чем объясняется кислый вкус фруктов и других продуктов?
Работа над словами «кислота», «индикаторы»,
Работа в парах
Постановка проблемы
Парная работа
МО.
Проблемно-поисковый.
Работа с учебником
Работа над терминами «валентность», «кислотный остаток».
Запись в тетрадь
Подберите однокоренные слова к слову кислота.
Таким образом, само название класса указывает на одно из физических свойств кислот. Действительно кислоты имеют кислый вкус, его вы ощущаете, когда положите на язык ломтик лимона, в соке которого содержится небольшое количество лимонной кислоты. Но, помните о том, что эта кислота пищевая! Пробовать на вкус кислоты ни в коем случае нельзя – можно отравиться или получить сильный химический ожог, так как кислоты обладают разъедающим действием.
Как можно распознать кислоты, не пробуя на вкус?
Учащимся предлагается проверить изменение окраски индикаторов при действии кислот и щелочей. Л/р
Повторение ТБ при работе с кислотами. Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление.
Но, чтобы этого не случилось нужно при выполнении лабораторных работ с кислотами соблюдать правила техники безопасности.
Повторим: выполнять все указания учителя, Не пробовать вещества на вкус, пробирку в руки не брать, не приступать к выполнению опыта, не зная, что и как нужно делать,
Обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок. При попадании кислоты на кожу надо смыть её струёй воды. Обработать 2% раствором гидрокарбонатом натрия.
http://multiurok.ru/files/praktichieskaia-rabota-poluchieniie-solianoi-kislo.html?__cf_chl_jschl_tk__=bf1b215dfa96f638f49f4da32ddd9777330dbeca-1608089245-0-AbX0mz3-Rx9W78wsrLBtUkfXHSu0NT_ZcRWZADlWExtAZMxt-T0K4iImBf7o-hqtiv_b-AVYmjHk1GPS25be3SqxOflW0RsILVXtxcW7z9989JER2OWS2J0kG6OXdFX0jBW_2HMWx_F8hrsBX6A4hb8jfo_ekX1w33EjMtJHx20k_CHkOecTxMDIOtNj3k5AJNqLoo-pLkW82vVSTi2U34Z45vyFy495jmTY5CcwocFs9oYyi_k_9_2EW6JRNy8oG3amUL09e-0_uG78oZF9mk9G-FUatHdf5cz2KM3kvelpEZ7wVtwfLJBY-g9h74nXmrBskZ4K5_fGl17UW7PpKOra_RGfpO0IivQ9aDkKCIktjtM03lq-c6rN2VVVpitm_pctUi0U-orOW7WtVhjKUec
http://urok.1sept.ru/articles/637660