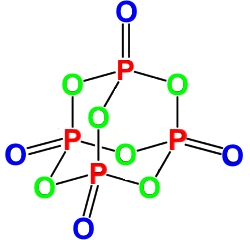
Оксид фосфора (III): получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III) – это кислотный оксид . Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III)
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например , оксид фосфора (III) диспропорционирует в горячей воде:
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например , N2O окисляется кислородом:
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора P2O5(V)
Фосфор является очень «плодовитым» элементом, образуя много разнообразных оксидов и кислот.
Самым устойчивым является оксид фосфора P2O5(V), который называется фосфорным ангидридом.
Физические свойства фосфорного ангидрида:
- Белый порошок, не имеющий запаха;
- Молярная масса: 141,94 г/моль;
- Плотность: 2,39 г/см 3 ;
- tпл.: 420°C(Н-форма), 569°C (О-форма)
- tкип.: возгоняется при 359°C (Н-форма)
Фосфорный ангидрид имеет несколько модификаций — одну кристаллическую и несколько полимерных.
В узлах кристаллической модификации расположены, соединенные попарно, молекулы P2O5.
Химические свойства P2O5(V)
Фосфорный ангидрид является типичным кислотным оксидом, активно взаимодействует с водой, с образованием фосфорных кислот:
P2O5+H2O = 2HPO3 (метафосфорная к-та)
P2O5+2H2O = H4P2O7 (пирофосфорная к-та)
P2O5+3H2O = 2H3PO4 (ортофосфорная к-та)
В реакциях со щелочами кислотный оксид P2O5(V) образует, как средние, так и кислые соли, в зависимости от соотношения реагентов:
P2O5+4NaOH = 2Na2HPO4+H2O
P2O5+2NaOH+H2O = 2NaH2PO4
Поскольку фосфорный ангидрид является водоотнимающим средством, он применяется для получения других оксидов из их кислот:
P2O5+2HNO3 = 2HPO3+N2O5
Несмотря на то, что в фосфорном ангидриде фосфор имеет максимально возможную степень окисления (+5), оксид фосфора P2O5(V) не обладает выраженными окислительными свойствами, что объясняется тем, что +5 является крайне неустойчивой степенью окисления для фосфора.
Получают P2O5(V) при горении фосфора в избытке кислорода:
4P+5O2 = 2P2O5
Выше уже было сказано, что фосфорный ангидрид является хорошим водопоглотителем, что позволяет его использовать в качестве осушителя разнообразных веществ (в эксикаторах), при проведении реакций дегидратации и проч.
Оксид фосфора P2O3(III)
Как и P2O5(V) оксид фосфора P2O3(III) имеет несколько модификаций, самая распространенная из которых имеет кристаллическую структуру — в узлах решетки располагаются спаренные молекулы P2O3 — это ядовитое вещество белого цвета, похожее на воск.
Свойства оксида P2O3(III) во многом схожи с фосфорным ангидридом (см. выше) — это кислотный оксид, образующий фосфористую кислоту (является сильным восстановителем, как и ее соли) при его растворении в воде:
P2O3+3H2O = 2H3PO3
P2O3(III) реагирует с основаниями и основными оксидами с образованием фосфитов (солей фосфористой кислоты):
P2O3+4NaOH = 2Na2HPO3+H2O
Получают оксид фосфора P2O3(III) окислением фосфора при недостатке кислорода:
4P+3O2 = 2P2O3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://prosto-o-slognom.ru/chimia/505_oksidy_fosfora.html http://acetyl.ru/o/np2o3.php |