Лекция №5
План лекции:
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает избыточный электрический заряд, который компенсируется противоионами. В результате, на границе Ж-Т возникает ДЭС. Образование ДЭС происходит самопроизвольно, вследствие стремления поверхностной энергии к минимуму и в связи с особыми свойствами границы раздела.
Возникновение на границе электрических зарядов характерно, прежде всего, для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
При погружении металла в раствор электролита, содержащего ионы этого металла, устанавливается электрохимическое равновесие. Если химический потенциал ионов металла m М больше химического потенциала этих же ионов в растворе m р , то ионы переходят из металла в раствор, и поверхность металла заряжается отрицательно. И, наоборот, при помещении медной пластинки в раствор сульфата меди с достаточно высокой концентрацией соли, металлическая поверхность заряжается положительно.
Возникновение зарядов на твердом теле приводит к тому, что на границе раздела фаз возникает электрический потенциал, обозначаемый через j .
Если j -потенциал определяется активностью ионов в растворе, то есть твердое тело играет роль электрода, то для выражения его можно воспользоваться уравнением Нернста:


где n — заряд иона, F — число Фарадея, ап и ар -активности ионов у поверхности и в растворе.
ОБРАЗОВАНИЕ ДЭС
Поверхность твердого тела приобретает ионы определенного знака. Эти ионы называют потенциалоопределяющими. К твердой поверхности из жидкой среды притягиваются ионы противоположного знака, их называют противоионами. Возникает ДЭС.
Было предложено несколько теорий образования ДЭС.
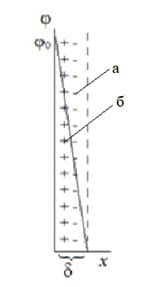
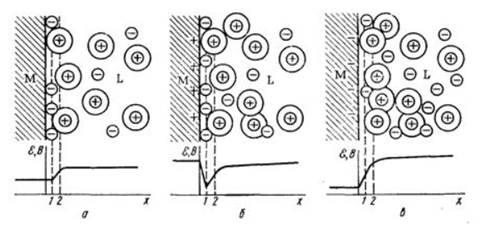
Простейшей из них является модель плоского конденсатора Гельмгольца (5.1.а), согласно которой потенциалоопределяющие ионы и противоионы находятся на молекулярном расстоянии друг от друга, взаимодействие между ними осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно.
Дальнейшее развитие теория ДЭС получила в работах Гуи и Чепмена на основе сопоставления электростатического взаимодействия противоионов с энергией их теплового движения. Согласно модели Гуи и Чепмена противоионы рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое (5.1.б), а потенциал экспотенциально снижается по мере удаления от поверхности.
Согласно теории Штерна , которую можно рассматривать как основу современного представления о структуре ДЭС (5.1.в), противоионы находятся в двух положениях: одна их часть образует адсорбционный слой (иногда его называют плотным слоем или слоем Гельмгольца).Другая часть противоионов находится в диффузном слое. В отличии от адсорбционного слоя противоионы диффузного слоя не закреплены, в результате диффузии и взаимного отталкивания они способны перемещаться в пределах диффузного слоя в глубь жидкости.
ДЭС может возникнуть на частицах, находящихся в полярной среде, и в отсутствии электролитов, вследствие ориентации диполей, а также частичной поверхностной диссоциации полярных частиц, если в жидкой среде присутствуют хотя бы следы воды.
Потенциал, возникающий на границе между адсорбционным и диффузным слоем, называется потенциалом диффузного слоя j д .
Толщина адсорбционного слоя d определяется размерами противоионов, обычно она незначительна и не превышает 1 нм. В диффузном слое противоионы движутся хаотично, их положение изменяется. По этой причине толщина диффузного слоя будет величиной приведенной l .
ТЕРМОДИНАМИЧЕСКИЕ СООТНОШЕНИЯ МЕЖДУ ПОВЕРХНОСТНЫМ НАТЯЖЕНИЕМ И ЭЛЕКТРИЧЕСКИМ ПОТЕНЦИАЛОМ ДЭС.
Образование ДЭС происходит самопроизвольно, в результате стремления
системы уменьшить энергию Гиббса поверхностного слоя.
Обозначим изменение электрической энергии через j d q ( j — электрический потенциал ДЭС, q — заряд поверхности).
Тогда, в соответствии с обобщенным уравнением первого и второго начал термодинамики (без учета химической энергии), изменение энергии Гиббса на поверхности можно записать следующим образом:
dG = — S dT + s dS + j d q (5.2)
s dS — изменение поверхностной энергии
dG = s dS + j d q (5.3)
Полный дифференциал энергии Гиббса :
dG = s dS +S d s + j d q + q d j
Вычитая это уравнение из 5.3, получим:
S d s + q d j = 0 (5.4)
Разделим 5.4 на S (площадь межфазной поверхности) и обозначим q / S через qS (плотность заряда), получим:

I уравнение Липпмана
Если знаки потенциала и заряда совпадают, то поверхностное натяжение уменьшается с увеличением потенциала, если их знаки противоположны, то с увеличением потенциала увеличивается поверхностное натяжение.
Дифференциальная емкость ДЭС, как и любого конденсатора, определяется соотношением:

Дифференцируем 5.5 по j и подставляем в него соотношение 5.6, получаем второе уравнение Липпмана:

II уравнение Липпмана
Это уравнение показывает возможность определения емкости ДЭС, если известна зависимость поверхностного натяжения от потенциала.
Если ДЭС возникает вследствие перераспределения ионов, то для описания адсорбции ионов можно воспользоваться адсорбционным уравнением Гиббса. Если на поверхности адсорбируется катионы:
Г+ — гиббсовская адсорбция потенциалоопределяющих катионов.
Поверхностная плотность заряда:
Подставляем это выражение в уравнение Липпмана:
сравниваем 5.8 и 5.9:

a o и ap — активности иона на поверхности и в растворе
Полученное уравнение называется уравнением электродного потенциала Нернста. Приведенный вывод указывает на связь между уравнениями Гиббса и Липпмана и показывает, что потенциалоопределяющие ионы, адсорбируясь, изменяют поверхностное натяжение.
СПЕЦИФИЧЕСКАЯ АДСОРБЦИЯ ИОНОВ
Штерн попытался учесть влияние специфической адсорбции ионов на электрический потенциал, обусловленный действием ковалентных сил дополнительно к электростатическим силам. Так как радиус действия сил такой адсорбции соизмерим с размером ионов, это дает основание учитывать ковалентные силы только для ионов, входящих в плотный слой Гельмгольца.
Плотность поверхностного заряда противоионов можно разделить на две части: плотность заряда qr, обусловленную слоем Гельмгольца и q d диффузного слоя Гуи.
Общая поверхностная плотность заряда ДЭС:
Штерн предположил, что поверхность имеет определенное число адсорбционных центров, каждый из которых взаимодействует с одним противоионом.
Константа такой квазихимической реакции равна фактору Больцмана, в котором общий адсорбционный потенциал составляет сумму адсорбционных потенциалов электростатического и специфического взаимодействия:

F n j — электростатический адсорбционный потенциал,
F — потенциал специфической адсорбции.
Такой подход позволил Штерну получить уравнение для плотности поверхностного заряда в слое Гельмгольца:

где q ¥ — предельно возможная плотность поверхностного заряда
xo — мольная доля противоионов в растворе.
При малых концентрациях электролита можно пренебречь единицей в знаменателе.
Теория Штерна позволяет рассчитать заряд в плотном и диффузном слоях.
Из теории Ш. следует, что лучше адсорбируются и ближе подходят к Пв менее гидратированные ионы.
Специфическая адсорбция зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциирующие поверхностные соединения. Большими адсорбционными потенциалами обладают многозарядные ионы (Al 3+ , Th 4+ и др.), органические ионы.
Сильно адсорбирующиеся ионы в плотном слое способны создать избыточный заряд со знаком заряда противоионов. Это явление называется перезарядкой. (рис. 5.2)
Рис. 5.2. Изменение потенциала поверхности при ее перезарядке.
При перезарядке j o и j d имеют разные знаки. Общую поверхностную плотность заряда можно представить в виде разности между величинами адсорбции потенциалоопределяющих ионов разного знака :
Пример:
1) водный р-р — поверхность AgI. При избытке в растворе Ag + (при добавлении AgNO3 ) эти ионы являются потенциалоопределяющими
В роли противоионов выступают NO3 — , часть которых, находится в плотном слое, часть — в диффузном.
Ф — ла ДЭС :[AgI]m · nAg + |(n — x)NO3 — |x NO 3 —
n-число потенциалопределяющих ионов
x-число противоионов в диффузной части
Если в систему с AgI добавить KNO3 , то потенциалопределяющими станут иодид — ионы:
[ AgI ] m · nI — |( n — x ) K + | x K +
2) В ДЭС на поверхности оксидов в растворе в качестве потенциалопределяющих ионов выступают Н + или OH — (в зависимости от среды).
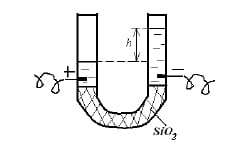
В результате преобладающей адсорбции одного и этих ионов поверхность оксида приобретает соответствующий знак заряда поверхности. Например: SiO2 обладает кислотными свойствами, поэтому его поверхность заряжена отрицательно:
[SiO2]m · nOH — |(n — x)H + |x H +
FeO имеет основные свойства, его поверхность будет заряжена положительно:
[FeO]m · nH + |(n — x)OH — |x OH —
Al2O3 — в кислой среде поверхность заряжена положительно, в щелочной — отрицательно.
В дисперсионных системах ДЭС возникает на поверхности частиц.
Частицу дисперсной фазы в гетерогенно-дисперсной системе вместе с ДЭС называют мицеллой.
Строение мицеллы можно показать той же формулой, что и строение ДЭС.
Внутренняя части мицеллы — агрегат основного вещества, на поверхности агрегата — потенциалопределяющие ионы:
Агрегат + потенциалопределяющие ионы = ядро.
Ядро + противоионы = гранула.
Гранулу окружают противоионы диффузного слоя. Вся мицелла электронейтральна.
Мицеллы создают в дисперсионной системе соответствующую противоионам ионную среду — суспензионный эффект. Если противоионами являются Н + и ОН — — ионы, то среда приобретает соответственно кислый или щелочной характер. При удалении частиц, например, фильтрацией, противоионы уходят вместе с ними в количествах, эквивалентных заряду частиц. Отсюда суспензионный эффект количественно можно определить как разность между концентрационными характеристиками противоионов в суспензии (дисперсионной системе) и в фильтрате. При определении кислотно-основных свойств дисперсной фазы суспензионный эффект рассчитывается по соотношению:
рНсэ = рНс — рНф, то есть по разности значений рН суспензии и фильтрата. Суспензионный эффект возрастает с увеличением концентрации дисперсной фазы, с увеличением ее дисперсности, и уменьшается с повышением концентрации электролита (это связано со сжатием ДЭС).
Теории строения двойного
Электрического слоя
Как было показано на прошлой лекции, возникновение заряда на поверхности частиц дисперсной фазы приводит к образованию двойного электрического слоя (рисунок 3).
Рис. 3. Возникновение двойного электрического слоя
на поверхности частиц
Вспомним, что, двойной электрический слой (сокращенно ДЭС) – это система пространственно разделенных зарядов на границе раздела фаз. Заряды одного знака сосредоточены на поверхности частиц дисперсной фазы, а заряды противоположного знака сосредоточены в жидкости вблизи частиц. Необходимо отметить, что одна часть ионов прочно закреплена на поверхности частиц (химическими связями), а вторая часть (так называемые противоионы) – находятся в растворе и могут свободно перемещаться, отходя от частицы на достаточно большие расстояния. Именно строение ДЭС может помочь в объяснении причин влияния различных факторов на электрокинетический потенциал.
Были предложены различные теории строения двойного электрического слоя. Поскольку заряды на поверхности частицы жестко закреплены, то различие в строении ДЭС сводится к различию в строении слоя противоионов.
Исторически первой была теория Гельмгольца-Перрена.
Рассмотрим строение ДЭС по Гельмгольцу – Перрену.
В соответствии с этой теорией двойной электрический слой представляет собой плоский конденсатор. ДЭС рассматривается как плоскопараллельный. Это допущение приемлемо, поскольку толщина ДЭС намного меньше, чем радиус кривизны поверхности частицы.
Рассмотрим графическую иллюстрацию теории Гельмгольца – Перрена. На рисунке 4 жирной линией обозначена поверхность частицы дисперсной фазы. Одна обкладка – заряды на поверхности частицы (положительные, суммарный заряд +s), вторая обкладка – ряд противоионов (отрицательных) в растворе (суммарный заряд – s). Число положительных зарядов равно числу отрицательных. По оси х откладываем Х – расстояние от поверхности частицы. По оси у откладываем значение потенциала j в зависимости от расстояния от поверхности частицы. d – толщина слоя противоионов, равная радиусу гидратированного иона. Максимальное значение потенциала jо наблюдается на поверхности частицы. В пределах толщины слоя противоионов d значение потенциала резко линейно падает до 0 в точке С. Это происходит потому, что противоионы полностью компенсируют заряд частицы и за пределами ДЭС суммарный заряд частицы равен 0. Как мы уже говорили, частицы дисперсной фазы при перемещении увлекают за собой часть жидкости. «А – В» – граница скольжения частицы относительно дисперсионной среды. График показывает, что в пределах границы скольжения коллоидная частица нейтральна (благодаря противоионам) и, следовательно, она не будет перемещаться в электрическом поле. Таким образом, теория Гельмгольца – Перрена не могла объяснить электрокинетические явления. К тому же, эта теория не учитывала теплового движения ионов в растворе.
   |
Рис. 4. Строение ДЭС по Гельмгольцу – Перрену
На смену теории Гельмгольца пришла теория Гуи-Чэпмена.
Теория Гуи-Чепмена(1910, 1913г.г.).
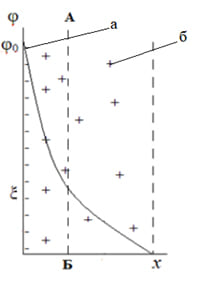
Теория Гуи-Чепмена – это теория ДЭС с диффузным слоем противоионов. Она устранила многие недостатки теории Гельмгольца – Перрена. С точки зрения этой теории на противоионы, находящиеся вблизи поверхности частицы, действуют две взаимно противоположные силы: электростатическое притяжение поверхности твердой фазы и тепловое движение, вследствие которого противоионы стремятся рассеяться во всем объеме жидкости (явление диффузии). Таким образом, слой противоионов приобретает диффузное строение.
Рассмотрим графическую иллюстрацию теории Гуи-Чепмена (рисунок 5).
    |
Рис. 4. Строение ДЭС по Гуи -Чепмену
Поскольку противоионы рассредоточены от поверхности частицы вглубь раствора, то толщина слоя противоионов значительно увеличивается по сравнению с теорией Гельмгольца. Полная компенсация заряда поверхности происходит только на линии СД , и в точке Д величина потенциала становится равной 0. Падение потенциала происходит не по прямой, а по экспоненте. Надо отметить, что граница скольжения «А – В» в этом случае находится внутри диффузного слоя, на границе скольжения заряд частицы частично скомпенсирован (уменьшается), поэтому потенциал на этой границе, меньше термодинамического, но не равен 0. На границе скольжения при перемещении частицы возникает электрокинетический потенциал. Из графика видно, что величина z- потенциала составляет только часть термодинамического потенциала. Таким образом, эта теория могла объяснить электрокинетические явления и объясняла, почему электрокинетический потенциал меньше термодинамического.



Рис. 6. Влияние электролитов на величину z- потенциала
При большой концентрации электролитов диффузный слой может уменьшиться до границы скольжения и z- потенциал станет равным 0 (кривая 3). Частицы дисперсной фазы перестанут перемещаться в электрическом поле. Такое состояние системы называется изоэлектрической точкой. Однако, эта теория не могла объяснить явление перезарядки поверхности, когда заряд частиц дисперсной фазы в присутствии ионов с высоким зарядом меняется на противоположный, и частицы в электрическом поле меняют свое направление.
Теория, которая вобрала в себя наиболее полезное из двух предшествующих теорий, была создана в 1924 году. Ее автором был Штерн.
Теория Штерна (1924г.).
Эта теория в настоящее время является общепринятой.
Рассмотрим графическую иллюстрацию этой теории (рисунок 7).





Рис. 7. Строение ДЭС по Штерну
Эти ионы прочно удерживаются на поверхности благодаря действию двух сил: электростатического притяжения и специфической адсорбции. Падение потенциала j d в этой части ДЭС происходит линейно.
Другая часть противоионов образует диффузный слой (слой Гуи). Толщина этого слоя l может быть значительной. В диффузной части потенциал снижается по экспоненте. Ионы диффузного слоя удерживаются частицей слабо и могут отходить от частицы на значительные расстояния. На границе скольжения «А – В» и в этом случае при перемещении частицы возникает электрокинетический потенциал z. Некоторые исследователи считают, что граница скольжения проходит между адсорбционным и диффузным слоем противоионов.


Рис. 8. Перезарядка поверхности
У поверхности частицы образуется новый диффузный слой противоионов, а электрокинетический потенциал сначала становится равным 0, а затем меняет знак на противоположный. Явление перезарядки поверхности можно наблюдать реально при изучении электрофореза. Например, частицы, которые перемещались в электрическом поле к катоду, при введении в раствор электролитов с многозарядными анионами вначале прекращают движение, а затем меняют направление перемещения на противоположное, то есть движутся к аноду.
Таким образом, теория Штерна смогла объяснить практически все электрические явления, наблюдаемые в гетерогенных системах, благодаря ей было установлено строение твердофазных частиц. Эта теория сыграла важную роль в изучении условий стабилизации и разрушения дисперсных систем.
ЗАКЛЮЧЕНИЕ
Подводим итоги изучения электрических свойств дисперсных систем. Эти свойства обусловлены возникновением двойного электрического слоя на поверхности частиц дисперсной фазы. Современная теория ДЭС – теорияШтерна – позволяет объяснить строение коллоидных мицелл и причины электрокинетических явлений – электрофореза, электроосмоса, потенциала течения и седиментации, которые возникают только при взаимном перемещении дисперсной фазы и дисперсионной среды.
Двойной электрический слой (ДЭС): понятие и теории строения
Содержание:
1. Электрокинетические явления.
В начале XIX века Рейс, проводя электролиз воды, обнаружил явления электрокинетики.
В одном из опытов Рейсс заметил, что если дно U-образной трубки наполнить кварцем, то при наложении разности потенциалов на систему совершается смещение столба воды в область «-» электрода. Явление получило название электроосмос.
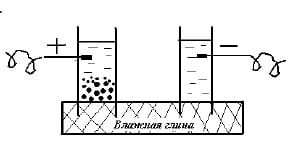
После этого Рейс сделал схему из двух стеклянных трубок, заполненных водой и опущенных концами в мокрую глину. Под действием электрического тока глина передвигалась к электроду, имеющему заряд «+», что получило название «электрофорез».
А уже после Рейсса явлениями электрокинетики занялся Г. Квинке. Он открыл потенциал течения — разность потенциалов появлялась при просачивании воды сквозь песок, глину или другую пористую диафрагму.
В 1879 г. Дорном был открыт потенциал седиментации. Разность потенциалов возникала, когда частички кварца свободно осаждались в столбе жидкости.
Все эти явления объединяло одно — либо разность потенциалов вызывала движение фаз, либо, наоборот, движение фаз создавало разность электрических потенциалов. По этому признаку рассмотренные явления и получили общее название «электрокинетические».
Итак, различают электрокинетические явления двух родов:
• I рода, в которых происходит взаимное перемещение фаз при воздействии электрического поля;
• II рода, в которых разность потенциалов возникает за счет перемещения двух фаз.
Присутствие одноименно заряженных частиц на поверхности дисперсной фазы и противоположно заряженных частиц на поверхности дисперсной среды и есть причина возникновения электрокинетических явлений. Совокупность же всех зарядов, сконцентрированных на границе раздела фаз, образует структуру, называемую двойным электрическим слоем (ДЭС).
2. Механизмы образования ДЭС.
Формирование ДЭС происходит в результате стремления системы уменьшить энергию Гиббса межфазного слоя. Межфазный слой – это слой, в котором происходит взаимодействие двух различных фаз, в результате соприкосновения которых свойства поверхности каждой фазы станут отличаться от их индивидуальных свойств.
Различают два типа ДЭС, в которых:
- заряды распространяются в различных фазах (пограничный);
- заряды располагаются на плоскости одной из фаз (поверхностный).
ДЭС будет играть весомую роль при:
- переносе вещества или энергии;
- ионном обмене;
- электрокаппилярных и элктрокинетических явлениях;
- адсорбции ионов.
Выделяют несколько механизмов образования ДЭС:
а) Формирование ДЭС при наступлении электрохимического равновесия, посредством прохода заряженных частиц между фазами. Основные разновидности этого механизма формирования ДЭС:
• Переход заряженных частиц на границе металл – газ. В этом варианте происходит переход электронов с поверхности металла в газовую фазу, из-за чего поверхность металла заряжается положительно, а со стороны газовой фазы образуется электронное облако. Появляется препятствие для дальнейшего перехода электронов (положительный заряд поверхности металла), в результате чего наступает равновесное состояние.
• В системе «малорастворимое соединение – жидкость» переход заряженных частиц будет происходить в результате поверхностного растворения частицы малорастворимого соединения, при чем в жидкую фазу преимущественно будет выполняться переход тех ионов, электрохимический потенциал которых выше. В данном случае равновесие будет выражаться электрохимическими потенциалами:
При установлении равновесия происходит переход ионов из фазы с большим электрохимическим потенциалом, в фазу с меньшим потенциалом. При этом возникает межфазный скачок потенциалов, который препятствует дальнейшему переходу ионов. В результате этого равновесие будет выражаться уравнением
• Ионизация молекул вещества твердой фазы может происходить за счет диссоциации поверхностных ионогенных групп под воздействием полярной дисперсной среды. К примеру, молекулы SiO2 при взаимодействии с водой образуют кремниевую кислоту, которая после будет диссоциировать с переходом в раствор ионов Н + . В этом случае силикат-ионы образуют слой потенциалопределяющих ионов, а ионы Н + — слой противоионов.
б) ДЭС может формироваться за счет адсорбции ионов из раствора, этот механизм формирования можно разделить на несколько вариантов:
• В соответствии с правилом Фаянса – Панета ионы могут адсорбироваться на поверхности частиц, сообщая им соответствующий заряд, если эти ионы входят в состав кристаллической структуры этих частиц. Около заряженной поверхности будут концентрироваться противоположно заряженные ионы (противоионы).
• Заряд поверхности может образовываться за счет избирательной адсорбции ионов из растворов, не входящих в состав твердой фазы. В пример можно привести раствор хлорида натрия, в котором на металлах адсорбируются хлорид-ионы и придают его поверхности «-» заряд, а ионы натрия, в свою очередь, являются противоионами создавая с хлорид-ионами ДЭС
в) ДЭС может создаваться в том случае, если поверхность образована двумя фазами, молекулы которых не могут диссоциировать, но обладают дипольными моментами. Согласно правилу Кёна, из двух соприкасающихся фаз, не способных обмениваться зарядами, положительно заряжается та фаза, которая имеет большую диэлектрическую проницаемость.
3. Модели строения двойного электрического слоя.
Авторы моделей придерживались следующих положений:
- На межфазной поверхности в системе «твердое вещество – жидкость», ДЭС образуется из потенциалопределяющих ионов, связанных с твердой поверхностью и эквивалентного количества противоионов, находящихся в жидкой дисперсной среде;
- Равномерное распределение заряда на поверхности твердой фазы;
- Одинаково заряженные частицы находятся в равновесии.
Основное различие между моделями строения ДЭС заключается в постепенном усложнении представлений о структуре слоя противоионов.
3.1 Модель Гельмгольца – Перрена.
В конце XIX века Г. Гельмгольц предложил первую модель строения ДЭС, далее ее развивал Ж.Б. Перрен, но уже в 1904 г.
Модель Гельмгольца – Перрена основывалась на представлении ДЭС как плоского конденсатора, в котором обкладки представлялись как два ряда ионов (потенциалопределяющих ионов и противоионов) (рисунок 1). Потенциал в ДЭС линейно уменьшался с расстоянием, как в плоском конденсаторе, а плотность заряда на поверхности η0 определялась уравнением:
где:
δ – толщина ДЭС;
ε0ε – диэлектрическая проницаемость среды между обкладками конденсатора;
(ε0ε /δ)= С – емкость плоского конденсатора;
φ0 – потенциал поверхности относительно объема раствора.
Рисунок 1. Схема строения двойного электрического слоя по модели Гельмгольца – Перрена: а) слой потенциалопределяющих ионов, б) слой противоионов.
Модель Гельмгольца – Перрена подтверждена несколькими экспериментальными фактами:
- В зависимости от потенциала заряд ДЭС можно считать линейно меняющимся;
- Модель позволяет количественно оценить емкость ДЭС.
У этой модели есть и ряд недостатков:
- Не учитывается зависимость емкости и заряда поверхности от концентрации электролита и температуры;
- При взаимном перемещении твердой и жидкой фаз вместе с твердой частицей движется слой жидкости, превышающий толщину ДЭС по теории Гельмгольца – Перрена;
- Не объясняет электрокинетические явления.
3.2 Модель Гуи – Чапмена.
В начале XX века Л. Гуи и С. Чампен (Чэпмен) предположили более сложную структуру ДЭС (рисунок 2), предположив, что слой противоионов имеет диффузное строение и обусловлен противоположно направленным действием двух факторов:
- Сил электростатического притяжения со стороны потенциалопределяющих ионов;
- Направленного диффузионного действия.
Рисунок 2 — Схема строения двойного электрического слоя по модели Гуи – Чэпмена: а) слой потенциалопределяющих ионов, б) слой противоионов.
По закону Больцмана концентрация противоионовв диффузном слое изменяется, за счет установления динамического равновесия:
где:
ciX – концентрация i-иона в ДЭС на расстоянии xот поверхности;
ci0 – концентрация i-иона за пределами ДЭС;
Z – заряд иона;
F – число Фарадея (96500);
φ – потенциал на расстоянии x от поверхности;
R – универсальная газовая постоянная (8,31);
Е – абсолютная температура.
Если взять в пример плоский конденсатор (модель Гельмгольца – Перрена), то все противоионы будут располагаться около поверхности (при температуре близкой к абсолютному нулю), так как диффузность слоя будет определяться тепловым движением ионов.
Вторая представленная модель позволила описать явления электрокинетики. При перемещении твердой и жидкой фаз относительно друг друга плоскость скольжения (АБ) лежит внутри двойного слоя, поэтому на границе скольжения φ≠0. Потенциал в плоскости скольжения соответствует той доле заряда поверхности, которая нескомпенсирована противоионами и вызывает перемещение фаз при наложении электрического поля. Часть общего скачка потенциала в двойном электрическом слое, которая приходится на границу скольжения и проявляется в электрокинетических явлениях, называется электрокинетическим, или ξ – потенциалом.
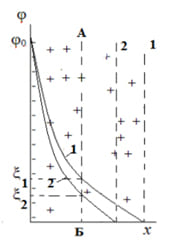
Можно описать изменение структуры ДЭС при повышении концентрации индифферентного электролита (рисунок 3). Введение индифферентного электролита повышает концентрацию противоионов в диффузном слое. Но, так как на компенсацию поверхностных зарядов потенциалопределяющих ионов необходимо то же количество противоионов, что и до введения электролита, часть противоионов окажется в избытке и это приведет к таким изменениям как:
- Граница ДЭС сдвинется ближе к поверхности;
- Слой Гуи уменьшится;
- Электрокинетический потенциал уменьшится.
Рисунок 3 — Смещение границы ДЭС (пунктирные линии 1 и 2) и изменение кривой распределения потенциала в двойном электрическом слое (кривые 1 и 2) при добавлении индифферентного электролита.
При описании данной модели Гуи и Чапмену удалось сделать важное открытие — они смогли определить концентрацию электролита в объеме раствора с и потенциал поверхности φ0 в зависимости от плотности заряда η0. В уравнении количество ионов в слое Гуи, определяется уравнением Больцмана (2), также ионы были рассмотрены как точечные заряды. В присутствии нескольких электролитов в диффузном слое, объёмная плотность заряда ρ (Кл/м 3 ) на расстоянии х от поверхности:
или, с учетом уравнения Больцмана (2):
Если ДЭС считать плоским и учитывать изменение потенциала только по одной координате, х, то:
Подставив (4) в уравнение (5), получим уравнение Пуассона – Больцмана:
В основе данной модели лежит уравнение (6), так как из него можно получить уравнение, выражающее зависимость потенциала от свойств и концентрации электролита:
При двойном интегрировании уравнения (6) в пределах от 0 до х и от φ0 до φх, получаем:
С увеличением расстояния потенциал ДЭС уменьшается по кривой, это определяется уравнением (8).
Емкость ДЭС разделяют на:
- дифференциальную dη0/dφ0
- интегральную η0/φ0.
Недостатки модели Гуи-Чапмена:
- Не учитывала увеличение эффективности действия ионов при увеличении их радиуса;
- Не могла объяснить перезарядку ДЭС;
- Не подходит для определения ДЭС в концентрированных растворах.
Все эти недостатки были учтены в теории Штерна, которая стала новым этапом в развитии представлений о двойном электрическом слое.
3.3 Модель Штерна.
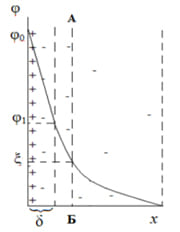
Дальнейшее изучение строения ДЭС проводил физик О.Штерн, который ввел два условия о его структуре:
- Ионы он представлял как частицы имеющие конечные радиусы;
- Учет энергии специфического адсорбционного притяжения противоионов к поверхности.
В своей схеме Штерн объединил две прошлые модели и ввел представления о плотном и диффузионном слое (рисунок 4). Часть противоионов, притягиваясь к заряженной потенциалопределяющими ионами поверхности электростатическими и адсорбционными силами, образует с потенциалопределяющими ионами плотный слой – плоский конденсатор. В плотном слое потенциал падает с расстоянием от поверхности практически по прямой, как в плоском конденсаторе. Остальные противоионы, в количестве необходимом для полной компенсации поверхностного заряда, образуют диффузный слой, в котором потенциал падает по экспоненте от φ1 до φ=0. Плоскость скольжения АБ расположена в диффузной части ДЭС.
Рисунок 4 — Схема строения двойного электрического слоя по модели Штерна
Уравнения (3) – (6) так же применимы и для модели Штерна, но возникает еще одно условие: функция расстояния х= δ описывает распределение противоионов.
После интегрирования уравнения Пуассона – Больцмана в этом случае справедливо уравнение:
Данные уравнения не берут во внимание адсорбционные силы, а выражение (9) называется уравнением Гуи. И если расстояние отсчитывать от начала диффузионного слоя ДЭС, то уравнение (8) преобразуется в:
С ростом температуры растет энергия теплового движения, а с увеличением диэлектрической проницаемости среды усиливается диссоциация электролитов. Оба фактора увеличивают толщину ДЭС.
В отсутствии электрического поля происходит перенос ионов на поверхность под влиянием адсорбционных сил, такое явление Штерн назвал адсорбционным потенциалом иона (Фi). Это считается главным достижением данной модели.
По модели Штерна плотный слой заряжается за счет заряда ионов при адсорбции:
- Электростатического адсорбционного потенциала zi Fφ1;
- Специфической адсорбции Фi.
При учете этих факторов Штерн вывел уравнение для плотного слоя Гельмгольца:
Таким образом, модель Штерна позволяет рассчитать заряд как в плотном, так и в диффузионном слое.
Модель Штерна позволила решить ряд вопросов, ответы на которые не смогли дать предыдущие теории строения ДЭС:
Зависимость структуры двойного слоя за счет введения не- и индифферентных электролитов;
- Зависимость от различного радиуса ионов;
- Дала понятие перезарядки.
3.4 Модель Грэма.
Грэм развил предыдущие модели и выделил три части в ДЭС (рисунок 5):
- Внутренний плотный слой (внутренняя плоскость Гельмгольца), образованная молекулами растворителя или активными поверхностными ионами. Если в этой плоскости находятся только молекулы растворителя, то заряд равен нулю, а если поверхностно-активные ионы -q1.
- Внешняя плоскость Гельмгольца. Ее общий заряд равен q2, а потенциал плоскости Ψ2;
- Диффузионный слой, в котором Ψ2 изменяется до нуля, а плотность заряда совпадает с q2.
Рисунок 5 — Строение ДЭС по Грэму: а) поверхность металла не заряжена; б) поверхность металла заряжена положительно; в) поверхность металла заряжена отрицательно.
В первой плоскости Гельмгольца находятся только специфически адсорбирующиеся анионы, причем их поверхностная концентрация растет при переходе от незаряженной поверхности (рисунок 5, а) к заряженной положительно (рисунок 5, б). При достаточно отрицательном заряде поверхности (рисунок 5, в) во внутреннем слое Гельмгольца остается лишь растворитель, и заряд его становится равным нулю. В этих условиях ДЭС электрически равен двум последовательно включенным конденсаторам.
Грэм разработал метод расчета кривых емкости ДЭС, где dη0/dφ0 при различных концентрациях электролита, так как он посчитал, что данная ёмкость будет зависеть не от концентрации раствора.
Таким образом модель Грэма может рассматриваться как модель, отражающая основные черты и особенности структуры ДЭС «металл – электролит».
3.5 Модель Фрумкина при адсорбции органических веществ.
Модель Фрумкина была разработана в 1926 году, она была рассмотрена в целях определения формы электрокаппилярных кривых и влияния органических веществ на ДЭС.
Адсорбцию органических соединений можно рассматривать как замену в двойном слое воды на органическое вещество. Так как размеры органических молекул больше, чем молекул воды, то, как это следует из теории плоского конденсатора, удельная емкость воды будет больше емкости исходного вещества в растворе, такая замена вызывает необходимость отвода заряда с обкладок конденсатора.
В случае перехода от исходного раствора к раствору с органическим веществом возникает разность потенциала равная сдвигу потенциала на электрокаппилярной кривой. Все это происходит так как молекулы органического вещества обладают дипольным моментом.
По версии Фрумкина в данном случае двойной слой напоминает два параллельно присоединенных конденсатора (это является одним из его исходных положений). В одном из конденсаторов будет находиться вода, между обкладками, а у другого – органические вещества. Другое положение теории связано с выбором изотермы адсорбции.
В качестве еще одного исходного предположения Фрумкин допускает, что адсорбция органического вещества подчиняется уравнению Ленгмюра:
В согласии с законом распределения Больцмана, можно записать в виде:
Из основного уравнения электрокаппилярности следует, что снижение пограничного натяжения σ под влиянием адсорбции органического вещества при данном δ равно:
Из данных уравнений Фрумкин вывел уравнение новой изотермы:
Bc=θ/(1-θ) exp(-2aθ) (15)
а – константа аттракционного взаимодействия.
Полученное уравнение назвали изотермой Фрумкина.
3.6 Модель Алексеева–Попова–Колотыркина (АПК).
На случай смешанных растворов была разработана модель Алексеева – Попова – Колотыркина типа:
где:
A* — — – поверхностно-активный анион, снижающий емкость плотного слоя по сравнению с той, которая наблюдается в присутствии поверхностно-неактивного аниона A — .
В 60-х годах ХХ века Пейн сделал открытие, которое не описывалось ни одним физическим явлением. В системах типа нитрата калия зависимость энергии от заряда носила линейный характер, но, если рассмотреть границу Hg/H2О (xM NH4NO3 + (1–x)M NH4F), то можно было увидеть, что эта зависимость приобретала параболический вид.
После 20 лет попыток решения этой проблемы был дан ответ. В смешенных растворах выделяют скачок потенциала, а не заряд электрода. Это легло в основу модели АПК.
В смешанных растворах с постоянной ионной силой типа:
где:
A* — и A — – соответственно поверхностно-активный и поверхностно-неактивный анионы.
Анионы A* — вытесняются из ДЭС только в том случае, когда емкость адсорбированных частиц больше емкости свободных частиц, но если эти емкости равны, то энергия будет иметь линейную зависимость.
При значениях m выше m≤0.2, отсутствуют экспериментальные данные для количественного определения адсорбции ионов.
При использовании модели АПК некоторые параметры находят из экспериментальных данных. При этом она очень хорошо описывает некоторые свойства ДЭС при специфической адсорбции, но только на идеально поляризуемых электродах.
4. Влияние различных факторов на структуру ДЭС.
4.1 Влияние индифферентных и неиндифферентных электролитов.
Влияние концентрации индифферентного электролита на структуру ДЭС показано в разделе 3.2. При увеличении концентрации электролита увеличивается заряд противоионов, это приводит к уменьшению ξпотенциала. Учитывая все это уравнение (9) преобразуется в:
Уравнение (17) показывает, что при неизменном заряде поверхности η0 увеличение концентрации индифферентного электролита с и заряда противоионов z приводит к снижению потенциала φ1. При этом происходит уменьшение диффузионного слоя, снижение ξ-потенциала.
Неиндифферентным электролитом называют электролит, в котором хотя бы один ион может влиять на потенциал поверхности φ0, то такой ион будет называться потенциалопределяющим. При увеличении заряда поверхности η0, то также повышается и ξ-потенциал. Появление этих двух факторов приводит к зависимости ξ-потенциала от с: при малых с главным фактором является рост адсорбции потенциалопределяющих ионов, η0 и ξ-потенциал растут, затем наступает насыщение поверхности, рост заряда прекращается и главным фактором выступает сжатие диффузного слоя за счет повышения концентрации противоионов, ξ-потенциал уменьшается.
4.2 Явление перезарядки ДЭС под влиянием многозарядных противоионов.
Явление перезарядки ДЭС возникает в плотном слое посредством того, что многозарядные анионы могут превысить заряд потенциалопределяющих ионов. Так как происходит перезарядка, то потенциалы в двух слоях ДЭС приобретают отличные друг от друга знаки. Так как происходит смена знаков потенциалов, то изменяется и ξ-потенциал. Вследствие этого явления изменяется направление движения частиц дисперсной фазы.
4.3 Влияние температуры, рН и других факторов.
Увеличение температуры приведет к нескольким факторам:
- Произойдет увеличение теплового движения, следовательно, так же увеличиться и толщина слоя Гуи;
- При увеличении температуры может произойти удаление адсорбированного ионов с поверхности из-за этого произойдет снижение потенциалов.
Если частицы образованы веществом, проявляющим кислотные или основные свойства, то в качестве потенциалопределяющих ионов могут выступать ионы Н + или ОН — , в зависимости от рН среды. Высокая адсорбционная способность ионов Н + (из-за малого радиуса) и ОН — (из-за большого дипольного момента) определяет влияние рН на φ0. При адсорбции этих ионов из раствора ξ-потенциал растет за счет увеличения заряда поверхности и потенциала φ0. Особо велико влияние рН среды в тех случаях, когда вещество твердой фазы обладает амфотерными свойствами. В этом случае при изменении рН возможна перезарядка поверхности.
5. Заключение.
Первой теорией строения ДЭС была теория Гельмгольца – Перрена: ДЭС состоит из двух плоских зарядов и взаимодействующих между собой только за счет электростатических сил притяжения. Структура подобна плоскому конденсатору, падение потенциала между слоями происходит линейно.
Модель Гуи – Чэпмена предполагала диффузное расположение противоионов, находящихся под воздействием сил, действующих в противоположных направлениях: электростатических сил притяжения и сил теплового движения ионов, приводящих к диффузии и размыванию внешнего слоя. Теория вводит понятие диффузионного слоя, ионы рассматриваются как точечные заряды, не имеющие собственных размеров.
По теории Штерна строение ДЭС представляется следующим образом: ионы входящие в состав твердой фазы, образуют внутреннюю обкладку двойного слоя; ионы противоположного знака образуют внешнюю обкладку, при этом часть противоионов находится в непосредственном соприкосновении с ионами твердой фазы, образуя плотный слой, другая часть — диффузионный слой.
Грэм усовершенствовал модель Штерна и разделил ДЭС на три части: внутренний плотный слой, или же внутренняя плоскость Гельмгольца, внешний плотный слой и диффузионный слой. В этом случае ДЭС представляется в виде двух последовательно соединенных конденсаторов.
Фрумкин изучал строение ДЭС при адсорбции органических соединений. В этом случае ДЭС представлял собой два параллельно подсоединенных между собой конденсатора, в одном из них между обкладками находятся молекулы воды, в другом – молекулы органического вещества.
http://poisk-ru.ru/s212t10.html
http://zctc.ru/sections/stroyeniye_dvoynogo_electrichesogo_sloya_des_1