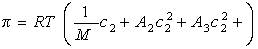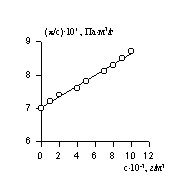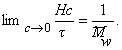5.2.2. Методы определения молекулярной массы полимеров по свойствам растворов
Свойства растворов
Наиболее часто среднечисленную молекулярную массу 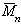
Молекулярная масса определяется как коэффициент, связывающий весовую и частичную концентрации
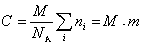
где С – весовая концентрация, г/см 3 ; 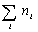
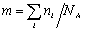
Таким образом, задача сводится к определению мольной концентрации раствора известной весовой концентрации.
Стремление молекул растворителя к самопроизвольному проникновению через мембрану определяется разностью химических потенциалов растворителя в частях системы, разделенных перегородкой, причем 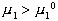
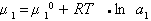
где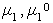
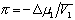
где 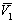
Связь между осмотическим давлением и весовой концентрацией растворов описывается следующими уравнениями:
(уравнение Вант-Гоффа) для растворов низкомолекулярных веществ
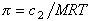
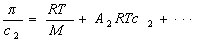
где А2 – второй вириальный коэффициент, характеризующий взаимодействие полимера с растворителем и форму макромолекул в растворе, обычно А3®0.
Величина p /c2 носит название приведенного осмотического давления. На рис. 2.50 показан пример зависимости приведенного осмотического давления для растворов полимера в различных растворителях. Чем больше наклон прямых, тем сильнее проявляется взаимодействие между компонентами раствора и тем больше величина
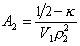
где k- параметр взаимодействия, r2 – плотность полимера в растворе, V1 – мольный объём растворителя.
При k = 0,5 А2 =0 и раствор ведет себя как идеальный. Таким образом, определяя наклон зависимости p /c2 = fc2 , можно охарактеризовать сродство компонентов раствора. Величина молекулярной массы определяется как
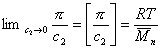
Найденная из измерений осмотического давления молекулярная масса характеризует 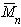
Метод светорассеяния. Среднемассовая молекулярная масса
Явление светорассеяния в растворах полимеров наблюдается в том случае, если размер макромолекул менее l/2 — половины длины волны проходящего света. Существуют различные теории рассеяния света, положенные в основу расчетных уравнений экспериментальных методов определения молекулярной массы. При условии, что размер молекул полимера меньше l/2, для растворов полимеров справедлива теория рассеяния света Эйнштейна.
Если рассеяние света происходит на сферических частицах, то интенсивность рассеяния будет одинаковой во всех направлениях. Обозначим угол, под которым по отношению к падающему лучу определяется интенсивность рассеянного света, Q. Рассеивающая способность характеризуется коэффициентом рассеяния R:
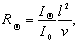
где IQ, I0— интенсивность рассеянного и падающего света; l– расстояние, на котором наблюдается рассеянный свет от рассеивающего объёма; v – рассеивающий объём.
В практике определения интенсивности рассеянного света наиболее часто определяется R90, т.е. рассеяние света под углом 90 o , хотя с помощью современных приборов, особенно использующих в качестве источника света лазер, можно определять интенсивность рассеянного света от Q = 4 o .
Для расчета молекулярной массы полимеров используется уравнение Дебая:
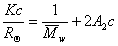
где с – весовая концентрация, г/см 3 ; K – оптическая постоянная, зависящая от коэффициента преломления среды (n0), концентрационного инкремента коэффициента преломления раствора (dn/dc) и длины волны света l,
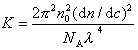
Таким образом для определения молекулярной массы следует измерять угловое рассеяние света, коэффициент преломления среды. Особенно тщательно следует определять (dn/dc), так как эта величина обычно чрезвычайно мала. Следует привлекать приборы, позволяющие определить коэффициент преломления с точностью до 6-го знака.
По аналогии с поглощением света можем записать для интенсивности рассеяния
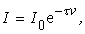
гдеt – мутность 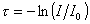
Мутность связана с коэффициентом рассеяния соотношением
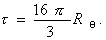
Поэтому, с учетом уравнения (2.5.19), можно проводить расчет молекулярной массы по уравнению
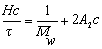
где Н – оптическая постоянная, Н = 16p K/3.
Для расчета молекулярной массы определяется величина
По углу наклона можно определить значение А2 и охарактеризовать взаимодействие компонентов раствора. Изменение температуры, замена растворителя могут вызвать изменение межмолекулярного взаимодействия компонентов раствора и формы макромолекул в растворе.
Молекулы могут приобретать и асимметрическую форму. В этом случае рассеяние света под разными углами к падающему лучу будет неравномерным и найденное значение молекулярной массы содержит погрешность. Поэтому необходимо вводить поправку на внутреннюю интерференцию света, появляющуюся в результате рассеяния света с некоторой разностью фаз от различных участков молекул. Для введения поправок существуют два основных метода: метод Дебая и метод Зимма.
Метод Дебая основан на измерении интенсивности рассеянного света при значении углов рассеяния, равных 135 и 45 o , соответственно R45 и R135. Отношение интенсивности равно отношению поправок Р и называется коэффициентом асимметрии
Величина z зависит от концентрации раствора, так как форма макромолекул в растворе может изменяться с увеличением концентрации. Для определения истинного значения z строят зависимость 1/(z-1)=fс и определяют 1/([z]-1) = limс®0 1/(z-1).
Зная z,по существующим таблицам находят величину Р, которую вводят в расчетное уравнение
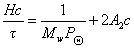
Метод Зимма основан на построении специальной диаграммы, на которой по оси абсцисс откладывается и концентрация, и угол рассеяния света. Линии на диаграмме образуют два семейства параллельных (практически прямых) линий. Более крутые линии представляют собой зависимость рассеяния света от концентрации растворов. Более пологие – зависимость рассеяния света от угла определения. Нижняя линия соответствует рассеянию света при с = 0, крайняя левая — дает совокупность точек при sin Q/2 =0. Обе прямые пересекаются с осью ординат в точке, характеризующей 
Для определения молекулярной массы полимеров можно измерять коэффициент диффузии растворенного вещества. Если представить, что макромолекулы имеют узкое распределение по молекулярной массе и каждая молекула не взаимодействует с другими молекулами полимера, то для молекулы, перемещающейся вдали от стенки сосуда, сила трения со средой может быть описана выражением
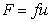
где F- сила трения; u – скорость перемещения молекулы; f =6ph0r- коэффициент трения сферических частиц; h0 – вязкость растворителя; r – радиус макромолекулы в растворе.
Уравнение (2.5.26) справедливо при скорости перемещения макромолекул 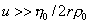
Предполагая применимость уравнения Эйнштейна для диффузии полимерных молекул в растворе, запишем
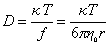
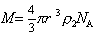
Сочетание (2.5.27) и (2.5.28) дает
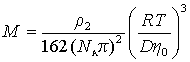
Cущественную ошибку может внести в расчет использование в качестве r2 значения плотности полимера, так как в растворе плотность макромолекул может значительно отличаться от плотности “сухого” полимера. Поэтому следует использовать значение 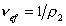
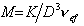
где vef— это тот удельный объём, который занимают макромолекулы в растворе, см 3 /г, учитывающий взаимодействие макромолекул в растворителе.
Вискозиметрический метод определенияvef и 
Существуют несколько уравнений, связывающих вязкость растворов полимеров с их концентрацией. Уравнение Симха для сферических частиц связывает удельную вязкость с объёмной концентрацией полимера:
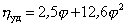
где j – объёмная доля, занимаемая полимером, 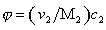
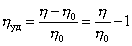
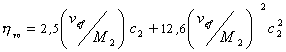
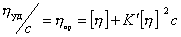
где 
Уравнение (2.5.33) носит название уравнения Хаггинса, K’ – постоянная Хаггинса, характеризующая форму макромолекул в растворе. Для сферических макромолекул K’ = 2, для эллипсоид-
ных K’ = 2¸10; для игольчатых форм K’ 2 x – ускорение центробежного поля, w – угловая скорость вращения; x – расстояние от молекулы до центра вращения; mh – масса одной сольватированной молекулы; vh – объем одной молекулы, r0 — плотность растворителя, vhr0 – поправка на выталкивающую силу.
Масса одной сольватированной молекулы, в соответствии с концепцией сольватированной частицы Онслея, определяется как
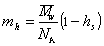
Объем одной сольватированной макромолекулы
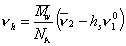
где v2— парциальный удельный объем макромолекул, см 3 /г; hsv1 0 — поправка на объем связанного растворителя; v1 0 = 1/r0 – — удельный объем растворителя, см 3 /г.
С учетом (2.5.36) и (2.5.37) запишем уравнение (2.5.35) в виде
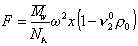
Можно видеть, что величина сольватации hs исключается из расчетного уравнения. Сила трения, уравновешивающая центробежную силу в стационарном режиме,
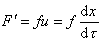
Из условия стационарности F= F’, следовательно,
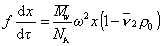
Для перехода от дифференциальной формы уравнения к интегральной Сведберг предложил использовать понятие постоянной седиментации
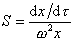
характеризующей скорость осаждения макромолекул под действием единицы центробежного поля. Эта постоянная зависит только от свойств макромолекул.
Коэффициент трения может быть определен из измерения коэффициента диффузии по уравнению Эйнштейна
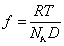

Уравнение (2.5.42) носит название уравнения Сведберга. Коэффициент диффузии D и коэффициент седиментации s определяются независимо. Для исключения эффекта взаимодействия макромолекул значение s экстраполируют к бесконечно малой концентрации и в расчетах используют значение s0.
Метод седиментации позволяет наиболее точно определить значение молекулярной массы полимера, так как здесь не надо определять или предполагать форму макромолекул, а величина сольватации исключается из расчетного уравнения. Экспериментально установлено, что
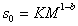
гдеK и b – постоянные, для многих полимеров приведенные в таблицах. Поэтому после калибровки постоянных уравнение (2.5.43) можно использовать для определения молекулярной массы без привлечения диффузионных измерений.
Определение средней молекулярной массы методом
По этому методу не проводят осаждения полимера, а ведут процесс только до установления равновесия между седиментацией и диффузией.
Для седиментационного потока
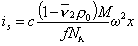
Для диффузионного потока
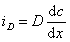
При седиментационно-диффузионном равновесии iD= is, следовательно,
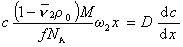
После преобразования с учетом D = kT/f и kNА=R получаем
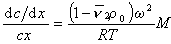
Откуда после интегрирования
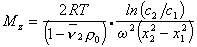
Таким образом достаточно определить значения концентрации раствора в двух точках кюветы чтобы рассчитать значение Mz . Этот метод носит название метода Арчибальда. Можно проводить расчет и по неустановившемуся равновесию, что значительно сокращает время эксперимента, но усложняет расчет.
Кроме определения молекулярной массы метод седиментационного ультрацентрифугирования в сочетании с вискозиметрией позволяет охарактеризовать форму макромолекул в растворе, определяя фактор Шераги — Манделькерна b, который для сферических частиц равен b = 2,12×10 6 .
Расчет проводится по формуле
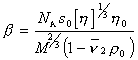
где s0 – коэффициент седиментации, экстраполированный к бесконечному разбавлению; [h] – характеристическая вязкость;h0 – вязкость растворителя.
Определение молекулярной массы полимера по характеристической вязкости. Уравнение Марка-Куна-Хаувинка.
Ограниченное, неограниченное набухание ВМС (полимеров)
Растворению предшествует набухание ВМС – еще одно уникальное свойство, присущее только им. При контакте ВМС и
растворителя начинается абсорбция. Молекулы растворителя диффундируют внутрь полимера, поглощаются его объемом. Они располагаются между макромолекулами, раздвигают их, что увеличивает подвижность цепей. Усиливается мелкомасштабное движение. Набухание будет продолжаться до тех пор, пока макромолекулы не получат возможность для крупномасштабного движения и тогда произойдет растворение.
При набухании ВМС увеличивается объем и масса образца.
Количественной мерой набухания служит степень набухания a
где m и m 0 – массы набухшего и исходного образца ВМС.
В зависимости от структуры ВМС, свойств растворителя и температуры набухание может быть ограниченным или неограниченным. При ограниченном набухании величина a сначала растет во времени, затем достигает предельного значения и дальше от времени не зависит. Так набухает желатин в холодной воде или резина в бензине.
Неограниченное набухание — это набухание, заканчивающееся растворением: полимер сначала поглощает жидкость, а затем при той же температуре переходит в раствор, образуя однофазную гомогенную систему. Так набухают натуральный и синтетический каучук в углеводородах, нитроцеллюлоза – в ацетоне.
6. По характеру вязкого течения жидкостные дисперсные системы делятся на две группы:
1) бесструктурные системы, частицы которых более или менее свободны и почти не взаимодействуют друг с другом (растворы низкомолекулярных веществ, разбавленные эмульсии, суспензии и золи);
2) структурированные системы — содержат частицы, взаимодействующие друг с другом и с дисперсионной средой (растворы ВМС, концентрированные эмульсии и суспензии). Системы первой группы подчиняются законам Пуазейля и Ньютона: количество жидкости, протекающей через капилляр в единицу времени, изменяется прямо пропорционально давлению, а коэффициент вязкости является величиной постоянной и не зависит от градиента скорости или давления, приложенного к капиллярному вискозиметру.
Вязкость– это внутреннее трение между слоями жидкости или газа, которое возникает когда слои движутся с разными скоростями. Вязкость (η) является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы молекулярного притяжения. Поэтому вязкость полярных веществ всегда больше, чем неполярных.
Вязкость (η) является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы молекулярного притяжения. Поэтому вязкость полярных веществ всегда больше, чем неполярных. Зависимость реологических свойств от различных факторов выражают графически в виде реологических кривых (кривых течения): η = f (P) или v = f(P), где v – скорость сдвигового течения жидкости; P — напряжение сдвига (аналог – давление).Для жидкостей характерны два основных типа течения: ламинарное и турбулентное. Ламинарным называют течение жидкости в виде параллельных слоев, не перемешивающихся между собой. Примером ламинарно текущей жидкости может служить спокойная равнинная река. Турбулентное течение – это бурное течение, сопровождающееся образованием завихрений, воронок и взаимным перемешиванием слоев жидкости.
Уравнение Пуазейля и его применение для каппилярной вискозиметрии.
Закон Пуазейля связывает объем протекающей через капилляр жидкости V за время t с вязкостью
где К – константа, зависящая от геометрии капилляра, а Р здесь –давление на конце капилляра. Закон Пуазейля позволяет характеризовать вязкость по времени истечения определенного объема жидкости через капилляр. Это – принцип действия капиллярных вискозиметров.
Определение молекулярной массы полимера по характеристической вязкости. Уравнение Марка-Куна-Хаувинка.
Характерной особенностью растворов полимеров является их высокая вязкость даже при очень больших разбавлениях.
Для вычисления молекулярной массы используют более точное уравнение Марка–Куна–Хаувинка которое учитывает изменение гибкости макромолекул с изменением молекулярной массы. Величина a характеризует форму молекулы полимера в растворе, которая связана с гибкостью цепей, а константа К, как и ранее, постоянна для данного
гомологического ряда. Таким образом, для каждой пары полимер – растворитель характерны свои значения К и a. При увеличении жесткости макромолекул величина a приближается к единице и уравнение Марка–Куна–Хаувинка переходит в уравнение Штаудингера и дальше – в уравнение Эйнштейна.
Лекция №15.
План лекции:
Строение макромолекул
Основным признаком соединений является их высокая молекулярная масса, а, следовательно, и их большой размер молекул.
Свойства таких соединений зависят не только от химического состава, но также от размеров и формы больших молекул, называемых обычно макромолекулами.
Три основных типа молекул ВМС : линейная, плоская (двухмерная) и пространственная (трехмерная).
Свойства линейных макромолекул
К этому типу относится подавляющее большинство природных и искусственно получаемых ВМС. Такая форма отвечает наименьшей потенциальной энергии молекул.
Часто цепи дают ответвления и тогда они называются разветвленными цепями (б). В этом случае макромолекулу геометрически можно отнести к типу двухмерных молекул.
В более редких случаях однородные линейные макромолекулы под влиянием изменения внешних условий (например, температуры и давления) или добавок посторонних веществ могут вступать друг с другом в химическую (валентную) связь, устанавливающуюся в отдельных участках цепи на ее длине в виде “мостов” или “перемычек” (в). Такие молекулы получили название “сшитых” молекул (“сшитых” структур). Так как такое “сшивание” происходит в пространстве, то макромолекулы становятся трехмерными образованиями и превращаются в жесткие системы с характерными для них свойствами (нерастворимостью, отсутствием плавкости, эластичности, пластичности и пр.) Типичными ВМС с трехмерными молекулами являются фенолформальдегидные смолы.
Длина цепочного типа макромолекул при наличии в них десятков тысяч атомов может достигать нескольких тысяч ангстрем.
От формы и строения макромолекул зависят и другие свойства ВМС — осмотическое давление, способность к набуханию, вязкость.
Все молекулярные вещества, вследствие их большого молекулярного веса, нелетучи и не способны перегоняться.
Влияние температуры на структуру ВМС
Межмолекулярные силы, действующие между отдельными атомами и их группами, препятствуют изменению формы макромолекул. Чтобы изменить форму макромолекул, надо преодолеть действие межмолекулярных сил, что сопряжено с затратой определенного количества энергии. С повышением температуры растет энергия макромолекул, причем энергия теплового движения может оказаться больше энергии взаимодействия молекул друг с другом, в результате чего вероятность изменения конфигурации и взаимного расположения молекул увеличивается. Наоборот, при охлаждении полимера перегруппировка макромолекул практически прекращается: в результате, полимер остается по своей неупорядоченной структуре в аморфно- жидком состоянии и при температурах значительно ниже температуры кристаллизации. Таким образом, даже при сильном охлаждении высокополимеры не переходят в упорядоченное (кристаллическое) состояние. В этом ВМС сходны со стеклами и такое состояние высокополимера называется стеклообразным. Процесс застекловывания идет часто в довольно значительном температурном интервале. Та температурная область, в которой происходит такой переход, называется температурой перехода, в частности для явления застекловывания она называется температурой застекловывания.
Выше температуры застекловывания полимер начинает переходить из стеклообразного состояния в высокоэластичное и сохраняет его при дальнейшем нагревании до некоторой температуры, называемой температурой текучести. Выше этой температуры у полимера появляется необратимое и самопроизвольное перемещение макромолекул относительно друг друга (текучесть).
Способность к течению высокомолекулярных веществ при повышении температуры используется в технике для смешения каучуков и пластиков с инградиентами и для формирования изделий из пластмасс прессованием.
Не все аморфные ВМС могут находиться во всех трех указанных состояниях.
Общая характеристика растворов высокомолекулярных соединений
Растворы ВМС термодинамически устойчивы и при соответствующих предосторожностях могут существовать сколько угодно долго. При растворении ВМС всегда образуется гомогенная система, причем, растворение сопровождается уменьшением термодинамического потенциала. Коллоидные растворы, наоборот термодинамически неустойчивы и способны стареть.
Растворение ВМС не требует присутствия в системе стабилизатора. Наконец, растворы ВМС находятся в термодинамическом равновесии и являются обратимыми системами. К таким системам применимо правило фаз Гиббса (в отличие от коллоидных систем).
Следует также учитывать, что равновесное состояние в растворах высокомолекулярных веществ устанавливается медленно.
Для растворов ВМС характерны три группы свойств. Первые две присущи истинным и коллоидным растворам, а третья группа характерна только для растворов ВМС: набухание и студнеобразование.
Характеристика первой и второй группы свойств
Растворам ВМС присуще осмотическое давление, которое вычисляется по формуле:
p = (с/М) R Т + b с 2 (15.1)
с, М — концентрация и молекулярная масса ВМС, b — второй вириальный коэффициент (отражает флуктуацию конформационных линейных структур макромолекул)
Разделим левую и правую части уравнения на концентрацию:
p /с = R Т/М + b с (15.2)
Величина p /с — приведенное осмотическое давление. Для идеальных растворов и большинства коллоидных растворов величина приведенного осмотического давления постоянна и не зависит от концентрации. Для растворов ВМС эта величина зависит от концентрации ВМС (что и отражено в уравнении 15.2).
В координатах “ p /с — с” уравнение 15.2 является уравнением прямой, тангенс угла наклона которой равен коэффициенту b , а отрезок, отсекаемый этой прямой на оси ординат соответствует величине R Т/М.
Таким образом, по значению осмотического давления можно определить молекулярную массу макромолекулы растворенного ВМС.
Вязкость растворов ВМС зависит от концентрации вещества в растворе. В отличие от других растворов незначительная концентрация ВМС порой приводит к значительному увеличению вязкости раствора.
Вязкость растворов ВМС зависит от условий определения, в частности, от давления. Это объясняется тем, что одни и те же макромолекулы могут находиться в различных конформационных состояниях: от линейных до глобул, поэтому вязкость растворов ВМС может быть неодинакова в различных направлениях. Вязкость макромолекул с выпрямленными хаотично расположенными звеньями выше, чем вязкость макромолекул, которые имеют форму клубка.
Если вязкий полимер или его раствор продавить через капилляр, то молекулы будет выпрямляться и располагаться ориентированно, а вязкость будет снижаться.
Вязкость растворов ВМС зависит также от свойств и температуры растворителя.
Для растворов ВМС различают относительную, удельную, приведенную и характеристическую вязкости.
Относительная вязкость — отношение вязкости раствора h р к вязкости растворителя h 0 :
t р время истечения раствора ВМС, t 0 — время истечения растворителя(эти величины определяются с помощью вискозиметра).
Удельная вязкость — показывает, насколько увеличилась вязкость раствора ВМС по сравнению с вязкостью растворителя:
Приведенная вязкость — отношение удельной вязкости к концентрации:
Обычно приведенная вязкость линейно зависит от концентрации (рис.15.2).При экстраполяции прямой до пересечения с осью ординат получают величину / h /, которую называют характеристической вязкостью:
/ h / = l i m h уд /с (15.6)
SHAPE \* MERGEFORMAT
Рис.15.2.Изменение приведенной вязкости в зависимости от концентрации ВМС.
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значение относительной, удельной и приведенной вязкостей.
Характеристическая вязкость для данной пары веществ является величиной условной, но постоянной, она не зависит от концентрации растворителя и состояния макромолекул, кроме того, она связана с молекулярной массой макромолекул.
/ h / = k М а , l g / h / = l g k + а l g М (15.7)
М — средняя молекулярная масса ВМС, а, k — коэффициенты.
Уравнение 15.7 — уравнение Марка-Куна-Хаувинка.
Для растворов полимеров с короткими и жесткими цепями а = 1 и уравнение 15.7 упрощается:
/ h / = k М, l g / h / = l g k + l g М (15.8)
Коэффициент a зависит от формы молекул. Значение коэффициентов определяют экспериментально, это позволяет по значению характеристической вязкости рассчитать молекулярную массу макромолекул. Зная массу, можно определить средний размер r макромолекул:
http://lektsii.org/9-46784.html
http://www.trotted.narod.ru/collchem/lec-15.htm