Мембранный транспорт. Лекция 7 Ж (1). Физические процессы в биологических мембранах
| Название | Физические процессы в биологических мембранах |
| Анкор | Мембранный транспорт |
| Дата | 08.11.2021 |
| Размер | 0.7 Mb. |
| Формат файла |  |
| Имя файла | Лекция 7 Ж (1).doc |
| Тип | Лекция #266686 |
| страница | 2 из 2 |
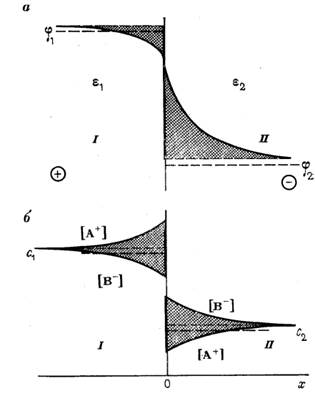
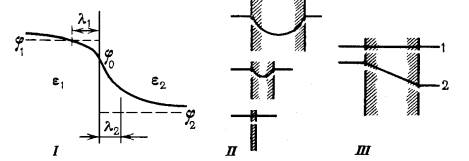
| Подборка по базе: Переходные процессы вариант 14 -1.docx, Термические процессы переработки нефти и газа.pdf, Лекция ГОСТ Р ИСО_МЭК 12207. Основные процессы и взаимосвязь меж, Лекция ГОСТ Р ИСО_МЭК 12207. Основные процессы и взаимосвязь меж, ОСТ 36-28-78 Система стандартов безопасности труда. Процессы про, Базовые информационные процессы.docx, Опасные природные процессы Солодовникова.docx, Общие проблемы малой группы. Динамические процессы в малой групп, Романов. Д.В. Базовые информационные процессы и технологии_ИК.do, ПК_ПЛАН-КОНСПЕКТ ФИЗИЧЕСКИЕ КАЧЕСТВА В БАДМИНТОНЕ.docx Как известно , на мембране существует разность потенциалов, следовательно, в мембране имеется электрическое поле. Оно ока зывает влияние на диффузию заряженных частиц (ионов и элект ронов). Между напряженностью поля Е и градиентом потенциала d / dx существует известное соотношение (см. § 12.1): Заряд иона равен Ze. На один ион действует сила Скорость направленного движения ионов пропорциональна дей ствующей силе [см. (11.4), (11.5)]: Чтобы найти поток вещества (ионов), выделим объем электролита (рис. 11.12) в виде прямоугольного параллелепипеда с ребром, численно равным скорости ионов. Все ионы, находящиеся в параллелепипе де, за 1 с пройдут через площадку S . Это и будет поток Ф. Число молей этих ионов можно найти, умножая объем параллелепипеда ( S ) на молярную концентрацию ионов с: Плотность потока вещества найдем, используя формулы (11.24) и (11.25): В общем случае перенос ионов определяется двумя факторами: неравномерностью их распределения, т.е. градиентом концентра ции [см. (11.11)], и воздействием электрического поля [см. (11.26)]: Это уравнение Нернста — Планка. Используя выражение для подвижности (11.12), преобразуем уравнение (11.27) к виду Это другая форма записи уравнения Нернста—Планка. Используем уравнение Нернста—Планка для установления за висимости плотности диффузионного потока от концентрации ионов и от напряженности электрического поля. Предположим, система находится в стационарном состоянии, т. е. плотность потока J постоянна. Электрическое поле в мембране примем за од нородное, следовательно, напряженность поля одинакова, а по тенциал линейно изменяется с расстоянием. Это позволит счи тать, что — вспомогательная величина (безразмерный потенциал). С учет ом (11.29) получим уравнение Нернста—Планка в виде: Разделим переменные и проинтегрируем уравнение: Вообще говоря, формула (11.33) справедлива как для положи тельных ( Z > 0, > 0), так и для отрицательных ( Z 0, ионов. Однако для отрицательных ионов целесообразно видоизме нить это выражение, подставив в него отрицательное значение безразмерного потенциала: Разделим числитель и знаменатель этого выражения на е — : При использовании этой формулы необходимо помнить, что отри цательные значения Z и уже учтены в самой формуле, т. е. — положительная величина. Уравнения (11.33) и (11.34) устанавливают связь плотности стационарного потока ионов с тремя величинами: 1) проницаемо стью мембран для данного иона, которая характеризует взаимо действие мембранных структур с ионом; 2) электрическим полем; 3) молярной концентрацией ионов в водном растворе, окружаю щем мембрану (ciи c0). Проанализируем частные случаи уравнения (11.33): а) = 0, что означает либо Z = 0 (нейтральные частицы), либо отсутствие электрического поля в мембране ( м = 0), либо и то, и другое: Найдем пределы отдельных сомножителей. Эту неопределенность можно раскрыть по пра вилу Лопиталя: Отсюда получаем, как и следовало ожидать, уравнение (11.21): б) одинаковая молярная концентрация ионов по разные сторо ны от мембраны ( c i = с 0 = с ) при наличии электрического поля: Это соответствует электропроводимости в электролите (см. § 12.9). Для нейтральных частиц ( Z = 0 и = 0) J = 0; в) если мембрана непроницаема для частиц (Р = 0), то, естест венно, плотность потока равна нулю. Явления переноса (см.§ 11.3 и §11.4) относятся к пассивному транспорту: диффузия молекул и ионов в направлении их мень шей концентрации, перемещение ионов в соответствии с направле нием силы, действующей на них со стороны электрического поля. Пассивный транспорт не связан с затратой химической энергии. Наиболее общая классификации видов пассивного транспорта веществ через мембрану включает в себя простую диффузию, диф фузию через поры и диффузию с переносчиком. Простая диффузия через липидный бислой подчиняется урав нению Фика для молекул (11.21) или, в более общем случае для нейтральных и заряженных частиц, — уравнению Нернста— Планка (11.28). В живой клетке такая диффузия обеспечивает прохождение кислорода и углекислого газа (см. рис. 11.13, а). Ряд жирорастворимых лекарственных веществ и ядов также про никает через липидный бислой по схеме, изображенной на рисун ке. Как уже отмечалось в § 11.1, определенная конфигурация ли пидов способствует диффузии поперек мембраны благодаря пере мещению «кинков». Однако подобная простая диффузия протекает достаточно мед ленно и не может снабдить клетку в нужном количестве питатель ными веществами. Поэтому есть иные механизмы пассивного пе реноса веществ через мембрану, к ним относятся диффузия через канал (пору) и диффузия в комплексе с переносчиком. Два по следних варианта называют иногда облегченной диффузией (рис. 11.13, б, в). Порой или каналом называют участок мембраны, включаю щий липидные или белковые молекулы и образующий в мембране проход (см. рис. 11.13, б). Этот канал допускает проникновение через мембрану не только малых молекул, например, молекул во ды, кислорода, но и более крупных ионов. Диффузия через поры также описывается диффузионными уравнениями, однако нали чие пор увеличивает коэффициент проницаемости Р. Каналы могут проявлять селективность (избирательность) по отношению к разным ионам, это проявится и в различии проницаемости для разных ионов. Еще одно «облегчение» диффузии — перенос ионов специаль ными молекулами-переносчиками (см. рис. 11.13, в). При этом пе реносчик может быть подвижным либо неподвижным. Так, антибиотик валиномицин при связывании с ионом калия образует рас творимый в липидах комплекс и проходит через мембрану. Молекулы другого антибиотика, грамицидина, образуют времен ную цепочку поперек мембраны и «по эстафете» передают перено симое через мембрану вещество (ионы натрия) от одной молекулы переносчика к другой. За способность переносить ионы через мембраны валиномицин, грамицидин и другие переносчики получили название ионофоров. Следует отметить, что диффузия комплекса переносчика и иона также описывается общим уравнением диффузии, посколь ку облегченная диффузия происходит от мест с большей концент рацией диффундирующего вещества к местам с меньшей концент рацией. Вывод о том, что имеет место облегченная диффузия, по зволяют сделать некоторые особенности, отличающие ее от простой. Во-первых, перенос вещества с помощью переносчика любого типа идет с существенно большими скоростями, по сравнению с простой диффузией. Во-вторых, для облегченной диффузии ха рактерно «насыщение», когда с увеличением концентрации дан ного вещества с одной стороны мембраны плотность его потока становится больше только до определенного предела, зависящего от количества молекул переносчика. Наконец, при облегченной диффузии возможна конкуренция близких по структуре веществ за связывание с молекулой переносчика. Наряду с пассивным транспортом в мембранах клетки проис ходит перенос молекул в область большей концентрации, а ионов — против силы, действующей на них со стороны электрического по ля. Такая разновидность переноса поручила название активного транспорта. Если пассивный транспорт может происходить в любых полупроницаемых мембранах, как биологических, так и искусственных, то активный транспорт присущ только биологи ческим мембранам. Благодаря активному транспорту сохраняет ся пространственная неоднородность в клетке (отличие внутри клеточной среды от внеклеточного пространства), создаются и поддерживаются градиенты концентраций, электрических потен циалов и т. д. Активный перенос веществ через мембрану осу ществляется за счет энергии гидролиза молекул (АТФ). С В результате пассивного транспорта ионы натрия диффундиру ют из наружного раствора в кожу. При этом цитоплазма заряжа ется положительно относительно этого раствора. Ионы калия, проходя из цитоплазмы во внутренний раствор, заряжают ее от рицательно. Таким образом, на коже лягушки между внутренним и внешним барьерами возникает разность потенциалов. В уста новке имеется блок компенсации напряжения, позволяющий ус тановить разность потенциалов на коже, равную нулю. Это можно контролировать вольтметром. Концентрацию ионов с наружной и внутренней сторон поддерживают одинаковой. Если бы при этих условиях перенос ионов определялся только пассивным транспортом, потоки частиц в обе стороны были бы одинаковыми, а суммарный поток через мембрану был бы равен нулю. Однако с помощью амперметра был зарегистрирован ток в це пи, проходящий через кожу лягушки. Это свидетельствует о том, что через кожу лягушки происходит односторонний перенос заря женных частиц. Методом меченых атомов было показано, что имеет место движение ионов натрия от наружного раствора к внутреннему. Таким образом, результаты опыта Уссинга показа ли, что перенос ионов натрия через кожу лягушки не подчиняет ся законам пассивного транспорта. В этом случае имеет место активный перенос ионов. Согласно современным представлениям, в биологических мембранах имеются ионные насосы — специальные системы интег ральных белков (транспортные АТФазы). Известны четыре вида ионных насосов, три из которых обеспечивают перенос ионов Na + , К + , Ca 2+ и Н + через мембраны за счет энергии гидролиза АТФ. Ме ханизм переноса протонов при работе дыхательной цепи митохондрий изучен менее всего. Натрий-калиевый насос работает при условии сопряжения переноса ионов калия и натрия. Это означает, что если во внеш ней среде нет ионов калия, не будет активного переноса ионов натрия из клетки, и наоборот. Другими словами, ионы натрия активируют натрий-калиевый насос на внутренней поверхности клеточной мембраны, а ионы калия — на внешней. Натрий-калиевый насос переносит из клетки во внешнюю сре ду три иона натрия в обмен на перенос двух ионов калия внутрь клетки. Один акт переноса требует затраты энергии одной молекулы АТФ. При этом создается и поддерживается разность потенциалов на мембране, причем внутренняя часть клетки имеет отрицательный заряд. Надо отметить, что существует также активный перенос сахаров, аминокислот, нуклеотидов, но кинетика этих процессов не достаточно хорошо изучена. Интересно, что до сих пор нет досто верных сведений об активном транспорте анионов, хотя они игра ют важную роль в жизнедеятельности клеток (в особенности ионы хлора). По-видимому, анионы попадают в клетку путем пассивно го переноса. Лекция 5, 6. Биофизика транспортных процессовЛекция 5, 6. Биофизика транспортных процессов Перейдем теперь к рассмотрению некоторых направлений клеточной биофизики и начнем с биофизики транспортных процессов. Прежде всего, определим некоторые понятия – под транспортом на клеточном ровне понимаются прежде процессы переноса нейтральных веществ и ионов через биологические мембраны, и именно эти процессы изучаются в первую очередь в биофизике транспортных процессов. Надо отметить, что транспорт на клеточном уровне этими процессами не исчерпывается. Так существует латеральный транспорт – т. е. транспорт веществ ВДОЛЬ мембраны. Можно говорить также о транспорте веществ внутри клетки, который не связан с мембранными структурами, а осуществляется, например, за счет взаимодействия транспортируемых молекул с белками цитоскелета или водных потоков внутри клетки. Однако именно трансмембранный транспорт, т. е. транспорт ЧЕРЕЗ биологические мембраны играет одну из ключевых ролей. Поему так? Чтобы понять это, необходимо вспомнить роль биологических мембран в существовании живых систем. Как вы, наверно, знаете мембраны представляют собой клеточные структуры состоящие из бислоя (если нужно – напомнить структуру бислоя, РИС) и взаимодействующих с ним белков. У прокариот основной мембранной структурой является клеточная мембрана, выполняющая широкий спектр функций. У эукариот имеется широкий спектр мембранных структур – плазматическая мембрана, ядерная мембрана, сопрягающие мембраны – у митохондриальная и тилакоидная, и другие. Наиболее общей функцией биомембран является барьерная – т. к. за счет центрального гидрофобного участка в бислое, они обладают очень низкой проницаемостью для полярных, водорастворимых соединений. Именно благодаря этой функции мембраны и стали играть столь значительную роль в функционировании живых систем – без них само существование живых систем как отдельных объектов стало бы невозможным. Однако, как мы уже говорили, живые системы – это открытые системы, т. е. системы, которые не могут существовать без обмена с внешней средой веществом и энергией. Отсюда существование биомембран, являющееся само по себе необходимым условиям для существования живых организмов в том виде в каком они есть, с необходимостью требует существования транспортных процессов через эти мембраны и обуславливает большую биологическую значимость этих процессов. Рассмотрим процессы транспорта через биомембраны подробнее. Простая диффузия представляет собой движение молекул незаряженного вещества по градиенту концентрации, т. е. от участков с более высоким содержанием данного вещества к участкам с более низким содержанием его. Такой процесс является пассивным, т. е. его непосредственное протекание не требует затрат энергии. Его существование было изначально показано эмпирически, однако этот закон может быть выведен, например, из более общего второго принципа термодинамики (равновесие – как отсутствие градиентов, если нужно объяснить). Впрочем, к явлению диффузии легко прийти и на основе молекулярной картины строения вещества и броуновского движения, которое, в общем-то, тоже вытекает из этой картины. Так, если у нас имеется два отсека, заполненных, например, разной концентрацией газа, то если мы откроем перегородку между этими отсеками, то получим, что количество молекул, движущихся из 1 в 2, будет пропорционально концентрации газа в 1, а из 2 в 1 – концентрации газа в 2 (РИС). Т. е. можно записать, что Отметим, что D – коэффициент диффузии, размерность которого обычно см2*с-1, j – поток вещества, с размерностью М*см-2*с-1. D – можно найти, учитывая, что В том случае, когда речь идет о перемещении вещества через тонкий барьер, например, через биомембрану, толщиной h, можно принять внутри этого барьера связь между С и х имеет линейный характер, т. е. dC/dx = const. Справедливость этого легко доказать, проанализировав зависимость ΔС от x, на участке от 0 до h:
| ||||||||
| | | следующая лекция ==> |
| Химия элементов VIIA группы | | |
Дата добавления: 2016-04-11 ; просмотров: 3026 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://pandia.ru/text/78/219/15048.php
http://helpiks.org/7-75419.html
 (11.22)
(11.22) ; сила, действующая на 1 моль ионов, равна
; сила, действующая на 1 моль ионов, равна (11.23)
(11.23) (11.24)
(11.24)
 (11.26)
(11.26) (11.27)
(11.27) (11.28)
(11.28) где м — разность потенциалов на мембране. Упростим запись слагаемого в уравнении (11.28):
где м — разность потенциалов на мембране. Упростим запись слагаемого в уравнении (11.28): 
 (11.29)
(11.29) (11.30)
(11.30)

 (11.31)
(11.31) 

 (11.32)
(11.32)  (11.33)
(11.33)
 (11.34)
(11.34)




 уществование активного транспорта через биологические мембраны впервые было показано датским ученым Уссингом в опытах с переносом ионов натрия через кожу лягушки, которая имеет более сложную структуру, чем одиночная мембрана. Кожу лягушки можно представить как два последовательно располо женных барьера (1 и 2 на рис. 11.14). Наружный барьер 1 (мемб рана) отличается тем, что он избирательно проницаем для ионов натрия, но не калия. В то же время внутренняя мембрана 2 более проницаема для калия, чем для натрия. Экспериментальная ка мера Уссинга, изображенная на рис. 11.14, разделена на две части кожей лягушки. На рисунке кожа лягушки располагается между наружным и внутренним раствором: снаружи и изнутри камеры заполнены раствором Рингера, содержащим ионы натрия, калия, кальция и хлора.
уществование активного транспорта через биологические мембраны впервые было показано датским ученым Уссингом в опытах с переносом ионов натрия через кожу лягушки, которая имеет более сложную структуру, чем одиночная мембрана. Кожу лягушки можно представить как два последовательно располо женных барьера (1 и 2 на рис. 11.14). Наружный барьер 1 (мемб рана) отличается тем, что он избирательно проницаем для ионов натрия, но не калия. В то же время внутренняя мембрана 2 более проницаема для калия, чем для натрия. Экспериментальная ка мера Уссинга, изображенная на рис. 11.14, разделена на две части кожей лягушки. На рисунке кожа лягушки располагается между наружным и внутренним раствором: снаружи и изнутри камеры заполнены раствором Рингера, содержащим ионы натрия, калия, кальция и хлора.
 , а
, а  , следовательно – общая скорость транспорта молекул будет:
, следовательно – общая скорость транспорта молекул будет:  . Учтем, что k зависит от расстояния между участками 1 и 2 и запишем, что k = k0*1/∆x, где ∆x – расстояние между участками С1 и С2. Учтем также, что, чтобы перейти к потоку мы должны домножить выражение на V/S, т. е. перейти к другой размерности (если нужно – пояснить). Отсюда получим:
. Учтем, что k зависит от расстояния между участками 1 и 2 и запишем, что k = k0*1/∆x, где ∆x – расстояние между участками С1 и С2. Учтем также, что, чтобы перейти к потоку мы должны домножить выражение на V/S, т. е. перейти к другой размерности (если нужно – пояснить). Отсюда получим: или
или  — уравнение Фика.
— уравнение Фика. , где R и T – универсальная газовая постоянная и абсолютная температура, а u — подвижность вещества в рассматриваемой среде.
, где R и T – универсальная газовая постоянная и абсолютная температура, а u — подвижность вещества в рассматриваемой среде. , если х – мало (или если x
, если х – мало (или если x
 Транспорт
Транспорт