Pb no3 2 hcl молекулярное уравнение
Допишите уравнения реакций, составьте полные и краткие ионные уравнения.
1) HCl+Pb(No3)2-
2) HCl+Cao-
3) HCl+Fe(OH)3-
2HCl + Pb(NO₃)₂ = 2HNO₃ + PbCl₂↓
2H⁺ + 2Cl⁻ + Pb²⁺ + 2NO₃⁻ = 2H⁺ + 2NO₃⁻ + PbCl₂↓
2Cl⁻ + Pb²⁺= PbCl₂↓
2HCl + CaO = CaCl₂ + H₂O
2H⁺ + 2Cl⁻ + CaO = Ca²⁺ + 2Cl⁻ + H₂O
2H⁺ + CaO = Ca²⁺ + H₂O
3HCl + Fe(OH)₃ = FeCl₃ + 3H₂O
3H⁺ + 3Cl⁻ + Fe(OH)₃ = Fe³⁺ + 3Cl⁻ + 3H₂O
3H⁺ + Fe(OH)₃ = Fe³⁺ + 3H₂O
Срочно нужна помощь написать в молекулярной и ионной формах уравнение реакции между следующими веществами Pb(NO3)2 + HCL Pb(OH)2 + HNO3 Pb(OH)2 + KOH?
Химия | 10 — 11 классы
Срочно нужна помощь написать в молекулярной и ионной формах уравнение реакции между следующими веществами Pb(NO3)2 + HCL Pb(OH)2 + HNO3 Pb(OH)2 + KOH.
1. Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
Pb(2 + ) + 2NO3( — ) + 2H( + ) + 2Cl( — ) = PbCl2 + 2H( + ) + 2NO3( — )
PB(2 + ) + 2Cl( — ) = PbCl2
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O
Pb(oh)2 + 2h( + ) + 2no3( — ) = pb(2 + ) + 2no3( — ) + 2h2o
pb(oh)2 + 2h = pb(2 + ) + 2h2o
Pb(oh)2 + 2koh = реакция не пойдёт.
CrO + HCl решите уравнение?
CrO + HCl решите уравнение.
Нужно написать уравнения в молекулярной и ионных формах.
Написать молекулярные и ионно — молекулярные уравнения реакций для следующих пар веществ ZnCl2 и KOH, Na2CO3 и HNO3?
Написать молекулярные и ионно — молекулярные уравнения реакций для следующих пар веществ ZnCl2 и KOH, Na2CO3 и HNO3.
ОЧЕНЬ СРОЧНО?
Составить уравнения реакций : молекулярное уравнение, полное ионное уравнение, сокращенное ионное AgNo3 + KOH CuSo4 + KOH CaC03 + HCL KOH + финол фталеин + HCL H2S04 + мтил оранж + KOH.
Напишите уравнения реакций в молекулярной, полной и краткой ионной форме между следующими веществами(просьба подробно написать) 1)AgNO3 и K2S 2)HNO3 и K2CO3 3)NaOH и HCL 4)NaCL и KOH обучение?
Напишите уравнения реакций в молекулярной, полной и краткой ионной форме между следующими веществами(просьба подробно написать) 1)AgNO3 и K2S 2)HNO3 и K2CO3 3)NaOH и HCL 4)NaCL и KOH обучение.
Напишите молекулярные и ионные уравнения реакций : CO2 + KOH → , NiOHCl + HCl → ?
Напишите молекулярные и ионные уравнения реакций : CO2 + KOH → , NiOHCl + HCl → ;
Написать в молекулярной , ионно — молекулярной и сокращенной ионной формах реакцию между водными растворами следующих веществ : BaCl2 + Na3Po4?
Написать в молекулярной , ионно — молекулярной и сокращенной ионной формах реакцию между водными растворами следующих веществ : BaCl2 + Na3Po4.
CuSO4 — Cu(No3)2 — Pb(No3)2 — K2PbO2 — PbOH написать уравнения при которых можно осуществить превращения(полное ионное уравнение)?
CuSO4 — Cu(No3)2 — Pb(No3)2 — K2PbO2 — PbOH написать уравнения при которых можно осуществить превращения(полное ионное уравнение).
K2SO3 + HCL как написать молекулярное и ионно — молекулярное уравнение к этой реакции?
K2SO3 + HCL как написать молекулярное и ионно — молекулярное уравнение к этой реакции?
— Составьте молекулярное и ионное уравнения реакций, протекающих в растворе между следующими веществами ) K2CO3 и HCl ; б)CH3COOH и KOH?
— Составьте молекулярное и ионное уравнения реакций, протекающих в растворе между следующими веществами ) K2CO3 и HCl ; б)CH3COOH и KOH.
Написать уравнения реакций в молекулярном и ионном виде между следующими веществами MgCl2 + KOH H2 PO4 + NaOH CuO + HCI?
Написать уравнения реакций в молекулярном и ионном виде между следующими веществами MgCl2 + KOH H2 PO4 + NaOH CuO + HCI.
На этой странице сайта, в категории Химия размещен ответ на вопрос Срочно нужна помощь написать в молекулярной и ионной формах уравнение реакции между следующими веществами Pb(NO3)2 + HCL Pb(OH)2 + HNO3 Pb(OH)2 + KOH?. По уровню сложности вопрос рассчитан на учащихся 10 — 11 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Формула 1 моль железа является Fe, в ней 1 атом. Вычислим число атомов на 1 моль . Число Авагадро = 6. 02•10 ^ 23 N = 1•Na = 1•6, 02•10 ^ 23 = 6, 02•10 ^ 23 Значит в 1 моль 6, 02•10 ^ 23 атомов А в 5 моль получится х Составим пропорцию Получим х =..
Для того чтобы была ионная связь разница межде электроотрицательносями дожна быть 2. 1 и более мы можем частично сказать что это ионная связь но правильней если ковалентная N берет у Li 3 электрона.
Ответ есть на фотографии.
(140 — 110) / 10 = 3 Значит берем кубический корень из 27 и получаем 3 — коэффициент Вант — Гоффа.
Na2O, MgO, Al2O3, SiO2, P2O5, SO2, Cl2O7, Na3N, Mg3N2, AlN, Si3N4, P4N5, N2S3, NCL3.
2NaOH + H2SO4 = Na2SO4 + 2H2O 80г щелочи — 142г соли 20г щелочи — х г соли х = 35. 5 г.
20 х2NaOH + H2SO4 = 2H2O + Na2SO4 80 142х = 35. 5 граммов.
CH3 — CH(CH3) — CH2 — CH(C2H5) — CH2 — CH2 — CH3.
M(Ag) = 108г / моль ; M(BaS) = 137г / моль + 32г / моль = 169 г / моль ; M(AlCl3) = 27 г / моль + 106, 5 г / моль = 133, 5 г / моль ; M(H2) = 2 г / моль.
А)Mg + 2HCl→H2↑ + MgCl2 замещение Б)Cu(OH)₂ + 2HNO₃→Cu(NO₃)₂ + 2H₂Oобмен В)Cu(OH)₂→°t CuO + H2O разложение Г)4Al + ₃O₂→₂Al₂O₃ соединение.
Частные реакции катионов второй аналитической группы
Реакции катиона свинца Pb 2+
1. Хлороводородная кислота HCl и растворимые хлориды осаждают из умеренно концентрированных растворов солей свинца (II) белый хлопьевидный осадок хлорида свинца (II), легко растворимый в горячей воде:
Pb(NO3)2 + 2HCl 
Pb 2+ + 2Cl — 
Выполнение реакции. В пробирку помещают 2 капли раствора нитрата свинца (II) Pb(NO3)2 и добавляют 2 капли хлороводородной кислоты. К раствору с осадком добавляют 0,5 мл дистиллированной воды и нагревают смесь на водяной бане. Наблюдают растворение осадка и постепенное его выпадение при охлаждении раствора.
2. Едкие щелочи из растворов солей свинца (II) осаждают гидроксид свинца (II) – осадок белого цвета:
Pb(NO3)2 + 2KOH 
Pb 2+ + 2OH — 
Гидроксид свинца (II) обладает амфотерными свойствами, поэтому он растворяется в разбавленной азотной или уксусной кислотах и в избытке щелочи:
Pb(OH)2 + 2KOH 
Выполнение реакции. К 2 каплям соли свинца (II) прибавляют сначала 1 каплю раствора щелочи, а затем ее избыток и наблюдают выпадение осадка и последующее его растворение в избытке щелочи.
3. Серная кислота H2SO4 и растворимые сульфаты выделяют из свинцовых солей труднорастворимый сульфат свинца – осадок белого цвета:
Pb(NO3)2 + H2SO4 
Pb 2+ + SO4 2- 
Осадок растворим при нагревании в растворах щелочей (10-15%):
PbSO4 + 4NaOH 
Выполнение реакции. К 2 каплям раствора соли свинца (II) прибавляют 2 капли разбавленной серной кислоты и наблюдают выпадение осадка.
4. Иодид калия KI, взаимодействуя со свинцовыми солями, дает желтый осадок иодида свинца (II):
Pb(NO3)2 + KI 
Pb 2+ + 2I — 
Реакция часто применяется для открытия ионов Pb 2+ .
Выполнение реакции. К 2 каплям раствора нитрата свинца (II) Pb(NO3)2 добавляют 2 капли раствора иодида калия. В полученный раствор с осадком добавляют 0,5 мл воды и 3-4 капли разбавленной уксусной кислоты; нагревают смесь на кипящей водяной бане в течение 2 мин, затем охлаждают содержимое пробирки под струей воды. Растворившийся при нагревании осадок иодида свинца вновь выпадает в виде красивых золотистых чешуек.
5. Хромат калия K2CrO4 или хромат натрия Na2CrO4 выделяет из раствора соли свинца желтый осадок соли свинца (II):
Pb(NO3)2 + K2CrO4 
Pb 2+ + CrO4 2- 
Осадок не растворяется в уксусной кислоте, но растворяется в азотной кислоте и щелочах. Реакция чувствительна и является характерной для ионов Pb 2+ .
Выполнение реакции. К 2 каплям раствора соли свинца (II) добавляют 2 капли раствора хромата калия и наблюдают выпадение осадка.
Реакции катиона серебра Ag +
1. Хлороводородная кислота HCl и растворимые хлориды осаждают из нейтральных и кислых растворов солей серебра в виде белого творожистого осадка хлорида серебра:
AgNO3 + HCl 
Ag + + Cl — 
Осадок легко растворяется в избытке аммиака с образованием комплексной соли:
AgCl + 2 NH3 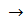
При подкислении аммиачного раствора концентрированной азотной кислотой эта соль разрушается и вновь выпадает осадок хлорида серебра:
[Ag(NH3)2]Cl + 2HNO3 
Эту реакцию обычно используют для открытия иона Ag + . Она является фармакопейной.
Выполнение реакции. В пробирку помещают 2 капли раствора нитрата серебра, добавляют к нему 2 капли разбавленной хлороводородной кислоты. К раствору с осадком добавляют 5 капель концентрированного раствора аммиака и встряхивают смесь до растворения осадка. К полученному раствору добавляют 6 капель концентрированной азотной кислоты. Наблюдают выпадение осадка.
2. Иодид калия KI образует с ионом Ag + светло-желтый осадок AgI:
AgNO3 + KI 
Ag + + l — 
Иодид серебра не растворяется в растворе аммиака в отличие от хлорида серебра.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли иодида калия и наблюдают выпадение осадка.
3. Хромат калия K2CrO4 из растворов солей серебра осаждает кирпично-красный хромат серебра:
2AgNO3 + K2CrO4 
2Ag + + CrO4 2- 
Осадок растворяется в растворе аммиака и азотной кислоте.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли раствора хромата калия и наблюдают выпадение осадка.
4. Едкие щелочи из растворов солей серебра осаждают грязно-коричневый осадок оксида серебра:
2AgNO3 + 2KOH 
2Ag + + 2OH — 
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли раствора щелочи и наблюдают выпадение осадка.
5. Тиосульфат натрия Na2S2O3 из растворов солей серебра выделяет белый осадок, который быстро желтеет, затем буреет и переходит в черный:
2AgNO3 + Na2S2O3 
Ag2 S2O3 + H2O 
Осадок Ag2 S2O3 растворяется в избытке тиосульфата с образованием комплексных солей, поэтому осадок образуется при избытке ионов серебра. Реакция является фармакопейной.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 1 каплю раствора тиосульфата натрия. Наблюдается изменение цвета осадка.
Реакции катиона ртути (I) Hg2 2+
1. Хлороводородная кислота HCl и растворимые хлориды из растворов солей ртути (I) осаждают хлорид ртути (I), или каломель, — осадок белого цвета:
Hg2(NO3)2 + HCl 
Hg2 2+ +2Cl — 
Водный раствор аммиака окрашивает осадок в черный цвет, обусловленный образованием черной мелкораздробленной ртути:
Hg2Cl2 + 2 NH3 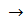
С помощью этой реакции открывают ион Hg2 2+ .
Выполнение реакции. К 2 каплям раствора нитрата ртути (I) Hg2(NO3)2 добавляют 2 капли раствора разбавленной хлороводородной кислоты. К раствору с осадком добавляют 3 капли раствора аммиака. Наблюдают почернение осадка.
2. Иодид калия KI из растворов солей ртути (I) осаждает иодид ртути (I) – осадок болотно-зеленого цвета:
Hg2(NO3)2 + 2KI 
Осадок довольно легко распадается на иодид ртути (II) и металлическую ртуть; при этом цвет осадка изменяется:
Hg2I2 
Выполнение реакции. К 2 каплям раствора нитрата ртути (I) Hg2(NO3)2 добавляют 2 капли раствора иодида калия. Наблюдают выпадение осадка и изменение его цвета при встряхивании.
3. Хромат калия K2CrO4 
Hg2(NO3)2 + K2CrO4 
2Hg + + CrO4 2- 
Осадок не растворяется в щелочах и разбавленной уксусной кислоте.
Выполнение реакции. 2 капли раствора Hg2(NO3)2 , помещенные в пробирку, нагревают на водяной бане и добавляют 2 капли хромата калия.
http://himia.my-dict.ru/q/3572742_srocno-nuzna-pomos-napisat-v-molekularnoj/
http://zdamsam.ru/b4833.html









