Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6def4c20be6dc4a4 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Гидролиз нитрата свинца (II)
Pb(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
Pb 2+ + 2NO3 — + HOH ⇄ PbOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Pb 2+ + HOH ⇄ PbOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
PbOH + + NO3 — + HOH ⇄ Pb(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
PbOH + + HOH ⇄ Pb(OH)2 + H +
Среда и pH раствора нитрата свинца (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?
Решение:
Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2 + связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb 2 + + H2O 
полное ионно-молекулярное уравнение:
Pb 2+ + 2NO3 — + H2O 
Pb(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO3 2– + H2O 
полное ионно-молекулярное уравнение:
2K + + CO3 2– + H2O 
K2CO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид цинка ZnCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Zn 2+ + H2O 
полное ионно-молекулярное уравнение:
Zn 2+ + 2Cl — + H2O 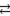
ZnCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HSO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
SO3 2– + H2O 
полное ионно-молекулярное уравнение:
2Na + + SO3 2– + H2O 
Na2SO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид кобальта (II) CoCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Co 2+ + H2O 
полное ионно-молекулярное уравнение:
Co 2+ + 2Cl — + H2O 
CoCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Al 3+ + H2O 
полное ионно-молекулярное уравнение:
Al 3+ + 3NO3 — + H2O 
Al(NO3)3+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH
http://chemer.ru/services/hydrolysis/salts/Pb(NO3)2
http://poisk-ru.ru/s4411t5.html