Частные реакции катионов второй аналитической группы
Реакции катиона свинца Pb 2+
1. Хлороводородная кислота HCl и растворимые хлориды осаждают из умеренно концентрированных растворов солей свинца (II) белый хлопьевидный осадок хлорида свинца (II), легко растворимый в горячей воде:
Pb(NO3)2 + 2HCl 
Pb 2+ + 2Cl — 
Выполнение реакции. В пробирку помещают 2 капли раствора нитрата свинца (II) Pb(NO3)2 и добавляют 2 капли хлороводородной кислоты. К раствору с осадком добавляют 0,5 мл дистиллированной воды и нагревают смесь на водяной бане. Наблюдают растворение осадка и постепенное его выпадение при охлаждении раствора.
2. Едкие щелочи из растворов солей свинца (II) осаждают гидроксид свинца (II) – осадок белого цвета:
Pb(NO3)2 + 2KOH 
Pb 2+ + 2OH — 
Гидроксид свинца (II) обладает амфотерными свойствами, поэтому он растворяется в разбавленной азотной или уксусной кислотах и в избытке щелочи:
Pb(OH)2 + 2KOH 
Выполнение реакции. К 2 каплям соли свинца (II) прибавляют сначала 1 каплю раствора щелочи, а затем ее избыток и наблюдают выпадение осадка и последующее его растворение в избытке щелочи.
3. Серная кислота H2SO4 и растворимые сульфаты выделяют из свинцовых солей труднорастворимый сульфат свинца – осадок белого цвета:
Pb(NO3)2 + H2SO4 
Pb 2+ + SO4 2- 
Осадок растворим при нагревании в растворах щелочей (10-15%):
PbSO4 + 4NaOH 
Выполнение реакции. К 2 каплям раствора соли свинца (II) прибавляют 2 капли разбавленной серной кислоты и наблюдают выпадение осадка.
4. Иодид калия KI, взаимодействуя со свинцовыми солями, дает желтый осадок иодида свинца (II):
Pb(NO3)2 + KI 
Pb 2+ + 2I — 
Реакция часто применяется для открытия ионов Pb 2+ .
Выполнение реакции. К 2 каплям раствора нитрата свинца (II) Pb(NO3)2 добавляют 2 капли раствора иодида калия. В полученный раствор с осадком добавляют 0,5 мл воды и 3-4 капли разбавленной уксусной кислоты; нагревают смесь на кипящей водяной бане в течение 2 мин, затем охлаждают содержимое пробирки под струей воды. Растворившийся при нагревании осадок иодида свинца вновь выпадает в виде красивых золотистых чешуек.
5. Хромат калия K2CrO4 или хромат натрия Na2CrO4 выделяет из раствора соли свинца желтый осадок соли свинца (II):
Pb(NO3)2 + K2CrO4 
Pb 2+ + CrO4 2- 
Осадок не растворяется в уксусной кислоте, но растворяется в азотной кислоте и щелочах. Реакция чувствительна и является характерной для ионов Pb 2+ .
Выполнение реакции. К 2 каплям раствора соли свинца (II) добавляют 2 капли раствора хромата калия и наблюдают выпадение осадка.
Реакции катиона серебра Ag +
1. Хлороводородная кислота HCl и растворимые хлориды осаждают из нейтральных и кислых растворов солей серебра в виде белого творожистого осадка хлорида серебра:
AgNO3 + HCl 
Ag + + Cl — 
Осадок легко растворяется в избытке аммиака с образованием комплексной соли:
AgCl + 2 NH3 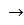
При подкислении аммиачного раствора концентрированной азотной кислотой эта соль разрушается и вновь выпадает осадок хлорида серебра:
[Ag(NH3)2]Cl + 2HNO3 
Эту реакцию обычно используют для открытия иона Ag + . Она является фармакопейной.
Выполнение реакции. В пробирку помещают 2 капли раствора нитрата серебра, добавляют к нему 2 капли разбавленной хлороводородной кислоты. К раствору с осадком добавляют 5 капель концентрированного раствора аммиака и встряхивают смесь до растворения осадка. К полученному раствору добавляют 6 капель концентрированной азотной кислоты. Наблюдают выпадение осадка.
2. Иодид калия KI образует с ионом Ag + светло-желтый осадок AgI:
AgNO3 + KI 
Ag + + l — 
Иодид серебра не растворяется в растворе аммиака в отличие от хлорида серебра.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли иодида калия и наблюдают выпадение осадка.
3. Хромат калия K2CrO4 из растворов солей серебра осаждает кирпично-красный хромат серебра:
2AgNO3 + K2CrO4 
2Ag + + CrO4 2- 
Осадок растворяется в растворе аммиака и азотной кислоте.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли раствора хромата калия и наблюдают выпадение осадка.
4. Едкие щелочи из растворов солей серебра осаждают грязно-коричневый осадок оксида серебра:
2AgNO3 + 2KOH 
2Ag + + 2OH — 
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 2 капли раствора щелочи и наблюдают выпадение осадка.
5. Тиосульфат натрия Na2S2O3 из растворов солей серебра выделяет белый осадок, который быстро желтеет, затем буреет и переходит в черный:
2AgNO3 + Na2S2O3 
Ag2 S2O3 + H2O 
Осадок Ag2 S2O3 растворяется в избытке тиосульфата с образованием комплексных солей, поэтому осадок образуется при избытке ионов серебра. Реакция является фармакопейной.
Выполнение реакции. К 2 каплям раствора нитрата серебра добавляют 1 каплю раствора тиосульфата натрия. Наблюдается изменение цвета осадка.
Реакции катиона ртути (I) Hg2 2+
1. Хлороводородная кислота HCl и растворимые хлориды из растворов солей ртути (I) осаждают хлорид ртути (I), или каломель, — осадок белого цвета:
Hg2(NO3)2 + HCl 
Hg2 2+ +2Cl — 
Водный раствор аммиака окрашивает осадок в черный цвет, обусловленный образованием черной мелкораздробленной ртути:
Hg2Cl2 + 2 NH3 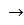
С помощью этой реакции открывают ион Hg2 2+ .
Выполнение реакции. К 2 каплям раствора нитрата ртути (I) Hg2(NO3)2 добавляют 2 капли раствора разбавленной хлороводородной кислоты. К раствору с осадком добавляют 3 капли раствора аммиака. Наблюдают почернение осадка.
2. Иодид калия KI из растворов солей ртути (I) осаждает иодид ртути (I) – осадок болотно-зеленого цвета:
Hg2(NO3)2 + 2KI 
Осадок довольно легко распадается на иодид ртути (II) и металлическую ртуть; при этом цвет осадка изменяется:
Hg2I2 
Выполнение реакции. К 2 каплям раствора нитрата ртути (I) Hg2(NO3)2 добавляют 2 капли раствора иодида калия. Наблюдают выпадение осадка и изменение его цвета при встряхивании.
3. Хромат калия K2CrO4 
Hg2(NO3)2 + K2CrO4 
2Hg + + CrO4 2- 
Осадок не растворяется в щелочах и разбавленной уксусной кислоте.
Выполнение реакции. 2 капли раствора Hg2(NO3)2 , помещенные в пробирку, нагревают на водяной бане и добавляют 2 капли хромата калия.
PbO + KOH Pb(OH)2 + H2SO4 Pb(OH)2 + KOH?
Химия | 5 — 9 классы
PbO + KOH Pb(OH)2 + H2SO4 Pb(OH)2 + KOH.
PbO + 2KOH — > ; K2PbO2 + H2OPb(OH)2 + H2SO4 — > ; PbSO4 + 2H2OPb(OH)2 + 2KOH — > ; K2PbO2 + 2H2OилиPb(OH)2 + 2KOH — > ; K2[Pb(OH)4].
BeO + KOH = ?
CuSO4 — Cu(No3)2 — Pb(No3)2 — K2PbO2 — PbOH написать уравнения при которых можно осуществить превращения(полное ионное уравнение)?
CuSO4 — Cu(No3)2 — Pb(No3)2 — K2PbO2 — PbOH написать уравнения при которых можно осуществить превращения(полное ионное уравнение).
H2SO4 + KOH = ?
Подскажите пожалуйста подскажите пойдет ли эта реакция : KOH + PbO = ?
Подскажите пожалуйста подскажите пойдет ли эта реакция : KOH + PbO = ?
Fe (SO4)3 + KOH = CuSO4 + KOH =?
Fe (SO4)3 + KOH = CuSO4 + KOH =.
ОПРЕДЕЛИТЬ МЕЖДУ КАКИМИ ВЕЩЕСТВАМИ ИДЕТ РЕАКЦИЯ И ЗАПИСАТЬ ЕЁ 1) KOH + Ca2 2) KOH + SiO 3) KOH + BaCl2 4) KOH + Cu 5) KOH + Mg 6) KOH + Al(OH)3?
ОПРЕДЕЛИТЬ МЕЖДУ КАКИМИ ВЕЩЕСТВАМИ ИДЕТ РЕАКЦИЯ И ЗАПИСАТЬ ЕЁ 1) KOH + Ca2 2) KOH + SiO 3) KOH + BaCl2 4) KOH + Cu 5) KOH + Mg 6) KOH + Al(OH)3.
Be + KOH BeO + KOH Be(OH)2 + KOH?
Be + KOH BeO + KOH Be(OH)2 + KOH.
При взаимодействии ацетата свинца с карбонатом натрия в водной среде получился осадок состава (PbOH)2CO3 и PbCO3?
При взаимодействии ацетата свинца с карбонатом натрия в водной среде получился осадок состава (PbOH)2CO3 и PbCO3.
Составить уравнение реакций нейтралищации HNO3 + KOH HCL + KOH HPO3 + KOH H2SO4 + KOH H3PO4 + KOH?
Составить уравнение реакций нейтралищации HNO3 + KOH HCL + KOH HPO3 + KOH H2SO4 + KOH H3PO4 + KOH.
KOH — K2SO4 — KOH — KCI — KNO3?
KOH — K2SO4 — KOH — KCI — KNO3.
На этой странице сайта, в категории Химия размещен ответ на вопрос PbO + KOH Pb(OH)2 + H2SO4 Pb(OH)2 + KOH?. По уровню сложности вопрос рассчитан на учащихся 5 — 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Решение присутствует на фото.
1. В 2. А (видимо имелась ввиду группа СОН) 3. Б 4. В 5. А 6. Г 7. А.
2 алюминий Аl)OH)3 = 78 — 51 = 27 3 натрий ЕОH = 40 — 17 = 23 1S2 2S2 2P6 3S1 4 — сульфурSO3 = H2SO4 = 98 5 = 3 * 96 / 2. 67 * 4 = 27 алюминий.
В порядке возрастания основных свойств B₂O₃ Срочно?
2NO + O2 = 2NO2 Если принять объем оксида азота (II) за V’, а объем кислорода за V», то исходя из УХР, в котором коэффициенты показывают не только количество, но и объемы газообразных реагентов и продуктов реакции, V» = 0, 5V’ То есть, кислорода необ..
С + 2H2 — > CH4 2CH4 — > CH = — CH + 3H2 ( t = 1500) CH = — CH + H2 — > CH2 = CH2 (t, kat) CH2 = CH2 + H2O — > CH3 — CH2 — OH (kat) C6H6 + HONO2 — > C6H5NO2 + H2O ( t, H2SO4) C6H5NO2 + 3H2 — > C6H5NH2 + 2H2O.
Вот снизу должна быть указа формула на фото.
Mr(CH4) = 12 + 4 * 1 = 16 W(H) = 4 / 16 = 0. 25 = 25% Mr(C2H2) = 2 * 12 + 2 * 1 = 26 W(H) = 2 / 26 = 0. 08 = 8% Mr(C2H4) = 2 * 12 + 4 * 1 = 28 W(H) = 4 / 28 = 0. 14 = 14% Ответ : C2H2, C2H4, CH4.
Решение задачи находится на фото.
Марганец масса 54, 93 а валентность 2 ; 4 ; 7.
Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений: 105. Pb(NO3)2 Pb(OH)NO3 Pb(OH)2 K2PbO2






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений:
105. Pb(NO3)2 ® Pb(OH)NO3 ® Pb(OH)2 ® K2PbO2
Решение :
Pb 2+ + 2NO3 — + Na + + OH — ® Pb(OH) + + NO3 — + Na + + NO3 —
Pb 2+ + OH — ® Pb(OH) +
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений: 115. NiBr2 (NiOH)2SO4 Ni(OH)2 NiBr2
- Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи). 121. NaNO2, Cu(NO3)2
- Напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их H2SO4 с и NaOH. 81. HCl; Cr(OH)3
- Напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их H2SO4 с и NaOH. 95. KOH; H2CO3
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://himia.my-dict.ru/q/2607237_pbo-koh-pboh2-h2so4-pboh2-koh/
http://natalibrilenova.ru/napishite-v-molekulyarnoj-i-ionnoj-formah-uravneniya-reaktsij-dlya-sleduyuschih-prevraschenij-105-pbno32-pbohno3-pboh2-k2pbo2/












