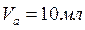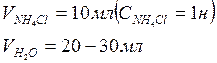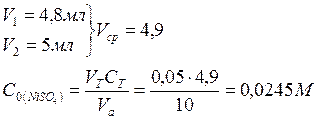Лаба по ПДОЕ
1 Что такое ПОЕ ионитов?
ПОЕ (полная обменная емкость) – общее количество всех ионообменных групп в единице объёма ионита (мг-экв/л).
2 Дайте определение ДОЕ. В каких единицах выражается ДОЕ? Как рассчитывается ДОЕ ионита?
ДОЕ (динамическая обменная емкость) – емкость ионита, определяемая по появлению данного иона в вытекающем из колонки раствора (по «проскоку») (мг-экв/л).
Рассчитать ДОЕ и ПДОЕ можно по формулам:


С – концентрация ионов (катионов для катионита, анионов для анионита) в воде, мг-экв/л; Vпроскок – количество воды, пропущенной через фильтр до проскока поглощаемого иона, л; Vполный – количество воды, пропущенной через фильтр до момента выравнивания концентраций, л; Vионита – объём ионита, л.
3 Дайте определение ПДОЕ. В каких единицах выражается ПДОЕ? Как рассчитывается ПДОЕ ионита?
ПДОЕ (полная динамическая обменная емкость) – определяется по полному прекращению извлечения данного иона из раствора, т.е. в момент выравнивания концентрации поглощаемого иона в растворе и фильтрате при пропускании раствора через колонку с ионитом (мг-экв/л).
4 Почему над слоем ионита в колонке всегда должен находиться слой жидкости?
Дата добавления: 2015-04-11 ; просмотров: 39 | Нарушение авторских прав
Исследование обменной адсорбции ионов. Определение полной и динамической объемной емкости. Выходная кривая ионообменной адсорбации
Страницы работы
Содержание работы
Федеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
Санкт-Петербургский Государственный Горный институт им. Г.В.Плеханова
 |
(технический университет)
КАФЕДРА ОБЩЕЙ И ФИЗИЧЕСКОЙ ХИМИИ
Отчёт по лабораторной работе № 3.
По дисциплине: Физическая химия л
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование обменной адсорбции ионов. л
Выполнил: студент гр. ОП-04 ______________ / /
(шифр группы) (подпись) (Ф.И.О.)
ПРОВЕРИЛ:
Руководитель: доцент ______________ / /
(должность) (подпись) (Ф.И.О.)
Цель работы: определить полную и динамическую объемную емкость.
Обменная ёмкость – количество ионов, выражаемое в миллиграмм-эквивалентах, поглощённых единицей массы воздушно-сухого сорбента или единицей объёма набухшего ионита. Объёмная ёмкость зависит от природы ионита, концентрации обменивающихся ионов, а также в значительной степени от рН среды.
Полная обменная ёмкость (ПОЕ) характеризует общую поглотительную способность ионита до наступления насыщения, т. е. практически полную замену подвижных ионов функциональных групп на сорбируемые ионы.
Обменная ёмкость до проскока (ДОЕ) характеризует количество обменивающихся ионов до первого появления сорбируемых из раствора ионов в фильтрате. ДОЕ всегда меньше ПОЕ. Если ПОЕ характеризует общую адсорбционную способность ионита, то ДОЕ определяет его технологические возможности.
Обменная ёмкость ионитов может быть определена либо статическими, либо динамическими методами.
Статические методы основаны на последовательной обработке навески ионита определёнными порциями раствора с известной концентрацией ионов, последующей фильтрации и анализе каждой порции. Эти операции повторяются до тех пор, пока концентрация поглощаемых ионов не станет равной исходной (при определении ПОЕ) или до появления ионов в фильтрате (определение ДОЕ).
Определение обменной ёмкости динамическим методом осуществляется в хроматографической колонке, заполненной слоем ионита высотой не менее 10 см, через который медленно фильтруется раствор электролита известной концентрации. Фильтрат собирают порциями в градуированные мензурки, определяя точный объём каждой пробы, содержание в ней поглощённых ионов и рН. Экспериментальные данные используют для построения выходной кривой в координатах: объём раствора, прошедшего через ионит, — концентрация в нём паоглощаемых ионов. С помощью выходной кривой вычисляют динамическую обменную ёмкость ионита.
Полная динамическая обменная ёмкость: 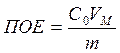
Динамическая обменная ёмкость до проскока: 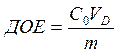
Порядок выполнения работы и результаты эксперимента.
1. Проводим анализ раствора соли СuSO4 и рассчитываем его исходную концентрацию. Для этого проводим титрование:
Индикатор мурексид окрашивает раствор в жёлтый цвет (окраска поддерживается добавлением (по каплям) NH4OH (1М)). Титрование осуществляется раствором трилона Б (0,05М) до перехода окраски в фиолетовую.
2. Определяем обменную ёмкость ионита динамическим методом. Результаты заносим в таблицу.
Методические указания к лабораторной работе по теме: «Ионный обмен»
Федеральное агентство по образованию
Тюменский государственный архитектурно-строительный университет
Кафедра Общей и специальной химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к лабораторной работе по теме:
«ИОННЫЙ ОБМЕН»
для студентов специальности «Охрана окружающей среды
и рациональное использование природных ресурсов»
по курсу «КОЛЛОИДНАЯ ХИМИЯ »
Ионный обмен: ст. преподаватель , методическое указание к лабораторной работе для студентов специальности ООС, дневное отделение, 2 курс, 4 семестр по курсу «Коллоидная химия». Тюмень: ТюмГАСУ, 2007г.
Рецензент: доцент, к. х.н.
(степень, звание, Фамилия, Имя, Отчество)
Учебно-методический материал утвержден на заседании кафедры общей и специальной химии,
протокол № от « » 2007г.
Учебно-методический материал утвержден УМС академии:
протокол № от « » 2007г.
Введение
Данное методическое пособие предназначено для студентов специальности “Охрана окружающей среды и рациональное использование природных ресурсов”.
Ионный обмен широко применяется в технологических процессах и для аналитических целей. С помощью ионитов проводится очистка растворов от вредных и нежелательных примесей, концентрирование, извлечение веществ.
В методическом указании даны общие представления о ионитах. В ходе выполнения лабораторной работы студенты знакомятся с динамическим методом проведения сорбционных процессов, определяют ДОЕ ионита.
1. Во время работы в лаборатории необходимо соблюдать тишину, порядок и правила безопасности.
2. Категорически воспрещается курить, пить воду, принимать пищу.
3. Нельзя приступать к выполнению опыта, пока не усвоена методика и не приготовлены все компоненты, необходимые для этого.
4. Опыты проводить только в чистой посуде. После проведения опытов всю использованную посуду чисто помыть.
5. При работе с кислотами, щелочами надо помнить, что это едкие, агрессивные вещества. Нужно следить, чтоб они не попадали на кожу рук, лица, одежду, т. к. возможен, химический ожег. При попадании вещества на кожу необходимо промыть пораженный участок большим количеством воды и обратится за помощью к преподавателю или лаборанту.
6. При отборе проб нельзя набирать растворы ртом, нужно пользоваться специальной грушей.
7. Необходимо соблюдать аккуратность и осторожность при работе со стеклянной посудой.
Некоторые сорбенты могут обменивать свои ионы на ионы раствора, в этом случае происходит обменная сорбция.
Материалы, способные к обмену ионов, получили название — иониты. Они могут быть в виде гранул, порошков, волокон, тканей, мембран. Большинство из них нерастворимо в воде.
Ионит условно состоит из трех частей: матрица (каркас), фиксированные ионы, противоионы. Например: 

R – матрица, 

Противоионы подвижны и могут обмениваться на ионы раствора.
По природе матрицы различают неорганические (минеральные) и органические иониты. Например, структуру стекла составляет трехмерная сетка силикатных ионов, в пустотах которой содержатся катионы щелочных и щелочноземельных металлов, способные к обмену. В органических ионитах трехмерный каркас образован сеткой из углеродных атомов, с которой связаны группы, несущие заряд.
По происхождению иониты бывают природные, искусственные, синтетические. Синтетические органические иониты обычно называют ионообменными смолами. Некоторые примеры ионитов приведены в таблице 1.
Классификация ионитов по природе и происхождению.
кристаллические силикаты типа цеолитов: глауконит, вермикулит; гидрослюды; апатит.
пермутиты (алюмосиликаты, подобные цеолитам;
гетерополикислоты 
каменные и бурые угли, торф, целлюлоза
По строению иониты бывают гелевые и макропористые. Гелевые способны к обмену только после набухания.
В зависимости от знака заряда обменивающихся ионов различают: катиониты (обмен катионами), аниониты (обмен анионами), амфолиты (обмен и катионами, и анионами).
Катиониты могут быть в 

Аниониты могут быть в 

По степени ионизации иониты могут быть сильно-, средне — и слабо-ионизированные, это аналогично обычным понятиям сильные и слабые электролиты. На примере ионообменных смол:
Сульфокатионит универсальный (КУ) RSO3H — сильнокислотный.
Фосфорнокислые иониты (КФП, КРФ) RPО3H2 — среднекислотные.
Карбоксильный ионит (КБ) RCOOH — слабокислотный.
Анионит АВ — высокоосновный.
Силу ионита можно охарактеризовать константой диссоциации. Средне — и слабокислотные иониты диссоциируют только в щелочных средах, а основные — только в кислых.
Слабые иониты перед работой обычно переводят в солевую форму и они становятся более сильными.
Ионный обмен происходит в равноэквивалентных количествах – сколько ионов поглощается из раствора, столько же их переходит обратно в раствор. Например:
Важнейшей характеристикой ионита является обменная емкость – количество поглощаемых им ионов [моль/г], [моль/м3]. Она зависит от числа активных групп на единицу массы или объема ионита и от степени диссоциации этих групп.
Общее число всех ионогенных групп, приходящееся на 1 г ионита характеризует его полную обменную емкость (ПОЕ). Методы определения ПОЕ стандартизованы. Обменная емкость ионита используется не полностью, а лишь на определенную величину (зависит от технологии процесса, гидродинамических условий, конструкции аппарата и т. д.), поэтому говорят о реальной емкости — рабочей (РОЕ). ПОЕ и РОЕ – главные показатели качества ионитов, т. к. являются мерой способности ионита к сорбции любых ионов, независимо от природы.
На обменную емкость ионитов влияют: структура ионита, набухаемость, рН (для сильных почти не влияет), концентрация, тип и размер ионов и др. Обменная емкость повышается с увеличением заряда иона, например:
А при одинаковой валентности – с ростом атомного радиуса, например:
для одновалентных катионов: 
для одновалентных анионов: 
Процесс ионного обмена проводят в статических и в динамических условиях. Обменная емкость будет называться соответственно статическая обменная емкость (СОЕ) и динамическая обменная емкость (ДОЕ).
СОЕ соответствует ионообменному равновесию между ионитом и данной концентрацией электролита. В раствор, содержащий ион, который нужно извлечь (например, 

Для проведения процесса в динамических условиях, ионит загружают в колонну, через которую с определенной скоростью пропускают раствор.
Характеристикой адсорбента в динамических условиях являются выходные кривые — зависимость концентрации сорбируемого вещества в фильтрате от объема раствора, прошедшего через колонну (рис.1).
Рис.1 Выходная кривая сорбции в динамических условиях.
Сначала вещество поглощается полностью или почти полностью. Таким образом, в процессе продвижения раствора через слои ионита, происходит обмен ионов и из колонны вытекает раствор, не содержащий тех ионов, которые были в начальном растворе. В точке Р происходит появление вещества в фильтрате — проскок. Затем кривая поднимается вверх, т. е. поглотительная способность сорбента падает. В точке D происходит полное насыщение ионита, большее количество вещества поглотиться уже не сможет. Для дальнейшего использования сорбента нужна регенерация.
ДОЕ характеризуется динамической емкостью до проскока ДОЕр и полной динамической емкостью ПДОЕ– до полного извлечения данного иона из раствора. При этом обязательно указывают в каких условиях проводился процесс – толщина, высота слоя, размер, структура частиц адсорбента, скорость процесса, концентрация и др.
На выходной кривой ДОЕр определяется площадью OPEF, а полная ДОЕ – площадью OPDF. Так же эти величины можно определить, вычислив количество поглощенных ионов (а) для каждой порции фильтрата (1), а затем сложив их.

где, 


Между величинами ДОЕ существует соотношение ДОЕр
http://vunivere.ru/work78049
http://pandia.ru/text/78/227/28021.php