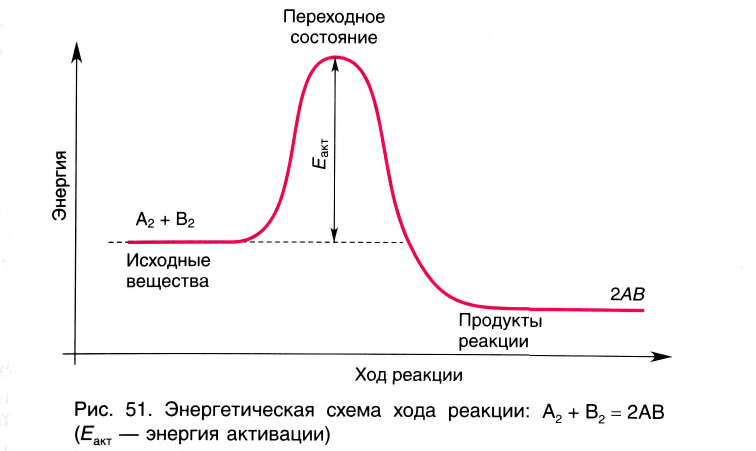
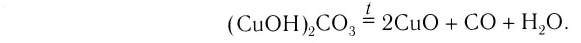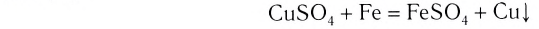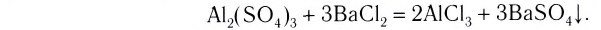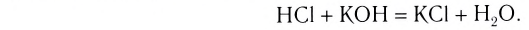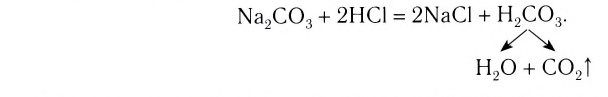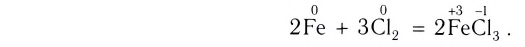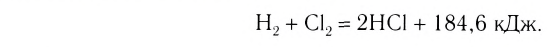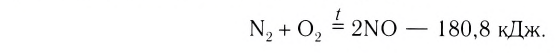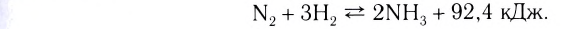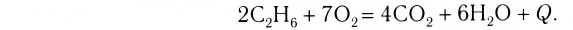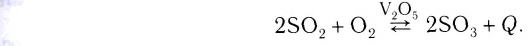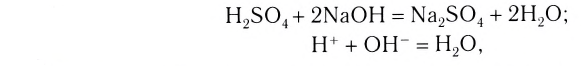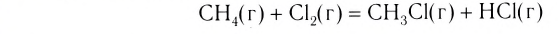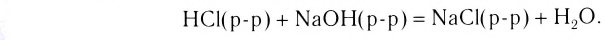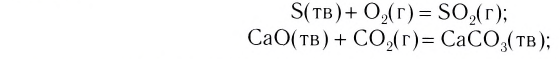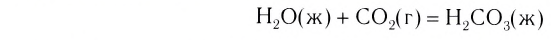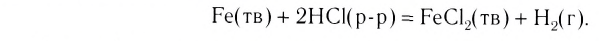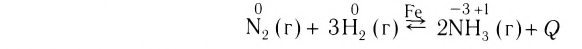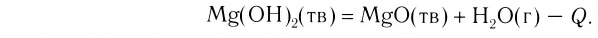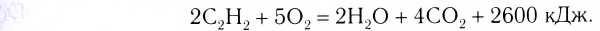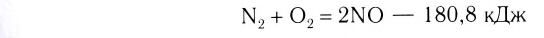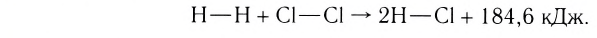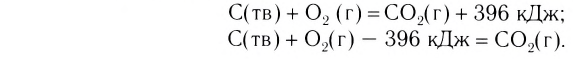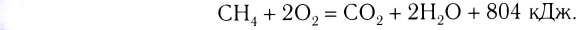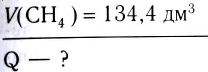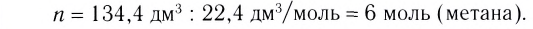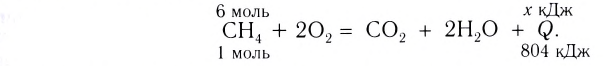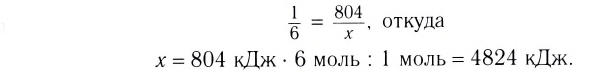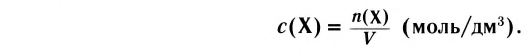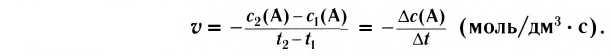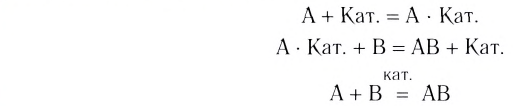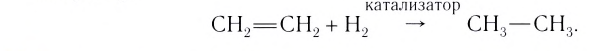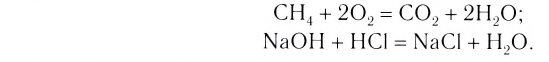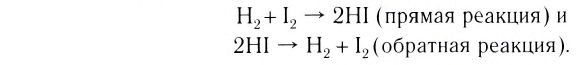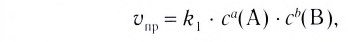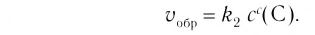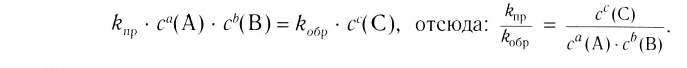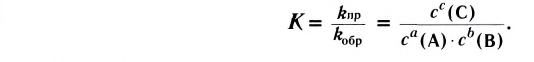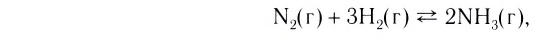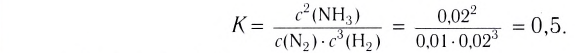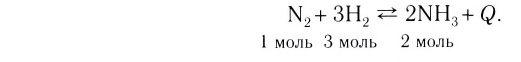Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Типы химических реакций
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный видеоурок посвящен изучению типов химических реакций по различным признакам. Вы узнаете, как определить тип химической реакции по числу и составу ее участников, по тепловому эффекту, по обратимости, по изменению степеней окисления и по участию катализатора.
Химические реакции в химии — виды, типы, формулы и определения с примерами
Содержание:
Классификация химических реакций:
Приступим к более подробному изучению отдельных типов реакций.
I. По составу и количеству вступающих в реакцию и полученных в результате реакции веществ существует 4 основных типа реакций.
Реакции, протекающие между кислотой и основанием с образованием нормальной соли и воды, называются реакциями нейтрализации. Реакции нейтрализации это особый вид реакций обмена.
II. По тепловому эффекту химические реакции подразделяются на экзотермические и эндотермические реакции. Как вам известно из курса VIl класса, химические реакции, протекающие с выделением теплоты, называются экзотермическими, а протекающие с поглощением теплоты эндотермическими реакциями.
III. По направлению протекания химические реакции подразделяются на необратимые и обратимые реакции.
Реакции, протекающие до конца, до полного израсходования одного из вступивших в реакцию веществ, называются необратимыми реакциями. В повседневной жизни мы часто встречаем необратимые процессы: сгорание бумаги, извержение вулкана, гниение фруктов, прокисание молока, скисание кефира, ржавление железа и др. Одним из веществ, полученных в результате необратимой реакции, протекающей в растворе, обязательно будет газ, осадок или вода.
Необратимые реакции всегда протекают в одном направлении. 
Последствия необратимых процессов
Реакции, протекающие в двух противоположных направлениях, называются обратимыми реакциями. В таких реакциях вместо одной стрелки ставятся две встречные стрелки (
IV По агрегатному состоянию вступающих в реакцию и полученных в результате реакции веществ реакции делятся на гомогенные и гетерогенные реакции.
Если вступающие в реакцию и полученные в результате реакции вещества находятся в одинаковом агрегатном состоянии (газ или жидкий раствор), то такие реакции называются гомогенными реакциями.
Если одно из вступивших в реакцию и полученных в результате реакции веществ находится в различном агрегатном состоянии, то такие реакции называются гетерогенными реакциями.
25 Окислительно-восстановительные реакции
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными реакциями.
Процесс отдачи электрона называют процессом окисления. Частица, отдающая электрон, становится восстановителем.
В процессе окисления степень окисления у элемента возрастает. Процесс присоединения электрона называют процессом восстановления. Атомы или ионы, присоединяющие к себе электрон, являются окислителями, а отдающие электрон восстановителями.
| Отдавать или принимать электроны могут не только атомы, но также ней тральные молекулы и ионы. |
| Процесс окисления | 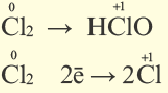 | 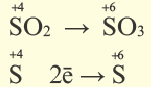 |
| Процесс восстановления | 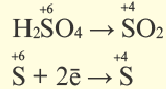 | 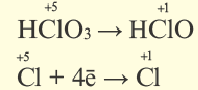 |
В окислительно-восстановительном процессе окислитель восстанавливается (получает электрон), а восстановитель окисляется (отдает электрон). Так как окисляющие или восстанавливающие атомы или ионы находятся в составе определенных соединений, эти соединения тоже, соответственно, называются окислителями или восстановителями.
Процессы окисления и восстановления происходят одновременно.
В процессах окисления восстановления число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
В окислительно-восстановительных реакциях для нахождения количества электронов, принятых и отданных элементом, используется числовая ось.
Элементы могут проявлять различные степени окисления. При обладании элементом минимальной степени окисления он может быть только восстановителем, а при максимальной степени окисления только окислителем. В промежуточных же значениях степени окисления он может быть как окислителем, так и восстановителем.
| Элемент | Степень окисления | Только восстановитель | И окислитель, и восстановитель | Только окислитель | |
| минимум | максимум | ||||
| F | -1 | 0 | F | F 0 | |
| Cl | -1 | +7 | Cl | Сl 0 , Сl +1 , Сl +3 , Сl +4 , Сl +6 | Сl +7 |
| S | -2 | +6 | S 2 | S, S 0 , S +2 , S +4 | S +6 |
| N | -3 | +5 | N 3 | N 0 , N +1 , N +2 , N +3 , N +4 | N +5 |
| C | -4 | +4 | C 4 | С 3 , С 2 , С 1 , С 0 , С +2 , С +3 | С +4 |
| Fe | 0 | +3 | Fe 0 | Fe +2 | Fe +3 |
| Mn | 0 | + 7 | Мn 0 | Мn +2 , Мn +4 , Мn +6 | Мn +7 |
В ряду активности металлов (Li ÷ Au) восстановительные свойства металлов ослабевают.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Со, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au 
Восстановительные свойства (химическая активность) ослабевают
В соответствии с рядом активности металлов, окислительные свойства ионов металлов усиливаются.
Li + , K + , Ca 2+ , Na + , Mg 2+ , Al 3+ , Mn 2+ , Zn 2+ , Cr 2+ , Fe 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+ , H + , Cu 2+ , Hg 2+ , Ag + , Pt 4+ , Au 3+

В отрицательно заряженных ионах изменение восстановительных свойств происходит следующим образом.
S 2- , I — , Br — , CL — , ОН — , SO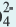

Восстановительные свойства ослабевают.
Составление окислительно-восстановительных реакций
Число электронов, отданных восстановителем, должно быть равно числу электронов, присоединенных окислителем. Учитывая это, проставление коэффициентов уравнений окислительно-восстановительных реакций производится по методу электронного баланса. Составление уравнений окислительно-восстановителных реакций методом электронного баланса происходит по следующим стадиям:
2. Над элементами с меняющимися степенями окисления проставляются их степени окисления: 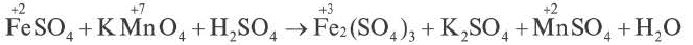
3. Записываются уравнения процессов окисления и восстановления, на основе элементов с меняющимися степенями окисления составляется электронный баланс.
| Если в правой и левой частях уравнения имеется разное число элементов с меняющимися степенями окисления или в обеих частях есть индекс, то это обязательно должно быть учтено в электронном балансе. |
4. Число отданных и принятых электронов в электронном уравнении записывается в крестообразной форме напротив процессов, после этого производят сокращения.
5. Найденные коэффициенты в электронном балансе, в первую очередь, записываются перед многоатомным простым веществом (если многоатомное простое вещество вступает в реакцию или является продуктом реакции, то его следует записать в электронном балансе как есть).
Если многоатомное простое вещество не участвует в реакции, тогда коэффициенты проставляются перед конечным продуктом реакции. Если различные элементы меняют степени окисления или же один и тот же элемент из одной степени окисления переходит в две разные степени окисления, то в электронном балансе найденные коэффициенты, в первую очередь, проставляются перед конечными продуктами реакции. Затем находятся коэффициенты других веществ. В нашем примере найденный в электронном балансе коэффициент 5 записывается перед Fe2(SO4)3, а коэффициент 2 перед MnSO4 и на основе этого находятся коэффициенты других веществ.
6. Если в окислительно-восстановительных реакциях степень окисления выражается дробным числом, в таком случае стехиометрические коэффициенты в уравнении находят следующим образом.
Поскольку найденный здесь коэффициент невозможно записать перед конечным продуктом (Fe), то он проставляется перед исходным веществом.
3Fe3O4 + 8А1 = 4A2O3 + 9Fe
7. Приведем пример перехода одного и того же элемента из определенной степени окисления в две разные степени окисления. В этом случае также найденный коэффициент, в первую очередь, записывается перед конечным продуктом реакции. 
8. Если один и тот же элемент переходит из двух различных степеней окисления в определенную степень окисления, то найденные в электронном балансе коэффициенты, в первую очередь, записываются перед исходными веществами. 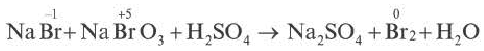
Проставив коэффициент 5 перед NaBr, а коэффициент 1 перед NaBrO3, определяем коэффициенты других веществ.
9. Если в окислительно — восстановительных реакциях степени окисления меняют более двух элементов, то это считается особым случаем окислительно-восстановительных реакций. В особых случаях окислительно-восстановительных реакций бывает два окислителя, один восстановитель или же два восстановителя и один окислитель. При составлении электронного баланса таких реакций учитывается число атомов элементов с меняющейся степенью окисления лишь в составе исходного вещества и многоатомное простое вещество отмечается в таком виде, как есть. Сумма полученных и отданных электронов определяется в отдельности. Найденные в электронном балансе коэффициенты, в первую очередь, записываются перед исходными и многоатомными простыми веществами.
Типы окислительно-восстановительных реакций
Окислительно-восстановительные реакции подразделяются на четыре типа:
Межатомные или межмалекулярные окислительно-восстановительные реакции
Если окислитель и восстановитель, будучи атомами различных элементов, входят в состав отдельных веществ, вступающих в реакцию, то такие реакции называют межатомными или межмолекулярными окислительно-восстановительными реакциями.
Если один и тот же элемент, находящийся как в составе окислителя, так и в составе восстановителя, изменяет свои степени окисления, то такие реакции тоже относятся к межмолекулярным окислительно-восстановительным реакциям.
Внутримолекулярные окислительно-восстановительные реакции
В ряде случаев окислительно-восстановительный процесс протекает внутри одной молекулы, т.е. одна из составных частей молекулы выступает в качестве окислителя, а другая в качестве восстановителя.
Если окислитель и восстановитель, будучи разными элементами, входят в состав одного вещества, вступающего в реакцию, то такие реакции называют внутримолекулярными окислительно-восстановительными реакциями.
Соединения, подверженные внутримолекулярному окислительно-восстановительному процессу, обычно отмечаются малой устойчивостью. Такие молекулы при условиях относительно высокой температуры подвергаются внутреннему окислительно-восстановительному процессу и распадаются.
Реакции диспропорционирования или самоокисления-самовосстановления
В некоторых многоатомных простых (в основном неметаллы) и сложных веществах атомы одних и тех же элементов выступают как в качестве окислителя, так и в качестве восстановителя. В это время этот элемент переходит из одной и той же степени окисления в две разные степени окисления. Такие реакции называют реакциями диспропорционирования или самоокисления-самовосстановления. К данному типу окислительно-восстановительных реакций относятся реакции между Cl2, Br2, NO2 с водой и щелочами (NOH,KOH и др.).
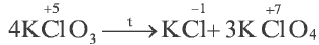
Реакции конмутации или антипропорционирования
В данных типах окислительно-восстановительных реакций атомы одних и тех же элементов, обладающие различными степенями окисления, превращаются в атомы с одинаковыми степенями окисления.
Скорость химических реакций
Из курса физики вам известен термин «скорость». Скорость это величина, характеризующая состояние движения тела. Как и механическое движение тела, химические реакции тоже протекают с различной скоростью.
Скорость гомогенных реакций
Изменение молярной концентрации (или количества моль) одного из вступивших в реакцию или полученных веществ в единицу времени называют скоростью гомогенных реакций. Чтобы знать скорость гомогенных реакций, надо вспомнить понятие молярной концентрации.
Формула скорости гомогенных реакций дана в таблице.
| Формула скорости гомогенных реакций | |
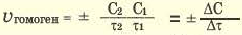 | |
| По изменению концентрации исходных веществ | По изменению концентрации конечного продукта |
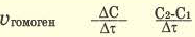 | 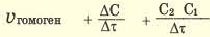 |
Здесь ΔC изменение концентрации исходного вещества и конечного продукта реакции, ∆τ время, затраченное на реакцию. Единица скорости гомогенной реакции выражается в виде 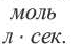
Графическое выражение изменения по времени молярной концентрации исходных веществ и конечных продуктов реакции называется кинетической кривой.
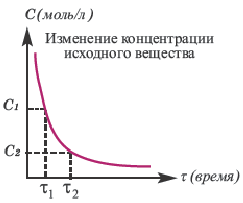 | 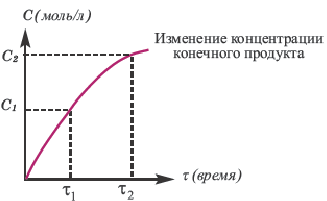 |
| Изменение концентрации исходного вещества будет ΔC = C2 — C1 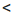 0. 0. | Изменение концентрации конечного продукта будет ΔC = C2 — C1  0. 0. |
Поскольку молярная концентрация 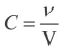
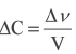
Изменение количества моль одного из вступивших в реакцию или полученных в результате реакции веществ за единицу времени в единице объема системы называют скоростью гомогенной реакции.
∆v выражает изменение количества моль исходного вещества и конечного продукта реакции, V обозначает объем сосуда, в котором протекает реакция.
Скорость гетерогенных реакций
Изменение количества моль одного из вступающих в реакцию веществ или конечных продуктов за единицу времени на единице поверхности называется скоростью гетерогенных реакций. Формула скорости гетерогенных реакций выражается в виде:
∆v= v2 v1 изменение количества вещества. S площадь поверхности соприкосновения твердого вещества, ∆τ время, затраченное на реакцию. C измельчением твердого вещества площадь поверхности соприкосновения увеличивается, и поэтому скорость реакции растет. Единица скорости гетерогеннои реакции выражается таким образом: 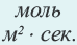
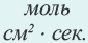
Реакции ржавления железа, свертывания молока, брожения глюкозы и т.д. это реакции, протекающие с медленной скоростью.
Факторы, влияющие на скорость химических реакций
Увеличение скорости химических реакций имеет большое практическое значение. Чем выше будет скорость за короткий период времени, тем больше можно получить веществ. Однако существуют и такие реакции, где, наоборот, требуется уменьшение их скорости, предотвращение их разрушительного действия. Например, реакции ржавления изделий из стали и чугуна, гниение материалов, изготовленных из дерева, и др. Для регулирования скорости химических реакций следует знать факторы, воздействующие на их скорость.
Влияние природы веществ
Чем активнее вещества, вступающие в реакцию, тем быстрее будет протекать реакция. Так, например, чем активнее металл, тем с большей скоростью протекает реакция. Скорость реакций щелочных металлов с соляной кислотой или с водой повышается с увеличением их порядкового номера и активности.
Влияние концентрации
Влияние концентрации на скорость реакции в основном имеет отношение к реакциям, протекающим в газообразной среде и в растворе. Скорость гомогенных реакций прямо пропорциональна произведению концентраций исходных веществ.
Эта зависимость для гомогенных реакций была установлена в 1867-ом году норвежскими учеными К.Гульдбергом и П.Baaгe и названа «законом действующих масс».
А(газ) + В(газ)=АВ(газ) 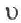
Если реагенты имеют коэффициенты, то концентрации веществ увеличиваются в соответствии с их коэффициентами.
mА(газ) + nВ(газ)=АmВn(газ) 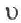
Здесь CA и CB молярная концентрация исходных веществ, к постоянная (константа) скорости реакции.
| Значение константы скорости реакции может меняться в зависимости от природы веществ и температуры, k не зависит от других факторов (от концепт рации, давления и т.д.). |
Уравнение скорости, показывающее зависимость скорости реакции от концентрации реагентов, называется кинетическим уравнением скорости реакции.
Следует отметить, что скорость реакции также зависит от того, по какому веществу она вычисляется. Подобное состояние наблюдается в том случае, когда стехиометрические коэффициенты веществ в уравнении реакции отличаются друг от друга. Например, в реакции, выраженной уравнением N2+ ЗН2 → 2NH3, скорость, вычисленная по водороду, в 3 раза выше скорости, вычисленной по азоту, и в 1,5 раза выше скорости, вычисленной по аммиаку. Т.е.
Если в уравнении гомогенной реакции стехиометрические коэффициенты веществ одинаковые, то скорость не зависит от того, по какому веществу ведутся вычисления.
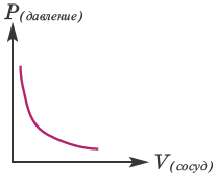 |  |  |
Влияние давления вступающих в реакцию газов. C повышением давления вступающих в реакцию газов увеличивается и скорость гомогенной реакции. В таком случае, в кинетическом уравнении реакции вместо концентрации можно записать парциальное давление газа.
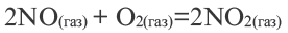
Влияние объема сосуда, в котором протекает реакция, на скорость реакции
Скорость реакции находится в обратно-пропорциональной зависимости от объема сосуда, в котором протекает реакция. Потому что с увеличением объема сосуда вероятность столкновения газов уменьшается и в результате скорость реакции замедляется.
Влияние температуры
Повышение температуры также увеличивает скорость реакций. В 1884-ом году голландский ученый Я.Х.Вант-Гофф установил зависимость скорости реакции от температуры, и эта зависимость была названа в его честь правилом Вант-Гоффа. Данное правило выражается так: с увеличением температуры на каждые 1O o C скорость большинства реакций увеличивается в 2÷4 раза. Математическое выражение этой зависимости следующее:
Здесь υtl t1 скорость при температуре и времени τ1, υt2 t2 скорость при температуре и времени 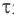
C повышением температуры увеличивается число и скорость движения молекул, активизированных за счет увеличения запасов внутренней энергии вещества. В результате увеличивается число эффективных столкновений молекул.
Влияние энергии активации
Количество энергии, затрачиваемой на активацию одного моля вещества, называют энергией активации, которая измеряется в кДж/моль. При меньшей энергии активации реакция протекает быстрее, а при большей медленнее.
Влияние площади поверхности твердого вещества. Скорость же гетерогенных реакций находится в прямо пропорциональной зависимости от площади поверхности твердого вещества (степени измельчения твердого вещества). Чем больше будет увеличена площадь поверхности при измельчении твердого вещества, тем больше увеличится площадь его столкновения соприкосновения с газообразным или жидким вещеcтвом. Вследствие этого, увеличивается и скорость реакции. Например, в ходе реакций Al и Zn с соляной кислотой при превращении их в порошок скорость реакций увеличивается.
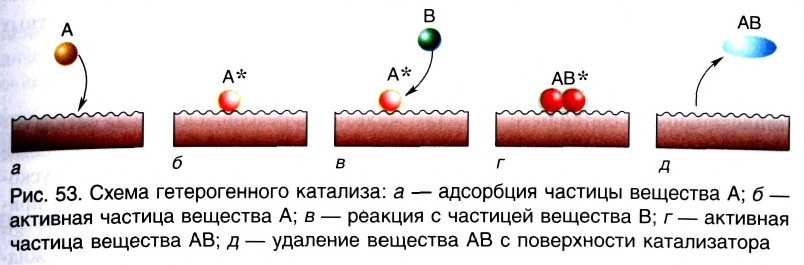
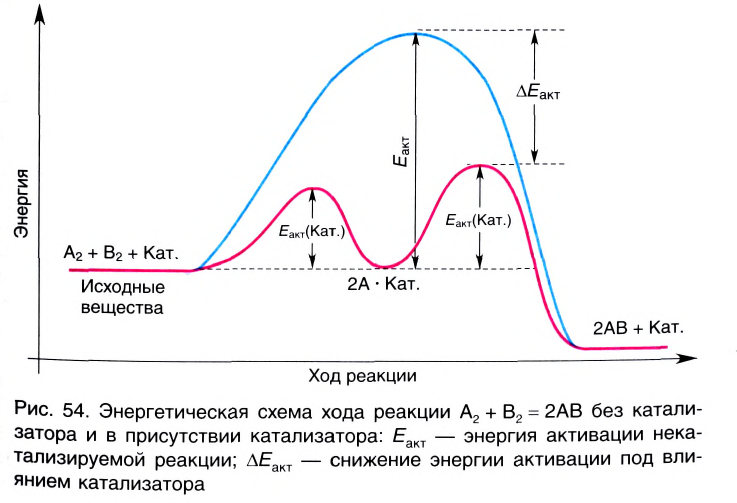
Влияние катализатора
Вещества, меняющие скорость реакции, оставаясь при этом химически неизменными в конце процесса, называют катализаторами; реакции, протекающие при участии катализатора, каталитическими реакциями, а само явление катализом. Участие катализаторов способствует протеканию реакции при более низких температурах.
Если вступающие в реакцию вещества и катализатор находятся в одном и том же агрегатном состоянии, это называется гомогенным катализом, а если в разных агрегатных состояниях гетерогенным катализом.
| Каталитические реакции | |
| Гомогенный катализ | Гетерогенный катализ |
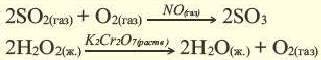 | 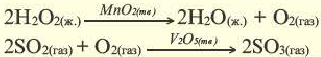 |
| Катализаторы | ||
| Твердые катализаторы | Жидкие катализаторы | Газообразные катализаторы |
| Pt, Ni,V2θ6, AI2O3, ZnO, AlCl3, FeCl3, MnO2, Cr2O3 | H2SO4, С2Н5ОН, Н3ВО3 (3%ый раствор), СН3ОН, Н2О2 | NO |
Катализаторы меняют значение константы скорости реакции (k) и уменьшают энергию активации (не воздействуют на тепловой эффект реакции). Существуют такие реакции, в которых полученный продукт играет роль катализатора и повышает скорость реакции. Такие реакции называются автокаталитическими реакциями.
Существует ряд веществ, участие которых в реакциях замедляет их скорость. Такие вещества называют отрицательным катализатором или ингибитором. Вещества, повышающие активность катализаторов, называются промоторами, а вещества, понижающие активность твердых катализаторов, каталитическими ядами. Например, добавленные к катализатору платине железо и алюминий промоторы.
Ингибиторы эти вещества:
- замедляют скорость реакции;
- предохраняют металлы от коррозии;
- используются при хранении продуктов питания.
Химическое равновесие
При нагревании закупоренной колбы Эйленмейера с водой, вначале в колбе начинают стремительно появляться водяные пары (I), после накопления определенного количества пара скорость испарения (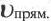
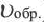
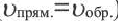
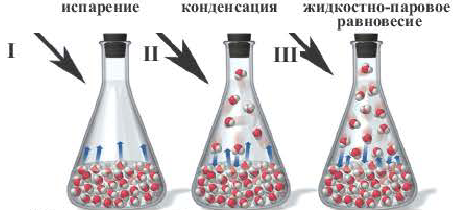
Образование жидкостно парового равновесия
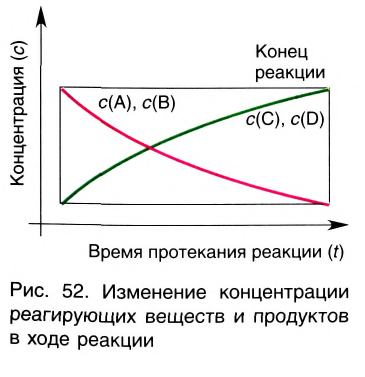
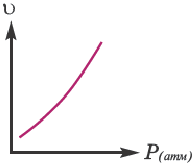
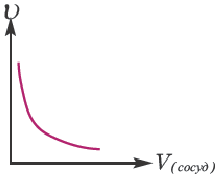
Если в результате химических реакций получаются газ, осадок и вода, то такие реакции являются необратимыми реакциями. Необратимых реакции не так много. В реакциях, протекающих до конца, концентрация исходных веществ уменьшается до нуля (1ый график). Большинство реакций обратимые.
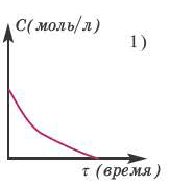
В обратимых реакциях концентрация исходных веществ не уменьшается до нуля (2-ой график).
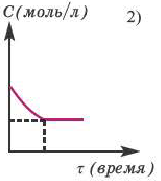
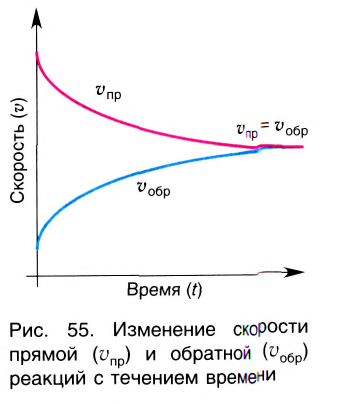
Состояние, при котором скорость прямой реакции в обратимых реакциях равна скорости обратной реакции, называют
состоянием химического равновесия.
Химическое равновесие происходит только в замкнутых системах и обратимых реакциях.
Состояние химического равновесия реакции можно также выразить количеством молекул, полученных и распадающихся в течение определенного времени.
Состояние, при котором число полученных за единицу времени молекул равно числу распадающихся молекул, называют состоянием равновесия. Концентрацию реагирующих веществ в состоянии равновесия называют равновесной концентрацией. Равновесная концентрация это часть вещества, не вступающая в реакцию.
Химическое равновесие динамично, при неизменности условий (концентрации веществ, температуры и давления) состояние равновесия не нарушается, т.е. прямые и обратные реакции протекают с одинаковой скоростью.
По левую сторону в уравнении реакции записываются вступающие в реакцию исходные вещества, а по правую сторону продукты реакции. Реакции, идущие в направлении слева направо, называются прямыми, а в направлении справа налево обратными. В начальной стадии обратимых реакций концентрация реагирующих веществ бывает высокой. В ходе реакции концентрация полученных конечных продуктов возрастает, а исходных веществ уменьшается. При увеличении концентрации полученных конечных продуктов в обратимых реакциях скорость реакции, направленной в сторону исходных веществ (влево), начинает возрастать. Через определенный промежуток времени в обратимых реакциях скорость прямой реакции равняется скорости обратной реакции
Константа равновесия. Отношение произведения равновесных концентраций конечных продуктов реакции к произведению равновесных концентраций исходных веществ является величиной постоянной, которая называется константой равновесия. Константа равновесия, будучи зависимой от природы вещества и температуры, вместе с тем не зависит от их концентраций, давления, объема, катализатора. Рассмотрим состояние равновесия реакции, обобщенно выраженной следующим уравнением:
аА +bВ
Применив к данной системе закон действующих масс, получим выражение скорости прямых и обратных реакций.
Здесь CА, СВ, CD, CE соответственно, являются равновесными концентрациями веществ А, В, С, Е; a, b, d, е стехиометрические коэффициенты; kпрям. и kобр, постоянные скорости. Согласно условию равновесия (
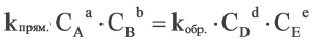
Так как соотношение постоянных скорости является постоянной величиной, это соотношение обозначается знаком К; математическое выражение химического равновесия называется константой равновесия.
Для определения равновесной концентрации (р.к.), исходную концентрацию (и.к.) или заграченную на реакцию концентрацию (з.р.к.) в обрагимых реакциях, следует построить схему реакции по нижеприведенному типу:
равновесная концентрация= исходная концентрация — затраченная на реакцию концентрация затраченная на реакцию концентрация= исходная концентрация -равновесная концентрация исходная концентрация=равновесная концентрация+ затраченная на реакцию концентрация
Если известна затраченная на реакцию концентрация одного из исходных веществ, то запишите это число над его формулой. На его основе вы можете определить затраченную на реакцию концентрацию другого исходного вещества и равновесную концентрацию конечного продукта. C другой стороны, если известна равновесная концентрация конечного продукта, то записав её над формулой, на её основе можно определить затраченную на реакцию концентрацию исходных веществ.
Факторы, влияющие на химическое равновесие
Как известно, равновесие происходит при 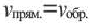
 | Влияние этих факторов на химическое равновесие определяется принципом Ле-Шателье (в честь французского ученого Генри Луиса Ле-Шателье). |
Принцип Ле-Шателье выражен следующим образом: Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие сместится в сторону ослабления этого воздействия.
Влияние концентрации на равновесие
Согласно принципу Ле-Шагелье, можно утверждать, что при увеличении концентрации одного из реагирующих веществ равновесие будет смещаться в сторону уменьшения концентрации данного вещества.
Для того, чтобы в реакции 2A(r)+ В(1)
Если в реакции CH4(r)+ H2O(пap) 
Для того, чтобы в обратимой реакции, протекающей с образованием воды, можно было направить равновесие вправо, в сторону продукта реакции, следует добавить в систему водопоглощающее вещество (концентрированную H2SO4).
Если в систему, находящуюся в состоянии равновесия, добавить одно из исходных веществ, то ее концентрация равновесия будет больше прежней концентрации, у другого же реагирующего вещества, наоборот, уменьшится, а у конечного продукта увеличится.
Если в систему протекающей обратимой реакции N2(r) + 3H2(r)
При удалении из системы конечного продукта реакции (NH3), ее новая равновесная концентрация будет меньше прежней равновесной концентрации, концентрации исходных веществ также уменьшатся, в итоге получится 2-ой график.
Влияние давления на равновесие. Влияние давления проявляется при газообразном состоянии реагирующих веществ. Повышение давления смещает равновесие реакции в сторону уменьшения объема (т.е. в сторону меньшего количества моль газов).
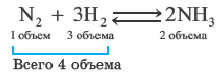
В реакции, представленной в виде данного уравнения, повышение давления смещает равновесие вправо, а понижение влево. При уменьшении давления равновесие смещается в сторону увеличения количества моль газов.
Если число моль вступающих в реакцию и образовавшихся газов одинаковое, то в таких реакциях изменение давления не влияет на равновесие.
Если в реакции в целом не участвует вещество в газообразном состоянии, то в таких случаях также давление не влияет на равновесие.
При повышении давления концентрация газов увеличивается. В таком случае, если в обратимой реакции N2 + 3H2 
Влияние температуры на равновесие
Говоря о влиянии температуры на равновесие, следует учитывать экзотермичность или эндотермичность реакции. Повышение температуры смещает равновесие экзотермических реакций в сторону исходных веществ (влево), а равновесие эндотермических реакций в сторону конечных продуктов (вправо). Понижение же температуры оказывает обратное действие.
В находящейся в состоянии равновесия реакции при определенной температуре получится столько же молекул, сколько их будет распадаться. Смещение равновесия в ту или иную сторону обусловлено разницей между поданной в систему температурой и температурой равновесия.
Катализаторы не влияют на смещение равновесия, так как в одинаковой степени ускоряют как прямые, так и обратные реакции.
На основе значения константы равновесия можно определить направление смещения равновесия. При К 
Пример №1
Гомогенная реакция выражена уравнением A(r)+B(r)=AB(r). Вычислите скорость реакции, если за время τ1 молярная концентрация вещества А равна 0,04 моль/л, а за время τ2— 0,01 моль/л в течение 50 сек. времени.
Решение: ΔC = C2-C1 = 0,01 — 0,04 = -0,03 моль/л
Δτ = τ2 -τ1 =50 сек.
Пример №2
В сосуде объемом 2 л проводится реакция 2A(г) + B(г)=D(г), Вычислите среднюю скорость реакции по веществу А, если в течение 10 сек в реакцию вступило 2 моль вещества А.
Решение:
Пример №3
Как изменится скорость реакции 2A(г) + B(г)=A2B(г) при увеличении парциального давления исходных веществ в 2 раза?
Решение: 
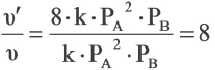
Значит, скорость увеличится в 8 раз.
Пример №4
Как изменится скорость реакции 2CO(г)+О2(г) = 2CO2(г) при уменьшении объема сосуда, в котором протекает реакция, в два раза?
Решение: При уменьшении объема сосуда в 2 раза концентрация СО и О2 также увеличивается в 2 раза. В таком случае: 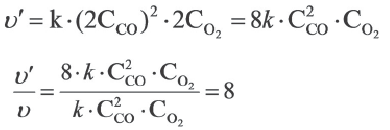
Значит, скорость увеличится в 8 раз.
Пример №5
Вычислите скорость реакции с температурным коэффициентом 2, протекающей при температуре 60 o C, если при температуре 20 o C ее скорость равна 0,01 мoль∕(л. сек).
Решение:
Пример №6
При какой температуре реакция с температурным коэффициентом 3 завершится за 6 сек., если при 20 o C она завершится за 54 сек.?
Решение: 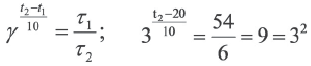
Так как основания равны, то и степени тоже будут равны. В таком случае:
Пример №7
На основе реакции N2+ ЗН2
| Равновесная концентрация азота (моль/л) | Концентрация азота, вступившего в реакцию (в %) |
| 0,4 | 20 |
Решение: Если в реакцию вступило 20% азота, то 80% его не вступило в реакцию. В таком случае:
0,4 → 80%
х → 20 % / х — 0,1 моль/л
Равновесная концентрация аммиака равна 0,2 моль/л.
Пример №8
Определите в реакции 2NO + O2 
| Вещества, вступающие в реакцию | Исходные концентрации (в моль/л) | Концентрация NO (в моль/л), расходуемой в реакции в момент равновесия |
| NO | 6 | 2 |
| O2 | 4 |
Решение:
Следовательно, равновесная концентрация NO 6-2=4; равновесная концентрация O2 — 4-1=3 моль/л.
Пример №9
Вычислите константу равеновесия реакции 2A(г) + Вод 
Решение:
| Вещества | Исходные концентрации (в моль/л) | Равновесная концентрация (в моль/л) |
| A | 4 | X |
| B | 2 | Y |
| C | 0 | 2 |
Пример №10
Вычислите объем сосуда (в л), в котором протекает реакция, если в реакции 2A(г) + В(г) 
Решение:
| Вещества | Исходные концентрации (в моль/л) | Равновесная концентрация (в моль/л) |
| A | 6 | X |
| B | 4 | 2 |
Пример №11
| Вещества | 1-ое состояние равновесия (в моль) | После добавление 2-ое состояние равновесия (в моль) |
| A | 2 | a |
| B | 3 | b |
| C | 6 | 7 |
Определите X, добавленный в реакцию A(г) + В(г) 
Решение:
Из таблицы видно, что концентрация конечного продукта увеличилась на 7-6=1 моль/л. Следовательно, в реакции было израсходовано 1 моль/л А и В.
В таком случае, A(г) + В(г) 
В I равновесии
Во II равновесии К не меняется, так как не зависит от концентрации. В таком случае, A(г) + В(г) 
Пример №12
На основании таблицы определите, какие выражения верны.
| Реакция, протекающая в закрытом сосуде | |
Х2(г) + 2Y(г)  2XY(г) 2XY(г) | |
| при 25 0 С | при 100 0 С |
| К=0,2 | К=0,02 |
I. C повышением температуры увеличивается и общее количество молей.
II. Прямая реакция эндотермическая.
III. При понижении температуры равновесие смещается вправо.
Решение: Если при повышении температуры константа равновесия уменьшается, значит, данная реакция экзотермическая. Константа равновесия уменьшилась в 0,2/0,02=10 раз.
В таком случае,
Следовательно, так как при повышении температуры равновесие смещается влево, то разлагается 2 моль XY и образуется 3 моль нового газа (1 моль Х2 и 2 моль Y). Т.е. общее количество моль увеличивается. При понижении температуры равновесие должно сместиться вправо. Следовательно, I и III выражения верные, a II выражение ошибочное.
Пример №13
Согласно графику относительно реакции
2СО + О2→ 2СО2, определите, какие выражения верные.
I. C(исходное)общее = 14 моль/л;
II. С(равновесия)общее = 11 моль/л;
III. K=0,1;
IV. В момент равновесия (t1) равновесные концентрации всех веществ одинаковые.
Решение:
С(исход.) O2=6 моль/л ;
С(исход.) O2=6 моль/л , в таком случае,
С(исход.) общее =6+6=12 моль/л (I выражение неверное)
С(равнов.)O2=5; Q(равнов.)CO=4; Q(равнов.)CO2=2 моль/л
С(равнов.) общее =5+4+2=11 моль/л (II выражение верное)
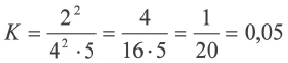
Из графика видно, что равновесные концентрации всех веществ в момент и разные (значит, IV выражение неверное).
Пример №14
На основе уравнения реакции
определите, сколько молей азотной кислоты превратилось в соль и сколько процентов подверглось восстановлению.
Решение: Продуктом восстановления азотной кислоты является NO, коэффициент которого составляет 2. Значит, из 8 молей азотной кислоты 2 моля было восстановлено, 8-2=6 молей потрачено на образование соли, а (2/8) ∙ 100%=25% подверглось восстановлению.
Пример №15
Определите, сколько молей серной кислоты, вступившей в реакцию 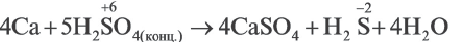
Решение: Коэффициент продукта восстановления (H2S) равен 1. В таком случае, на образование соли потрачено 5 1=4 моля, и (1/5) . 100%=20% подверглось восстановлению.
Метод электронного баланса наиболее удобен при составлении уравнений окислительно-восстановительных реакций, протекающих в газообразной или твердой фазе, т.е. в гетерогенной системе. Данный метод не отражает реального состояния ионов в растворе (MnO4, Cr2O 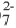
Пример №16
Определите X a в уравнении реакции
2X a + 16H + + 10Cl — →2Mn 2+ +8H2O + 5C12
Решение: Так как в правой части уравнения имеется 2Mn 2+ , то в составе X есть Мn. Поскольку в правой части имеется 8 атомов кислорода, то в составе X есть 4 атома кислорода. Сумма зарядов справа и слева должна быть равной.
В таком случае, 2а + 16 + 10( l)=2∙(+2); α = 1.
Значит, это ион X
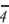
2Mn 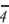
Таким образом, определением типа окислительно-восстановительных реакций и последовательным соблюдением правил проставления коэффициентов можно очень легко составить самые сложные окислительно-восстановительные реакции.
Пример №17
На основе графиков I и II относительно изменения концентраций исходных веществ определите, какие выражения верные.
1) I график относится к необратимым реакциям.
2) II график относится к необратимым реакциям.
3) I график относится к обратимым реакциям.
4) II график относится к обратимым реакциям.
Решение: Если концентрация исходных веществ уменьшается до нуля, то такие реакции являются необратимыми реакциями (I график), а если не уменьшаются до нуля обратимыми реакциями (II график).
Ответ: 1; 4
Пример №18
| 1) Реакция соединения 2) Реакция замещения 3) Реакция разложения 4) Реакция обмена | a) 4NO2+O2+2H2O → b) Cu (NO3)2 → с) KOH+HNO3→ d) Mg+ZnSO4→ е) Ca(OH)2+H2SO4→ |
Решение:
| a) 4NO2 + O2+ 2H2O → 4HNO3 b) Mg + ZnSO4 → MgSO4 + Zn с) 2Cu(NO3)2→ 2CuO + 4NO2 + O2 d) KOH + HNO3 → KNO3 + H2O е) Ca(OH)2 + H2SO4 → CaSO4 + 2H2O | (1) (2) (3) (4) (4) |
Пример №19
Выберите из представленных реакций реакции: а) соединения; b) обмена; с) замещения.
| 1) Fe+O2 + H2O → 4) Na2CO3+CaBr2 → | 2) CaCO3 → 5) Fe + Cu(NO3)2 → | 3) CaO + H2O → 6) FeCl2+NaOH → |
Решение:
Химические реакции
В этом разделе обобщена информация об известных вам типах химических реакций. Будут также рассмотрены реакции, которые вы еще не изучали. Обратим внимание на их характерные признаки и особенности протекания. Выполняя упражнения, вы приобретете новые навыки по составлению химических уравнений.
Признаки, по которым классифицируют химические реакции
Превращения одних веществ в другие постоянно происходят в природе. Без них невозможно развитие живых организмов. Изучением химических реакций и получением новых веществ занимаются ученые в исследовательских лабораториях. Различные реакции осуществляют инженеры и технологи на заводах, школьники и студенты при выполнении практических работ.
Химические реакции могут протекать медленно или мгновенно, в обычных условиях или при нагревании, с добавлением катализатора или без него. Они могут сопровождаться различными внешними эффектами — образованием осадка или газа, изменением цвета, выделением теплоты и т. д.
Чтобы установить порядок во множестве химических реакций, осуществлена их классификация. При этом были учтены определенные признаки и особенности реакций. Важнейшие из них приведены ниже:
- число реагентов и продуктов реакции;
- возможные направления протекания реакции;
- изменение или неизменность степеней окисления элементов в результате реакции;
- выделение или поглощение теплоты во время реакции.
В этом параграфе обобщены ваши знания о реакциях соединения, разложения, замещения и обмена, а также рассмотрены реакции, которые могут протекать в различных направлениях. О других типах реакций речь пойдет позже.
Реакции соединения и разложения
Реакцию, в результате которой из нескольких веществ образуется одно вещество, называют реакцией соединения.
Реакция соединения: А + В ( + . ) 
Вам известны реакции соединения, в которые вступают
- два простых вещества (рис. 31)
Не все такие реакции возможны. Например, инертные газы — гелий, неон и аргон не взаимодействуют ни с одним веществом. Не происходят реакции кислорода с галогенами, водорода с бором силицием. Золото реагирует только с наиболее активными неметаллами — галогенами, а также с некоторыми соединениями. Оксиды вступают в реакции друг с другом, если они отличаются по химическим свойствам. Так, основные оксиды взаимодействуют с кислотными и амфотерными оксидами.
Рис. 31. Реакция алюминия с бромом
Реакцию, в результате которой из одного вещества| образуется несколько веществ, называют реакцией разложения.
Разлагаться могут только сложные вещества. J Среди них — основания, амфотерные гидрокси-ды, оксигенсодержащие кислоты и их соли,] некоторые оксиды (рис. 32):
Рис. 32. Разложение Меркурий(II) оксида
Реакции разложения происходят, как правило, при нагревании. Карбонатная и сульфитная кислоты разлагаются в обычных условиях в момент образования:
Продуктами разложения оснований, оксигенсодержащих кислот и большинства их солей являются оксиды. Не разлагаются при нагревании гидроксиды, карбонаты и сульфаты Натрия и Калия, а также оксигенсодержащие соли, каждая из которых образована двумя нелетучими оксидами (фосфаты, силикаты, цинкаты, алюминаты и др.).
Реакции замещения и обмена
Изучая химические превращения неорганических соединений, вы узнали о реакциях, в каждой из которых — два реагента и два продукта.
Реакцию между простым и сложным веществом, в результате которой образуются другие простое и сложное вещества, называют реакцией замещения.
Реакция замещения: А + ВС 
Реакции замещения с участием металлов вам хорошо известны.
Щелочные и щелочноземельные металлы реагируют с водой:
В этой реакции один из двух атомов Гидрогена в каждой молекуле воды замещается на атом (точнее — на ион) металлического элемента.
Почти все металлы реагируют с кислотами. Часть этих реакций происходит с выделением водорода:
Так взаимодействуют с металлами хлоридная и разбавленная сульфатная кислоты. Реакция возможна, если металл находится в ряду активности левее водорода.
Металлы могут взаимодействовать с растворами солей. Продуктами такой реакции являются другой металл и новая соль:
Подобные реакции происходят, если металл-реагент размещен в ряду активности слева от металла-продукта.
Рис. 33. Реакция алюминия с водным раствором щелочи
Цинк, алюминий (рис. 33), олово, другие активные металлы, которым соответствуют элементы, образующие амфотерные оксиды и гидроксиды, взаимодействуют со щелочами:
В реакции замещения могут вступать и неметаллы. Например, более активный галоген вытесняет менее активный из водного раствора галогеноводорода, т. е. безоксигеновой кислоты, или соли (галогенида):
Напоминаем, что химическая активность галогенов возрастает в группе периодической системы снизу вверх.
Реакцию между двумя сложными веществами, в результате которой они обмениваются своими составляющими (атомами, группами атомов, ионами), называют реакцией обмена.
Реакция обмена: АВ + CD 
Рис. 34. Осаждение кадмий сульфида
Реакции обмена происходят преимущественно в водном растворе. В них участвуют электролиты — основания, кислоты, соли. Случаи, когда эти реакции возможны, вам известны. Это — выделение осадка (рис. 34), образование газа или слабого электролита (в том числе и воды):
Обратимые и необратимые реакции
Многие химические реакции протекают только «в одном направлении». Их продукты при любых температуре и давлении не могут взаимодействовать с образованием веществ, которые ранее были реагентами. Такие реакции называют необратимыми.
Натрий реагирует с водой согласно уравнению
Это — необратимая реакция, поскольку противоположное превращение невозможно:
Известны и реакции другого типа. Кальций оксид в обычных условиях медленно взаимодействует с углекислым газом:
Если продукт этой реакции — кальций карбонат — сильно нагреть, то он начнет разлагаться на кальций оксид и углекислый газ, т. е. будет происходить реакция
В определенном температурном интервале возможно как образование кальций карбоната, так и его разложение. В этих условиях обе реакции не происходят до конца, и в закрытом сосуде можно обнаружить смесь трех соединений — кальций оксида, карбон(IV) оксида и кальций карбоната.
Химические реакции, которые могут протекать в противоположных направлениях, называют обратимыми.
Обратимая реакция:
Некоторые реакции являются обратимыми в обычных условиях. Среди них — взаимодействие углекислого и сернистого гааов с водой.
Реакцию, которая происходит между веществами, записанными в левой части химического уравнения, называют прямой, а противоположную реакцию — обратной. Одновременное протекание этих реакций показывают в уравнении с помощью знака обратимости 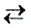
Обратимыми бывают и физические явления. Среди них — изменения агрегатного состояния вещества. Если сосуд, в котором кипит вода, накрыт крышкой, то в нем одновременно происходят два противоположных процесса — превращение воды в пар и конденсация водяного пара с образованием жидкой воды.
Выводы:
Для классификации химических реакций используют различные признаки.
Сопоставляя число продуктов и реагентов, а также учитывая, простым или сложным является каждое вещество, различают реакции соединения, разложения, замещения и обмена.
В зависимости от направления протекания химические реакции делят на обратимые (они могут происходить в прямом и обратном направлениях) и необратимые (возможна лишь прямая реакция).
Окислительно-восстановительные реакции
Сравним два химических превращения:
Учитывая число реагентов и продуктов в каждой реакции, делаем вывод: реакция (1) является реакцией разложения, а реакция (2) — реакцией соединения.
Эти реакции различаются и по другому признаку. Обратим внимание на степени окисления элементов в реагентах и продуктах.
Запишем степени окисления элементов над формулами веществ:
В результате первой реакции степени окисления элементов остались прежними, а во второй реакции изменились.
Реакции, протекающие с изменением степенен окисления элементов, называют окислительно-восстановительными реакциями.
Процессы окисления и восстановления
Выясним происхождение термина «окислительно-восстановительная реакция». Характеризуя реакции с участием кислорода в 7 классе, мы утверждали, что вещество, которое взаимодействует с кислородом, подвергается окислению. В реакции (2) таким веществом является магний. Каждый атом этого металла превращается в катион, теряя 2 электрона:
Элемент Магний повышает степень окисления от 0 до +2; он окисляется.
С магнием взаимодействует кислород. Каждый атом Оксигена, который входит в состав молекулы 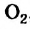
Степень окисления этого элемента понижается от 0 до -2; Оксиген восстанавливается.
Окисление — отдача электронов частицей вещества, а восстановление — присоединение ею электронов.
Процессы окисления и восстановления всегда сопровождают друг друга. Электроны не возникают из ничего и не накапливаются в пробирке. Сколько электронов теряют одни частицы, столько же их присоединяют другие. Убедимся в этом, обратившись к уравнению
Два атома Магния теряют 4 электрона:
а два атома Оксигена, которые имеются в молекуле 02, присоединяют 4 электрона:
Теорию окислительно-восстановительных реакций, которую назвали электронно-ионной теорией, предложил в 1914 г. отечественный ученый Л. В. Писаржевский.
Окислители и восстановители
По отношению к веществам — участникам окислительно-восстановительной реакции используют термины «окислитель» и «восстановитель».
Запомните: окислитель восстанавливается (им в реакции 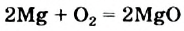
Окислителями и восстановителями могут быть не только простые вещества, но и сложные.
На основании изложенного материала сделаем вывод: если в реакции принимает участие простое вещество, то такая реакция всегда является окислительно-восстановительной. Действительно, степень окисления элемента в простом веществе равна нулю, а в соединении (оно образуется в результате реакции) является положительным или отрицательным числом.
В клетках таблицы растворимости, отвечающих солям 
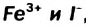
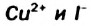
Катионы металлических элементов являются окислителями, а анион Иода — восстановителем.
Значение окислительно-восстановительных реакций
Окислительно-восстановительные реакции постоянно происходят в природе. Они составляют основу таких важнейших процессов, как дыхание и фотосинтез. В этих процессах одним из элементов, которые изменяют степень окисления, является Оксиген. В процессе дыхания его атомы (из них состоят молекулы кислорода) восстанавливаются, а при фотосинтезе (они входят в состав молекул оксигенсодержащих соединений) — окисляются:
Окислительно-восстановительные реакции используют во многих отраслях промышленности. Осуществляя химические превращения этого типа, из руд получают металлы. На теплоэлектростанциях сжигают различные виды топлива, а в двигателях автомобилей — бензин, дизельное горючее, природный газ.
Рис. 35. Корпус судна, поврежденный ржавчиной
Некоторые окислительно-восстановителыые реакции являются причиной негативных процессов: пожаров, ржавления железа (рис. 35), порчи пищевых продуктов и т. п.
Выводы:
Реакции, происходящие с изменением степеней окисления элементов, называют окислительно-восстановительными реакциями. Окисление — процесс отдачи электронов частицами вещества, а восстановление — процесс присоединения электронов. Вещество, которое окисляется, называют восстановителем, а вещество, которое восстанавливается, — окислителем. Сколько электронов отдает восстановитель, столько их присоединяет окислитель.
Окислительно-восстановительные реакции происходят в природе; их осуществляют в промышленности, теплоэнергетике, транспортных средствах.
Составление уравнений окислительно-восстановительных реакций
Прежде чем составить уравнение окислительно-восстановительной реакции, необходимо записать схему реакции с формулами всех реагентов и продуктов.
Прогнозирование продуктов многих окислитель-но-восстановительных реакций невозможно без знания характерных степеней окисления элементов, химических свойств их соединений, другой важной информации.
В этом параграфе ограничимся рассмотрением того, как превращают «готовые» схемы окислительно-восстановительных реакций в химические уравнения.
Подбор коэффициентов в схемах таких реакций можно осуществлять обычным способом.
Во многих случаях (например, когда взаимодействуют или образуются три вещества) на традиционный подбор коэффициентов приходится тратить немало времени. Убедитесь в этом, попробовав превратить схему реакции
в химическое уравнение.
Существует универсальный и эффективный метод подбора коэффициентов в схемах окислительно-восстановительных реакций. Его название — метод электронного баланса. Он основан на том, что число электронов, которые отдают одни частицы и присоединяют другие, всегда одинаково.
Это интересно. В реакции 4FeS + 702 = = 2Fe2Os + + 4S02 степени окисления изменяют три элемента.
Подберем коэффициенты методом электронного баланса в последней схеме окислительно-восстановительной реакции.
Сначала определим степень окисления каждого элемента в реагентах и продуктах реакции и подчеркнем элементы, которые изменили свои степени окисления:
Вы видите, что Феррум повысил степень окисления от +2 до +3, выступил восстановителем и окислился, а Оксиген понизил степень окисления от 0 до -2, выполнил функцию окислителя и восстановился:
Обратите внимание: в схеме восстановления перед атомом Оксигена поставлен коэффициент 2, так как из одной молекулы кислорода образуются два атома. Указано также, что молекула кислорода присоединяет 4 электрона, поскольку каждый атом Оксигена в ней присоединяет 2 электрона.
Находим соотношение частиц окислителя и восстановителя, при котором число присоединяемых и число отдаваемых ими электронов будет одинаковым. Для этого определяем наименьшее общее кратное чисел 1 (один электрон теряет атом 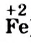
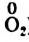
Записываем схему окисления, под ней — схему восстановления, а после вертикальных линий — только что указанные количества электронов и наименьшее общее кратное:
Разделив число 4 на количество электронов, которые теряются (1) и присоединяются (4), получаем числа 4 и 1 для схем окисления и восстановления соответственно. Записываем их за третьей вертикальной линией:
Числа в последнем столбике — 4 и 1 — это коэффициенты в будущем уравнении. В самом деле, каждые 4 атома 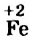
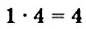
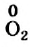
Записываем коэффициенты 4 перед формулами соединений Феррума, а коэффициент 1 перед формулой кислорода не указываем:
Далее ставим коэффициент 2 перед формулой воды:
Наконец, определяем коэффициент перед формулой хлороводорода — соединения, в котором содержатся элементы, не изменившие степени окисления, и вместо стрелки записываем знак равенства:
Примите во внимание два таких совета.
1. Найденные с учетом баланса электронов коэффициенты перед формулами окислителя и восстановителя изменять не следует; они являются окончательными.
2. В некоторых реакциях окисляется или восстанавливается лишь часть атомов определенного элемента, поскольку один из реагентов присутствует в избытке:
Коэффициент перед формулой такого соединения подбирают последним.
Выводы:
Уравнения окислительно-восстановительных реакций составляют, используя метод электронного баланса. Этот метод основан на том, что число электронов, отдаваемых частицами восстановителя и присоединяемых частицами окислителя, одинаково.
Экзотермические и эндотермические реакции
Вам известны реакции, которые происходят с выделением значительного количества теплоты. Это — реакции горения:
Еще в далекие времена люди обогревали свои жилища, готовили пищу, сжигая древесину, растительные остатки, уголь. Ныне сфера применения реакций горения значительно расширилась. Их осуществляют на теплоэнергетических предприятиях, металлургических заводах, в двигателях внутреннего сгорания, при запусках ракет и космических кораблей, при создании фейерверков(рис. 36) и т. д.
Рис. 36. Праздничный фейерверк
Теплота выделяется не только при горении веществ. Смешайте в пробирке небольшие порции растворов щелочи и сильной кислоты. Прикоснувшись к нижней части пробирки, вы почувствуете, что она стала теплой. Выделение теплоты является следствием реакции нейтрализации:
Аналогичный эффект наблюдается при гашении извести
взаимодействии металлов с кислотами
Реакции, при которых теплота выделяется, часто происходят самопроизвольно. Правда, в некоторых случаях их нужно инициировать (например, поджечь вещество).
Существуют реакции, при которых теплота поглощается. Среди них — реакции разложения многих соединений (оксидов, гидроксидов, оксигенсодержащих солей, кристаллогидратов):
Для того чтобы такие реакции происходили, вещества нагревают. Если нагревание прекратить, то прекращается и химическое превращение.
Реакции, протекающие с выделением теплоты, называют экзотермическими, а протекающие с поглощением геплоты — эндотермическими. Термины происходят от греческих слов ехо — извне и endon — внутри.
Тепловой эффект реакции
Выделение или поглощение теплоты при химической реакции называют тепловым эффектом реакции. Выясним причину его возникновения.
Каждое вещество обладает внутренней энергией (ее обозначают латинской буквой U). Эта энергия состоит из энергий всех его частиц (атомов, молекул, ионов) и энергий химических связей между ними. Разрыв химических связей в веществе требует затрат энергии (вещество ее поглощает), а их образование происходит с выделением энергии. Внутреннюю энергию вещества измерить невозможно.
Представим себе, что в случае некоторой реакции общая внутренняя энергия реагентов больше внутренней энергии продуктов:
Тогда в результате реакции вещества «отдают» часть своей энергии; происходит выделение теплоты. Следовательно, данная реакция является экзотермической.
Уменьшение внутренней энергии веществ выразим математически, использовав специальный знак 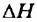
Если общая внутренняя энергия реагентов меньше внутренней энергии продуктов
то в результате реакции вещества «потребляют» энергию и теплота поглощается. Такая реакция является эндотермической:
В случае необходимости тепловой эффект указывают вместе с химическим уравнением:
Явление выделения (поглощения) теплоты при химической реакции согласуется с принципом сохранения энергии: энергия не возникает из ничего, не исчезает бесследно, а лишь превращается из одного вида в другой.
Термохимическое уравнение
Количество выделяемой или поглощаемой теплоты в результате реакции можно определить экспериментально, например с помощью калориметра — устройства, известного вам из уроков физики в 8 классе.
Химическое уравнение с записью числового значения теплового эффекта реакции называют термохимическим уравнением.
Примеры термохимических уравнений:
Первое уравнение свидетельствует о том, что при разложении 1 моль сульфатной кислоты с образованием 1 моль сульфур(VI) оксида и 1 моль воды поглощается 177 кДж теплоты.
Многие реакции являются обратимыми. Например, кальций карбонат при нагревании разлагается на соответствующие оксиды (это — эндотермическая реакция)
а в обычных условиях эта соль образуется из оксидов (экзотермическая реакция):
Знак «плюс» перед значением теплового эффекта не опускают.
Тепловой эффект химической реакции равен тепловому эффекту обратной реакции, но имеет противоположный знак.
Значения тепловых эффектов многих химических реакций приведены в справочниках.
Термохимические расчеты
Рассмотрим, как решают задачи на составление и использование термохимических уравнений.
Пример №20
При сгорании 0,5 моль фосфора в избытке кислорода выделилось 373 кДж теплоты. Составить термохимическое уравнение.
Дано:
Решение:
1. Составляем химическое уравнение:
2. Вычисляем тепловой эффект реакции.
По условию задачи при сгорании
0,5 моль фосфора выделяется 373 кДж теплоты, согласно термохимическому уравнению при сгорании 4 моль фосфора — х кДж теплоты;
3. Записываем термохимическое уравнение:
Ответ:
Пример №21
Исходя из термохимического уравнения 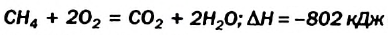
Дано:
Решение:
1. Находим количество вещества метана:
2. Вычисляем количество теплоты 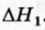
Согласно термохимическому уравнению при сгорании 1 моль метана выделяется 802 кДж теплоты, по условию задачи при сгорании 0,25 моль метана — х кДж теплоты;
Ответ: при сгорании 5,6 л метана выделяется 200,5 кДж теплоты 
Выводы:
Все химические превращения происходят с определенным тепловым эффектом. Реакции, протекающие с выделением теплоты, называют экзотермическими, а протекающие с поглощением теплоты — эндотермическими.
Химическое уравнение с записью числового значения теплового эффекта реакции называют термохимическим уравнением.
Калорийность пищевых продуктов
Общеизвестно, что пища является источником веществ и элементов, необходимых для жизни животных и человека. Кроме того, это — источник энергии для живых организмов. Реакции в организме с участием веществ, потребленных с пищей, преимущественно экзотермические, т. е. происходят с выделением теплоты. Большинство этих превращений напоминает реакции горения. (Иногда, например, говорят о « сгорании жиров в организме».) Количество энергии, которое выделяется при полном окислении пищевого продукта (условно — его реакции с кислородом, в результате которсй образуются углекислый газ, вода, азот, некоторые другие вещества), определяет калорийность (слово происходит от названия устаревшей единицы измерения количества теплоты — калории; 1 калория — 4,18 Дж) продукта (рис. 37). Высвободившаяся тепловая энергия необходима живому организму для осуществления в нем реакций, протекающих с поглощением теплоты, а также для поддержания постоянной температуры тела.
Рис. 37. Средняя калорийность пищевых продуктов
Существуют три основные группы питательных веществ в пищевых продуктах: белки, жиры и углеводы.
Важнейшими жирами являются подсолнечное и кукурузное масло (растительные жиры), сало, сливочное масло (животные жиры), а углеводами — сахар и крахмал. Больше всего теплоты выделяется при окислении жиров — в среднем 3900 кДж в перерасчете на 100 г жира. Белки и углеводы имеют значительно более низкую и почти одинаковую калорийность — приблизительно 1700 кДж на 100 г вещества. Если подсолнечное масло состоит практически из жиров, сахар — чистый углевод, то 100-процентной белковой пищи не существует. Больше всего белков содержится в мясе, рыбе, яйцах, сыре, орехах (10—25 % от массы продукта). Белки — ценнейший «строительный» материал для организма, а углеводы и особенно жиры важны как источники энергии.
Суточная энергетическая потребность человека составляет в среднем 12 ООО кДж и зависит от его возраста, физической и умственной нагрузки. Подсчитать, сколько человек должен потреблять белков, жиров, углеводов, тех или других пищевых продуктов, чтобы обеспечить свой организм необходимым количеством энергии, нетрудно. Сложнее выбрать необходимое для организма соотношение, например. животных и растительных жиров. Соответствующие рекомендации разрабатывают биологи, врачи, диетологи.
Скорость химической реакции
Выполнив немало лабораторных опытов, вы убедились в том, что одни химические реакции протекают мгновенно (например, реакции обмена с образованием осадка), другие — достаточно быстро (горение веществ), а некоторые — медленно (реакции разложения). Химические превращения минералов в природных условиях вообще не удается заметить, даже наблюдая за веществами в течение многих лет.
Каждая реакция протекает с определенной скоростью. Знание скорости реакции, а также факторов, от которых она зависит, умение ее прогнозировать и вычислять необходимы инженерам, технологам для того, чтобы регулировать протекание реакций, замедлять нежелательные и ускорять те, которые следует осуществить.
Скорость реакции, происходящей в однородной смеси, определяют по изменению количества вещества реагента (продукта) в единице объема смеси за единицу времени:
В этой формуле 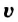
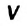
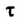
Зависимость скорости реакции от различных факторов
На скорость реакции влияют химическая природа реагирующих веществ, их концентрации (если реагируют газы или растворенные вещества), площадь поверхности контакта веществ (в неоднородных смесях), температура, иногда — наличие посторонних веществ.
Влияние химической природы реагентов на скорость реакции
Надеемся, что вы согласитесь с таким утверждением: скорость реакции определяется химической активностью реагентов. Хорошо известно, что металлы неодинаково ведут себя и химических реакциях. Об этом свидетельствует их ряд активности. Например, реакции щелочных металлов с водой происходят довольно быстро, иногда — со взрывом, а щелочноземельные металлы взаимодействуют с ней медленнее.
Влияние концентрации реагентов на скорость реакции
Под концентрацией (Слово «концентрация» происходит от латинского суффикса con, соответствует русскому предлогу с,) и слова centrum — сосредоточение, накопление) вещества понимают его количественное содержание в растворе. Один из способов выражения концентрации вам известен. Это — массовая доля растворенного вещества.
Скорость реакции с увеличением концентрации реагента возрастает
Эту зависимость объясняют так. Увеличение концентрации реогента означает возрастание числа его частиц (атомов, молекул, ионов) в реакционной смеси. Количество столкновений частиц этого вещества с частицами другого реагента увеличивается, и скорость реакции возрастает (рис. 38).
В результате химической реакции исходные вещества расходуются; их концентрации уменьшаются. Поэтому реакция со временем замедляется.
Влияние площади поверхности контакта реагентов на скорость реакции
Этот фактор имеет место, если взаимодействие веществ происходит в неоднородной смеси.

Рис. 38. Реакция кальций карбоната (мрамора) с хлоридной кислотой
ЛАБОРАТОРНЫЙ ОПЫТ:
Зависимость скорости реакции в неоднородной смеси от площади поверхности контакта реагентов
В пробирку насыпьте немного цинкового порошка и налейте 2 мл хлоридной кислоты с массовой долей 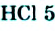
Реакция кислоты с порошком металла происходит с большей скоростью. Объясним результат опыта. Согласно ионно-молекулярному уравнению
в реакции принимают участие атомы Цинка и катионы Гидрогена. Взаимодействовать с ионами 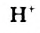
Скорость реакции с увеличением площади поверхности контакта реагентов возрастает.
Влияние температуры на скорость реакции
Для того чтобы ускорить протекание некоторых реакций, вы нагревали вещества. Подтвердите такое влияние температуры на химические превращения, выполнив еще один опыт.
ЛАБОРАТОРНЫЙ ОПЫТ: Зависимость скорости реакции от температуры
В две пробирки насыпьте по 0,5 г порошка купрум(Н) оксида и налейте в каждую по 2—3 мл хлоридной кислоты с массовой долей НС1 5 %. Содержимое пробирок осторожно перемешайте. Одну пробирку поставьте в штатив, а другую нагрейте, но не до кипения. После того как осядет остаток оксида, сравните цвет растворов.
Скорость реакции с повышением температуры возрастает.
Влияние температуры на протекание реакции можно объяснить так. При нагревании жидкости или газа увеличивается скорость движения молекул, а твердого вещества — интенсивность колебаний частиц в нем. В результате число столкновений частиц реагентов возрастает, а это приводит к увеличению скорости реакции.
Влияние посторонних веществ на скорость реакции
В некоторых случаях скорость реакции или возможность ее протекания зависит от наличия постороннего вещества.
Известно, что гидроген перокенд 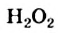
Некоторые вещества ускоряют эту реакцию. Если к раствору гидроген пероксида добавить порошок манган(IV) оксида, то сразу начинается интенсивное выделение кислорода (рис. 39).
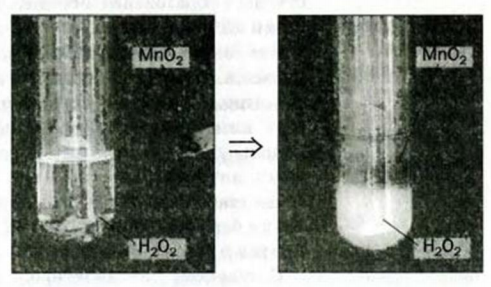
Рис. 39. Разложение гидроген пероксида в растворе
Увеличивает скорость разложения гидроген пероксида и купрум(II) сульфат. В этом можно убедиться, добавив несколько капель голубого раствора этой соли к раствору гидроген пероксида. Вы заметите, что во время интенсивного выделения кислорода окраска жидкости не изменяется. Значит, соль не расходуется (как, кстати, и манган(IV) оксид).
Вещество, которое увеличивает скорость реакции, оставаясь неизменным, называют катализатором. Термин происходит от греческого слова katalysis — разрушение.
Формулу катализатора записывают в химическом уравнении над знаком равенства:
Казалось бы, соединение 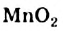
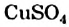
В книжках по химии можно найти такую запись:
Она объясняет, как вещества А и В взаимодействуют с образованием соединения АВ в присутствии катализатора К.
Значение катализаторов для современной промышленности и техники очень велико. При участии этих веществ осуществляют почти 90 % всех химических превращений. Катализаторы используют в транспортных средствах с двигателями внутреннего сгорания. Благодаря этим веществам угарный газ (продукт неполного окисления бензина), реагируя с кислородом, превращается в углекислый газ.
С участием катализаторов происходят реакции в живых организмах. Эти катализаторы называют ферментами; их вырабатывают живые клетки. Отсутствие или недостаток какого-либо фермента вызывает заболевание, иногда довольно тяжелое. Подробнее о ферментах вы узнаете на уроках биологии в старших классах.
Это интересно. Существуют вещества, замедляющие химические реакции. Их называют ингибиторами.
Это интересно. Вещества, предотвращающие порчу пищевых продуктов, называют консервантами.
Выводы:
Каждая реакция происходит с определенной скоростью.
Скорость реакции зависит от химической природы реагентов, возрастает с увеличением концентрации реагента, площади поверхности контакта реагентов и температуры.
Вещество, которое увеличивает скорость реакции, участвуя в ней, но оставаясь после реакции неизменным, называют катализатором. Катализаторы используют в промышленности, транспорте. Природные катализаторы регулируют химические превращения в живых организмах.
Что такое химические реакции
Общее число всех возможных химических реакций невообразимо велико, однако среди них есть превращения, схожие между собой по определённым признакам. Это даёт возможность классифицировать химические реакции, т. е. разделить их на группы, к каждой из которых относятся процессы с одним общим признаком. К таким признакам относятся, например, изменение числа и состава веществ в ходе реакции, выделение или поглощение теплоты, изменение степеней окисления атомов и др. Классификация реакций позволяет систематизировать наши знания о превращениях веществ и поэтому является очень полезной при изучении химии. Познакомимся с основами классификации химических реакций подробнее.
1. По признаку изменения числа и состава веществ химические реакции подразделяются на реакции соединения, разложения, замещения и обмена.
Реакция соединения — это химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое вещество.
В такие реакции могут вступать как простые, так и сложные вещества. Например:
Очевидно, что продуктами реакций соединения всегда являются только сложные вещества.
Реакция разложения — это химическая реакция, в результате которой из одного исходного вещества образуется несколько новых веществ.
В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества. Например:
Реакция замещения — это химическая реакция, в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении.
Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое — сложным. Например:
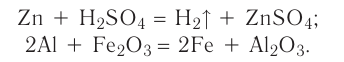
Реакция обмена — это реакция, в результате которой два сложных вещества обмениваются своими составными частями.
Примеры реакций обмена:
К реакциям данного типа относятся, например, известные вам реакции нейтрализации.
2. По признаку изменения степеней окисления атомов химические превращения подразделяются на реакции, в ходе которых степени окисления атомов не изменяются, и реакции, в ходе которых происходит их изменение.
К реакциям, в результате которых степени окисления атомов не изменяются, относятся все реакции обмена, некоторые реакции соединения и разложения. Например:
К химическим превращениям, сопровождающимся изменением степеней окисления атомов, относятся все реакции замещения, некоторые реакции соединения и разложения. Например:
Реакции, в ходе которых происходит изменение степеней окисления атомов, называются окислительно-восстановительными.
3. По признаку выделения или поглощения теплоты химические реакции подразделяются на экзотермические и эндотермические.
Экзотермическими называются реакции, сопровождающиеся выделением теплоты в окружающее пространство. Выделение теплоты обозначается символом + Q в конце уравнений таких реакций. Например:
Реакции этого типа начинаются либо при комнатной температуре, либо при небольшом нагревании и далее осуществляются самопроизвольно за счёт выделения «собственной» теплоты. К экзотермическим относится большинство реакций соединения, замещения, обмена и некоторые реакции разложения.
Эндотермическими называются реакции, сопровождающиеся поглощением теплоты из окружающего пространства. В уравнениях реакций этого типа поглощение теплоты обозначается символом — Q. Например:
Почти все реакции данного типа начинаются и протекают только при высоких температурах. К ним относится большинство реакций разложения, некоторые процессы соединения и обмена.
4. По признаку направления протекания химические реакции делятся на необратимые и обратимые.
Необратимыми называются химические реакции, протекающие лишь в одном направлении («слева направо»), в результате чего исходные вещества превращаются в продукты реакции. О таких химических процессах говорят, что они протекают «до конца». К ним относятся реакции горения, а также реакции, сопровождающиеся образованием малорастворимых 
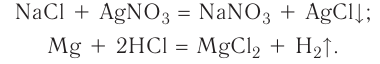
Обратимыми называются химические реакции, протекающие одновременно в двух противоположных направлениях («слева направо» и «справа налево»), В уравнениях таких реакций знак равенства заменяется двумя противоположно направленными стрелками. Например:
Среди двух одновременно протекающих реакций различают прямую, протекающую «слева направо», и обратную, идущую «справа налево».
Поскольку в ходе обратимой реакции исходные вещества одновременно и расходуются и образуются, они не полностью превращаются в продукты реакции. Поэтому об обратимых реакциях говорят, что они протекают «не до конца». В их результате всегда образуется смесь исходных веществ и продуктов взаимодействия.
5. По признаку участия катализаторов химические реакции делятся на каталитические и некаталитические.
Каталитическими называются реакции, протекающие в присутствии катализаторов. В уравнениях таких реакций химическую формулу катализатора указывают над знаком равенства или обратимости, иногда вместе с обозначениями условий протекания (температура /, давление р). Например: 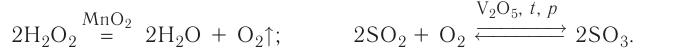
К реакциям данного типа относятся многие реакции разложения и соединения. Некаталитическими называются реакции, протекающие в отсутствие катализаторов. Это, например, реакции обмена и замещения:
6. По наличию границы раздела фаз все химические реакции подразделяются на гомогенные и гетерогенные.
Фаза — однородная часть смеси веществ, отделённая от других её частей поверхностью — границей раздела фаз. В зависимости от агрегатного состояния различают фазы твёрдые, жидкие и газообразные. Границы между разными фазами иногда видны даже невооружённым глазом. Например, в реакции
Fe(T) + H2S04(p.p) = FeS04 + Н2Т
твёрдая фаза (железо) отделена от жидкой фазы (раствора серной кислоты) отчётливо видимой границей — поверхностью кусочка железа. В реакции горения угля в кислороде
между твёрдой (углём) и газообразной (кислородом) фазами существует видимая граница — поверхность угля. Такие реакции, в которых исходные вещества образуют несколько фаз, называются многофазными, или 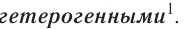
газообразными (т + г) или жидкими (т + ж) веществами, а также реакции между жидкими веществами и газами (ж 4- г), между твёрдыми веществами (т + т). Особенностью гетерогенных реакций является то, что они протекают только на поверхности раздела фаз.
Если между исходными веществами отсутствует поверхность раздела, они образуют одну фазу — однородную газообразную или жидкую смесь. Реакции между веществами, находящимися в одной фазе, называются однофазными, или 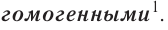
В отличие от гетерогенных гомогенные реакции протекают сразу во всём объёме реакционной смеси.
Таким образом, все химические реакции можно классифицировать по различным признакам. В то же время каждую химическую реакцию можно охарактеризовать совокупностью таких признаков. Так, например, о реакции образования аммиака из простых веществ
можно сказать, что она является реакцией:
- а) соединения, так как из двух исходных веществ — азота и водорода — образуется одно новое — аммиак;
- б) окислительно-восстановительной, так как в ходе реакции изменяются степени окисления атомов;
- в) обратимой, поскольку одновременно с образованием аммиака происходит его разложение;
- г) гомогенной, так как реагенты — азот и водород — находятся в одном агрегатном состоянии;
- д) экзотермической, потому что образование аммиака сопровождается выделением теплоты в окружающее пространство;
- е) каталитической, так как она протекает в присутствии катализатора — железа.
Химические реакции классифицируются по различным признакам: по изменению числа и состава веществ — участников реакции, по изменению степеней окисления атомов, по тепловым эффектам, по направлению протекания, по участию в реакциях катализатора, по наличию границы раздела фаз. Каждую химическую реакцию можно характеризовать набором указанных признаков.
Тепловые эффекты химических реакций. Простейшие термохимические расчёты
Как вы уже знаете, все химические реакции сопровождаются тепловыми явлениями — выделением или поглощением теплоты. Реакции, протекающие с выделением теплоты, называются экзотермическими, а реакции, идущие с поглощением теплоты — эндотермическими. Если химические количества реагентов численно равны соответствующим коэффициентам из уравнения реакции, то количество теплоты Q, выделяющейся или поглощающейся в ходе данной реакции, называется её тепловым эффектом. Тепловые эффекты экзотермических процессов принято считать положительными и обозначать в уравнениях реакций символом 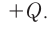
Тепловые эффекты реакций зависят от природы (состава и строения), агрегатного состояния исходных веществ и продуктов реакций, а также от условий, в которых они протекают.
Величины тепловых эффектов можно определять экспериментально, проводя реакции в специальных приборах — калориметрах1, способных очень точно определить количество выделившейся или поглотившейся теплоты. Для того чтобы эти опыты можно было сравнивать и систематизировать, все полученные результаты приводят к одинаковым условиям, называемым стандартными, — температуре 25 °С (298 К) и давлению 101,325 кПа.
Почему же в ходе одних реакций теплота выделяется, а в ходе других — поглощается? Что является источником теплоты? От чего зависят величины тепловых эффектов реакций? Ответ на эти вопросы заключается в следующем. В ходе любой химической реакции одновременно протекают два процесса — разрыв химических связей в молекулах исходных веществ и образование новых связей в молекулах продуктов реакции. Первый из этих процессов всегда эндо-термичен, т. е. осуществляется с поглощением теплоты 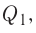
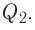
В качестве примера определим общий тепловой эффект реакции образования хлороводорода из простых веществ:
В ходе этой реакции разрываются химические связи в молекулах Н2 и CI2 и образуются новые связи в молекулах НС1. Известно, что при разрыве связей Н — Н в 1 моль водорода и связей С1 — С1в 1 моль хлора поглощается соответственно 435,9 кДж и 242,3 кДж теплоты. Поскольку в целом при разрыве связей поглощается 435,9 кДж + 242,3 кДж = 678,2 кДж, можно записать:
Известно также, что при образовании связей Н — О в 2 моль хлороводоро-да выделяется 862,8 кДж, соответственно чему запишем:
Тогда общий тепловой эффект реакции Q, равный сумме тепловых эффектов 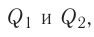
Это значит, что указанная реакция в целом является экзотермической и протекает в соответствии с термохимическим уравнением-.
Термохимическими называются уравнения, в которых указываются тепловые эффекты реакций. Поскольку их величины зависят от агрегатного состояния реагентов и продуктов, в термохимических уравнениях обязательно указываются эти состояния: (г) — газ; (ж) — жидкость; (т) или (к) — твёрдое (кристаллическое) вещество.
Термохимические уравнения используются при выполнении термохимических расчётов, которые позволяют:
- а) определить количество теплоты, выделяющейся или поглощающейся в результате реакции, если известны её тепловой эффект и химическое количество (масса, объём) одного из участников реакции;
- б) рассчитать химическое количество (массу, объём) одного из участников реакции, если известно количество выделившейся или поглотившейся теплоты;
- в) составить термохимическое уравнение реакции, если известно количество выделившейся или поглотившейся теплоты и химическое количество (масса, объём) одного из участников этой реакции.
В качестве примеров указанных термохимических расчётов решим две задачи.
Пример №22
Рассчитайте количество теплоты, выделяющейся в результате полного сгорания в кислороде метана объёмом (н. у.) 6,72 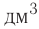
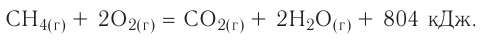
Дано:
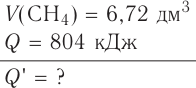
Решение:
1. Рассчитаем химическое количество сгоревшего метана:
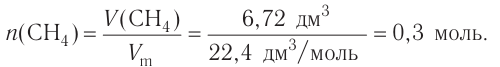
2. Рассчитаем искомую теплоту. Из термохимического уравнения реакции следует, что в результате сгорания 1 моль метана выделяется 804 кДж теплоты. С учётом этого составим пропорцию:
при сгорании 1 моль метана выделяется 804 кДж,
при сгорании 0,3 моль метана выделяется х кДж,
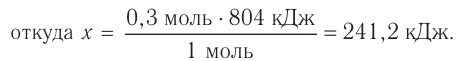
Ответ: Q’ = 241,2 кДж.
Пример №23
Рассчитайте химическое количество и массу алюминия, сгоревшего в кислороде в соответствии с термохимическим уравнением
если в результате реакции выделилось 83,69 кДж теплоты.
Решение:
1. Найдём химическое количество сгоревшего алюминия. Из термохимического уравнения реакции следует, что при сгорании 4 моль алюминия выделяется 3347,4 кДж теплоты. С учётом этого составим пропорцию и найдём искомое химическое количество металла: при сгорании 4 моль AI выделяется 3347,4 кДж теплоты, при сгорании х моль А1 выделяется 83,69 кДж теплоты,
Дано:
1. Найдём химическое количество сгоревшего алюминия. Из термохимического уравнения реакции следует, что при сгорании 4 моль алюминия выделяется 3347,4 кДж теплоты. С учётом этого составим пропорцию и найдём искомое химическое количество металла:
при сгорании 4 моль AI выделяется 3347,4 кДж теплоты,
при сгорании х моль А1 выделяется 83,69 кДж теплоты,
2. Рассчитаем массу сгоревшего алюминия:
Ответ: 0,1 моль; 2,7 г.
Термохимические исследования и расчёты широко используются в научных целях, в том числе и для определения энергетической ценности (калорийности) различных видов топлива, кормов для животных, продуктов питания.
В целом, чем больше теплоты выделяется при сгорании данного продукта, тем выше его калорийность, т. е. питательные свойства.
Протекание любой химической реакции сопровождается выделением или поглощением теплоты.
Количество теплоты, выделяющейся или поглощающейся в ходе реакции, называется её тепловым эффектом. Уравнения реакций, в которых указываются их тепловые эффекты, называются т ермохимическими.
Скорость химических реакций
Вы уже знаете, что для осуществления различных химических реакций требуются разные интервалы времени. Например, процесс, во время которого на железе во влажном воздухе образуется ржавчина, длится в течение нескольких лет или даже десятилетий. В то же время железная канцелярская скрепка растворяется в соляной кислоте в течение 15—20 минут. Эти примеры свидетельствуют о том, что химические реакции осуществляются с разной скоростью.
Чем же определяется скорость химических реакций? Рассмотрим это на примере реакции, выражающейся условным уравнением:
А + В = С + D.
С течением времени химические количества исходных веществ n(А) и n(В) уменьшаются, а химические количества продуктов реакции n(С) n «(D) увеличиваются. Чем быстрее происходит это изменение, тем больше скорость химической реакции, и наоборот — чем медленнее изменяются количества веществ в ходе реакции, тем меньше её скорость.
Для определения величины скорости химической реакции v нужно знать изменение химического количества 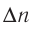
произошедшее за интервал времени 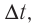
Соотношение этих величин, записанное в виде дроби 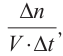
Вы уже знаете (см. § 8), что величина, равная отношению химического количества вещества п к объёму V реакционной смеси, называется молярной концентрацией этого вещества с: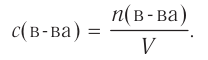
Если в выражение скорости реакции вместо 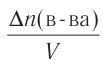
Из него следует определение:
Скорость химической реакции — величина, равная отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение.
Поскольку вещество А, вступая в реакцию, постепенно расходуется, изменение его концентрации 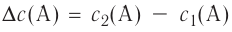
В то же время продукты реакции накапливаются, поэтому изменение их концентраций, например 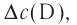
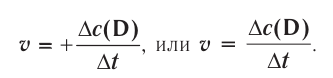
Скорость реакции по мере её протекания уменьшается (рис. 39) и через некоторое время реакция заканчивается.
Раздел химии, посвящённый изучению скорости химических реакций, называется xимической кинетикой (от греч. кинесис — движение). Знание её законов позволяет грамотно управлять различными химическими реакциями.
Скорость химической реакции определяется изменением молярной концентрации одного из реагентов или одного из продуктов реакции за единицу времени.
Факторы, влияющие на скорость химических реакций
От чего же зависит скорость химических реакций, какие факторы определяют её величину? Такими факторами являются природа реагирующих веществ, их концентрации, температура, присутствие катализаторов, площадь поверхности соприкосновения реагентов. Познакомимся с каждым из них подробнее.
Химическая природа реагирующих веществ
Поскольку химическая природа различных веществ неодинакова, они обладают разными химическими свойствами, разной реакционной способностью. Например, при комнатной температуре оксид азота(II) реагирует с кислородом быстро, а оксид углерода(II) в тех же условиях окисляется медленно. Почему эти оксиды, в равной мере контактирующие с кислородом, окисляются с разной скоростью? Ответ на этот вопрос в следующем. Из огромного числа частиц (в нашем примере — молекул N0 и СО) в реакцию вступают лишь те, которые обладают необходимым для этого повышенным запасом энергии. Такие частицы называются активными. Чем больше доля активных частиц в веществе, тем выше скорость реакции с его участием, и наоборот. При комнатной температуре число активных молекул в оксиде азота(II) намного больше, чем в оксиде углерода(II). Именно поэтому N0 окисляется кислородом намного быстрее, чем СО.
Для того чтобы реакция протекала с заметной скоростью, неактивные частицы нужно перевести в активное состояние, сообщив им недостающую энергию, например, нагревая вещество. Эта энергия называется энергией активации
Таким образом, энергия активации — это минимальная энергия (кДж/моль), которую необходимо сообщить неактивным частицам реагирующих веществ для перевода их в активное состояние.
Получая извне избыточную энергию, неактивные частицы преодолевают так называемый энергетический барьер (рис. 40) подобно человеку, который преодолевает высокую гору, предварительно получив энергию из пищи.
Каждая реакция характеризуется строго определённым значением энергии активации, от величины которой зависит скорость химического взаимодействия. Чем меньше величина энергии активации £а реакции, тем ниже «энергетический барьер», тем выше скорость реакции; чем больше величина энергии активации 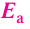
Температура:
Поскольку у разных реакций значения энергии активации 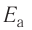
Как показывает эксперимент, скорость химических реакций сильно зависит от температуры. При её повышении неактивные молекулы поглощают энергию, равную или большую энергии активации, и становятся активными. Поскольку число активных молекул возрастает, скорость реакции увеличивается.
Количественную зависимость скорости реакций от температуры установил в 1884 году голландский химик Вант-Гофф. Он сформулировал правило, которое назвали его именем: «При повышении температуры на каждые 10°С скорость большинства химических реакций увеличивается в 2-4 раза». Математическое выражение этой зависимости имеет вид:
В этом уравнении:
— скорость реакции при более высокой температуре
— скорость реакции при более низкой температуре
— разность температур;
(гамма) — температурный коэффициент скорости реакции. Он принимает значения от 2 до 4 и показывает, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 °С.
Концентрация реагирующих веществ:
Чем выше молярные концентрации исходных веществ в смеси, тем больше частиц содержится в ней и тем чаще эти частицы сталкиваются между собой, а это, как вы уже знаете, приводит к увеличению скорости реакции. При уменьшении молярных концентраций реагентов число сталкивающихся частиц становится меньше и скорость их взаимодействия понижается.
Чтобы изучить влияние температуры и концентраций реагирующих веществ на скорость химических реакций, проведём небольшой эксперимент.
Катализаторы
Один из важнейших способов увеличения скорости реакций — проведение их в присутствии катализаторов. Из курсов химии 7-го и 8-го классов вы знаете, что катализаторы — это вещества, ускоряющие химические реакции. В присутствии катализаторов скорость реакций увеличивается в тысячи и даже миллионы раз. Катализаторы активно участвуют в химических реакциях, но, в отличие от реагентов, остаются химически неизменными.
Катализаторы — вещества, которые увеличивают скорость химических реакций, но сами при этом не расходуются и не входят в состав конечных веществ.
Увеличение скорости реакций в присутствии катализаторов называется катализом. Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор и реагенты находятся в одной фазе, а при гетерогенном — в разных фазах.
Почему же в присутствии катализаторов скорость реакции увеличивается? Оказывается, катализатор «направляет» реакцию по «более лёгкому пути», уменьшая её энергию активации. Рассмотрим это на примере реакции 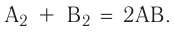
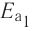
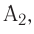
Оно быстро взаимодействует с другим реагентом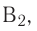
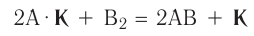
Поскольку энергии активации этих промежуточных процессов 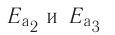
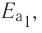
Выделившийся катализатор ускоряет взаимодействие новых порций исходных веществ.
В случае гетерогенного катализа (рис. 42) катализатор и реагенты находятся в разных агрегатных состояниях, и между их фазами имеется граница раздела, например поверхность твёрдого катализатора. Именно на ней и осуществляется катализ. При этом молекулы одного из реагентов, например 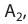
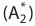
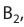
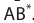
В качестве катализаторов наиболее часто используются некоторые простые вещества (Pt, Pd, Ni, Fe), некоторые оксиды (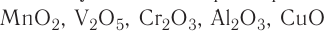
Площадь поверхности соприкосновения реагирующих веществ:
На скорость гетерогенных реакций, протекающих с участием твёрдых веществ, большое влияние оказывает величина площади соприкосновения реагентов. Чтобы убедиться в этом, проведём несложный эксперимент. В две пробирки нальём равные объёмы соляной кислоты с массовой долей НС1, равной 5 %. В первую пробирку опустим небольшой кусочек мела 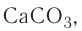
1 Адсорбция — поглощение частиц поверхностью.
Таким образом, чем больше площадь поверхности соприкосновения исходных веществ, тем больше реагирующих частиц сталкиваются друг с другом и тем выше скорость их взаимодействия.
Исходя из этого, для увеличения скорости гетерогенных реакций с участием твёрдых веществ их предварительно измельчают до состояния мелких кусочков или порошка.
На скорость химических реакций влияют: природа реагирующих веществ, величина энергии активации реакции, температура, концентрации реагентов, катализаторы, площадь поверхности соприкосновения реагирующих веществ.
Обратимые химические реакции
Изучая химические свойства различных веществ, вы до сих пор знакомились с необратимыми реакциями. Они называются так потому, что протекают лишь в одном направлении, в результате чего исходные вещества полностью превращаются в продукты реакций. В уравнениях необратимых химических реакций между формулами исходных и конечных веществ ставится знак «=».
После начала необратимой реакции концентрации исходных веществ постепенно уменьшаются, вследствие чего её скорость также уменьшается. Через некоторое время реагенты полностью расходуются, превратившись в продукты реакции, т. е. реакция идёт «до конца».
К необратимым относятся:
а) реакции, сопровождающиеся выделением большого количества теплоты, и, в частности, реакции горения веществ в кислороде. Например:
б) реакции нейтрализации. Например:
в) реакции, в результате которых образуются малорастворимые в воде твёрдые (

Другую большую группу химических превращений составляют обратимые реакции. В отличие от необратимых, они протекают одновременно в двух противоположных направлениях. Это значит, что в одно и то же время исходные вещества превращаются в конечные, а конечные вещества — в исходные. Как следствие, в результате любой обратимой реакции реагенты никогда полностью не превращаются в продукты реакции. Поэтому об обратимых реакциях говорят, что они протекают «не до конца».
Различают прямую (
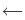
В Обратимыми называются реакции, которые протекают одновременно в двух противоположных направлениях.
В качестве примера рассмотрим обратимую реакцию синтеза иодоводорода из простых веществ:
В первоначальный момент в сосуде находятся только водород и иод, так как продукт реакции HI ещё не успел образоваться. С течением времени химические количества и концентрации исходных веществ — 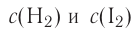
Одновременно химическое количество и концентрация иодоводорода с(НI) увеличиваются, вследствие чего скорость обратной реакции также постепенно увеличивается. Через некоторое время наступает особое состояние реакционной смеси, при котором скорости прямой и обратной реакций становятся одинаковыми (рис. 43):
Такое состояние называется химическим равновесием.
В Химическое равновесие — состояние реакционной смеси, при котором прямая и обратная реакции протекают с одинаковой скоростью.
Поскольку в состоянии равновесия скорость образования HI равна скорости его разложения, то, например, за 1 с образуется столько же молекул HI, сколько их за это время разлагается. То же самое наблюдается и с молекулами 
Молярные концентрации веществ, находящихся в состоянии равновесия, называются их равновесными концентрациями.
Смещение химического равновесия. Принцип Ле Шателье
Если внешние условия (температура и давление), при которых установилось химическое равновесие, не изменяются, то равновесные концентрации всех участников реакции остаются постоянными и равновесие не нарушается. Если же внешние условия изменяются, это приводит к изменению равновесных концентраций веществ. В этом случае говорят о нарушении или смещении химического равновесия.
Суть такого смещения состоит в следующем. В результате изменения хотя бы одного из внешних условий равенство скоростей прямой и обратной реакций на некоторое время нарушается. Если в течение этого времени скорость прямой реакции превышает скорость обратной реакции 
Как уже было сказано, смещение равновесия длится лишь некоторое время. По его прошествии изменившиеся скорости прямой и обратной реакций снова становятся одинаковыми, и устанавливается новое химическое равновесие с другими равновесными концентрациями веществ. Оно остаётся неизменным, пока не поменяется хотя бы одно из внешних условий.
Направление смещения химического равновесия при изменении внешних условий определяется закономерностью, установленной в 1884 году французским учёным Ле Шательё и называемой принципом Ле Шательё:
«Если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие (изменяется температура, давление или концентрация одного из веществ), то это равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет оказанное воздействие».
Принцип Ле Шателье часто называют принципом противодействия. Это «противодействие» заключается в смещении равновесия, т. е. в увеличении скорости той реакции (прямой или обратной), в результате которой оказанное на систему внешнее воздействие ослабевает.
Химическое равновесие смещается в ту или иную сторону при изменении любого из следующих параметров:
- а) температуры системы, т. е. при её нагревании или охлаждении;
- б) давления в системе, т. е. при её сжатии или расширении;
- в) концентрации одного из участников обратимой реакции, например при добавлении его в равновесную смесь.
Влияние температуры:
Символ +Q или —Q, записанный в конце термохимического уравнения, характеризует тепловой эффект прямой реакции. Он равен по величине тепловому эффекту обратной реакции, но противоположен ему по знаку. Например, из термохимического уравнения, записанного в общем виде,
следует, что прямая реакция идёт с выделением теплоты (т. е. +Q, а обратная — с поглощением такого же количества теплоты (т. е. — Q): 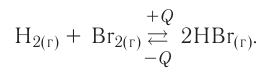
При нагревании (+t) этой равновесной системы она противодействует, «охлаждая» себя. Это происходит за счёт смещения равновесия в сторону эндотермической реакции, в ходе которой полученная извне теплота поглощается (-Q) Если же данную равновесную систему подвергают охлаждению (—t), то она снова противодействует, но теперь уже «нагревая» себя. Это достигается за счёт смещения равновесия в сторону экзотермической реакции, идущей с выделением теплоты (+Q) Таким образом, при повышении температуры (+t) химическое равновесие смещается в сторону эндотермической реакции (-Q), а при понижении температуры (-t) химическое равновесие смещается в сторону экзотермической реакции (+Q).
О противодействии системы внешнему изменению температуры свидетельствуют противоположные знаки « + » и « —» перед символами t и Q.
Влияние давления:
При постоянной температуре давление газовой смеси на стенки сосуда прямо пропорционально общему химическому количеству газов, содержащихся в нём. Если общее химическое количество газов в сосуде увеличивается, то давление газовой смеси возрастает, и наоборот — при понижении общего количества газов давление в сосуде уменьшается. Рассмотрим это на примере обратимой реакции синтеза аммиака, выражающейся уравнением: 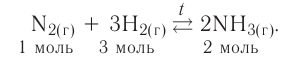
Из этого уравнения следует, что:
а) в результате прямой реакции (
б) в результате обратной реакции (
Это можно отобразить в уравнении реакции следующим образом:
Если данную равновесную систему подвергают сжатию, повышая её давление (+р), она «противодействует» этому, смещая равновесие в сторону прямой реакции, в ходе которой давление и общее количество газов уменьшается (—n).
Если же указанную равновесную систему подвергают расширению, уменьшая её давление (-p), она снова «противодействует», смещая равновесие в сторону обратной реакции, в ходе которой давление и общее количество газов увеличивается (+n). Таким образом, при повышении внешнего давления (+р) химическое равновесие смещается в сторону реакции, сопровождающейся уменьшением общего химического количества газов (-n). При понижении внешнего давления (—р) химическое равновесие смещается в сторону реакции, сопровождающейся увеличением общего химического количества газов (+n).
Известно достаточно много обратимых реакций, в ходе которых общее химическое количество газов не изменяется. Например: 
Очевидно, что в таких случаях изменение внешнего давления не влияет на положение химического равновесия, т. е. оно никуда не смещается.
О противодействии системы внешнему изменению давления свидетельствуют противоположные знаки « + » и « —» перед символами р и n.
Влияние концентраций веществ:
Химическое равновесие можно сместить, изменяя концентрации исходных или конечных веществ, участвующих в обратимой реакции. Рассмотрим это подробнее на примере реакции, отображаемой уравнением: 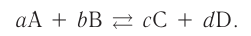
При увеличении концентрации одного или обоих исходных веществ А и В скорость прямой реакции увеличивается (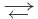
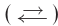
При увеличении концентрации одного или обоих конечных веществ С и D скорость обратной реакции возрастает 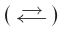
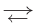
- При увеличении концентраций исходных веществ химическое равновесие всегда смещается вправо, а при их уменьшении — влево.
- При увеличении концентраций конечных веществ химическое равновесие всегда смещается влево, а при их уменьшении — вправо.
Приведём конкретный пример.
Пример №24
Определите, в какую сторону сместится химическое равновесие, отображаемое уравнением
а) при увеличении концентрации азота; б) при уменьшении концентрации водорода; в) при уменьшении концентрации аммиака.
а) Поскольку азот — исходное вещество, то при увеличении его концентрации данное равновесие сместится вправо.
б) Так как водород — исходное вещество, то при уменьшении его концентрации химическое равновесие сместится влево.
в) Поскольку аммиак — конечное вещество, то при уменьшении его концентрации указанное равновесие сместится вправо.
Смещение химического равновесия широко используется в химической промышленности для увеличения практического выхода многих ценных веществ. Например, для того чтобы увеличить выход аммиака, т. е. получить его как можно больше, химическое равновесие, рассмотренное в примере 1, смещают вправо. Для этого увеличивают давление (сжимают реакционную смесь), уменьшают температуру, увеличивают концентрации азота и водорода, уменьшают концентрацию аммиака.
Следует отметить, что катализаторы не влияют на положение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакции.
- Химические реакции подразделяются на обратимые и необратимые.
- При равенстве скоростей прямой и обратной реакций наступает состояние химического равновесия.
- Химическое равновесие смещается при изменении давления, температуры, концентраций веществ.
- Катализаторы не влияют на положение химического равновесия.
Окислительно-восстановительные реакции
Среди всех известных химических реакций особое место занимают окислительно-восстановительные реакции (ОВР). Именно они лежат в основе процессов фотосинтеза, дыхания и обмена веществ в живых организмах, используются при получении многих полезных веществ и материалов.
На протяжении многих веков люди широко использовали в своей деятельности различные окислительно-восстановительные реакции, не понимая их сути. Лишь во второй половине XVIII века французский химик А. Лавуазье дал научное объяснение этим процессам, создав кислородную теорию окисления. Согласно данной теории окисление — процесс присоединения атомов кислорода к атомам других элементов, а восстановление — процесс отнятия атомов кислорода. С этими определениями вы познакомились впервые в курсе химии 7-го класса на примере реакций окисления меди кислородом и восстановления меди из её оксида водородом:
В начале XX века была создана современная электронная теория окислительно-восстановительных реакций. В её основе лежит представление о том, что любая окислительно-восстановительная реакция осуществляется за счёт перехода электронов от атомов или ионов одних элементов к атомам или ионам других элементов, в результате чего происходит изменение их степеней окисления. Таким образом, к окислительно-восстановительным относятся реакции, сопровождающиеся изменением степеней окисления атомов.
Согласно электронной теории, в ходе любой окислительно-восстановительной реакции одновременно протекают два процесса — окисление и восстановление:
Окисление — процесс отдачи электронов (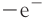
Атом или ион, отдающий электроны, называется восстановителем. Вещество, в состав которого входят такие атомы или ионы, также называется восстановителем. Типичными восстановителями являются простые вещества металлы, атомы которых в ходе окислительно-восстановительной реакции всегда отдают электроны.
Восстановление — процесс присоединения электронов (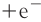
Атом или ион, присоединяющий электроны, называется окислителем. Вещество, в состав которого входят такие атомы или ионы, также называется окислителем. К окислителям относятся многие простые вещества-неметаллы (например,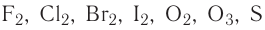
* восстановитель, отдавая электроны, восстанавливает другие атомы или ионы, но сам при этом окисляется;
- окислитель, принимая электроны, окисляет другие атомы или ионы, но сам при этом восстанавливается.
В ходе окислительно-восстановительной реакции общее число электронов, отданных восстановителем, всегда равно общему числу электронов, принятых окислителем:
Это равенство, называемое электронным балансом, лежит в основе метода расстановки коэффициентов в уравнениях ОВР, который называется методом электронного баланса. Рассмотрим его на следующих примерах.
Пример №25
Составьте уравнение окислительно-восстановительной реакции, протекающей по схеме:
1. Расставим степени окисления атомов в формулах всех веществ и подчеркнём символы элементов, у которых изменились степени окисления:
2. Определим атомы-восстановители и атомы-окислители в данной реакции. Поскольку степень окисления атомов азота повышается (от —3 до 0), они окисляются, отдавая электроны, и являются восстановителями. В то же время степень окисления атомов кислорода понижается (от 0 до —2), следовательно, они восстанавливаются, присоединяя электроны, и являются окислителями.
3. Составим схему электронного баланса. Для этого запишем одно под другим уравнения процессов окисления атомов азота и восстановления атомов кислорода. Запомните, что в этих уравнениях число атомов каждого элемента такое же, как в одной молекуле соответствующего исходного вещества. Учитывая, что в молекуле 
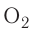
Из этих уравнений видно, что один атом азота отдаёт 3 электрона, а два атома кислорода принимают 4 электрона. Эти числа (3 и 4) записываются напротив соответствующих уравнений за первой вертикальной чертой. Далее находится наименьшее общее кратное1 указанных чисел — число 12, которое записывается посередине за второй вертикальной чертой. После этого наименьшее кратное поочерёдно делится на число электронов, отданных одним атомом азота, т. е. на 3 (12 : 3 = 4), и на число электронов, принятых двумя атомами кислорода, т. е. на 4 (12 : 4 = 3). Полученные числа — 4 и 3 — записываются напротив соответствующих уравнений за третьей вертикальной чертой. Они представляют собой множители, показывающие, на сколько нужно умножить числа атомов в записанных уравнениях окисления и восстановления для достижения электронного баланса. Получается, что число 1, записанное перед символами N, нужно умножить на 4 (1 

4. Учитывая, что в обеих частях уравнения должно быть по четыре атома азота и по шесть атомов кислорода, расставим соответствующие коэффициенты перед формулами веществ в исходной схеме реакции и получим искомое уравнение:
Пример №26
Составьте уравнение окислительно-восстановительной реакции, протекающей по схеме:
1. Расставим степени окисления атомов в формулах всех веществ и подчеркнём символы элементов, у которых изменились степени окисления:
2. Определим атомы-восстановители и атомы-окислители в данной реакции. Поскольку степень окисления атомов цинка повышается, они окисляются, отдавая электроны, и являются восстановителями. В то же время степень окисления атомов азота понижается, следовательно, они восстанавливаются, присоединяя электроны, и являются окислителями.
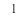
Обратите внимание: в данной ОВР азотная кислота участвует в двух процессах — одна её часть восстанавливается до простого вещества азота, а другая часть расходуется на образование соли без изменения степени окисления атомов азота.
3. Составим схему электронного баланса. Для этого запишем одно под другим уравнения процессов окисления атомов цинка и восстановления атомов азота:
Из этих уравнений видно, что один атом цинка отдаёт 2 электрона, а один атом азота принимает 5 электронов. Эти числа (2 и 5) записываются напротив соответствующих уравнений за первой вертикальной чертой. Наименьшее общее кратное указанных чисел — число 10, записанное за второй вертикальной чертой, поочерёдно делится на число электронов, отданных одним атомом цинка, т. е. на 2 (10 : 2 = 5), и на число электронов, принятых одним атомом азота, т. е. на 5 (10 : 5 = 2). Полученные числа — 5 и 2 — записываются напротив соответствующих уравнений за третьей вертикальной чертой. Они показывают, что число 1, записанное перед символами Zn, нужно умножить на 5 (1 • 5 = 5 атомов Zn), а число 1, записанное перед символами N, нужно умножить на 2 (1 -2 = 2 атома N). Таким образом, получается электронный баланс: число электронов (10), отданных пятью атомами цинка, равно числу электронов (10), принятых двумя атомами азота.
4. Расставим соответствующие коэффициенты перед формулами веществ:
Из этой схемы видно, что в соответствии с электронным балансом на образование одной молекулы азота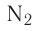
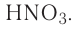

Окислительно-восстановительные свойства веществ можно определить по величинам степеней окисления атомов, входящих в их состав.
Если атомы элемента в веществе находятся в высшей степени окисления, то за их счёт данное вещество проявляет только окислительные свойства.
- Если атомы элемента в веществе находятся в низшей степени окисления
, то за их счёт данное вещество проявляет только восстановительные свойства.
- Если атомы элемента в веществе находятся в промежуточной степени окисления, то за их счёт данное вещество может проявлять как окислительные, так и восстановительные свойства.
Рассмотрим это на примере соединений азота. Поскольку этот химический элемент расположен в группе VA, максимальная и минимальная степени окисления его атомов равны соответственно +5 и —3. Поэтому, например, вещество 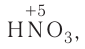
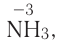
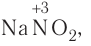
Окислительно-восстановительные реакции происходят во всех живых организмах и лежат в основе процессов жизнедеятельности. Они постоянно осуществляются и в окружающей среде — в атмосфере, в природных водах, в земных недрах. Со многими окислительно-восстановительными реакциями мы сталкиваемся в повседневной жизни. Это, например, горение бытового газа на кухне, прокисание молока, образование ржавчины, почернение серебряных изделий и многие другие.
- Окислительно-восстановительными называются реакции, в ходе которых происходит изменение степеней окисления атомов.
- Восстановители, отдавая электроны, окисляются, а окислители, принимая электроны, восстанавливаются.
- Общее число электронов, отданных атомами вещества-восстановителя, всегда равно общему числу электронов, принятых атомами вещества-окислителя.
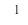
Классификация химических реакций в химии
Изучая химию, вы познакомились со многими химическими реакциями.
Мир химических реакций огромен и многообразен. В этих процессах участвуют различные частицы (молекулы, атомы, ионы), в результате протекания химических реакций образуются разнообразные вещества (простые и сложные), выделяется или поглощается теплота, в некоторых случаях — свет.
Сущность химических реакций состоит в превращении одних веществ в другие. При этом разрушается структура исходных веществ за счет разрыва химических связей и возникают новые вещества с новыми связями и другим строением. Однако масса и общее число атомов каждого элемента остаются постоянными, а это значит, что и суммарная масса веществ после реакции не изменяется. Эта закономерность выражается хорошо известным вам законом сохранения массы веществ.
Хотя любое химическое взаимодействие сопровождается изменением энергии системы, общее количество энергии сохраняется и лишь переходит из одной формы в другую. Энергия химических реакций может превращаться в другие виды: тепловую, электрическую, механическую, световую и др.
Каждая химическая реакция имеет свои характеристики. Ее можно рассматривать, выделяя отдельные признаки: изменение степени окисления, выделение или поглощение теплоты, соотношение числа исходных веществ и продуктов реакции и др. Рассмотрим некоторые из них.
1. По признаку соотношения числа исходных веществ и продуктов химические реакции можно разделить на реакции соединения, разложения, замещения и обмена.
Реакции соединения — это такие химические реакции, в результате которых из двух или нескольких исходных веществ образуется только один продукт реакции. В такие реакции могут вступать как простые, так и сложные вещества:

Реакции разложения — это реакции, при которых из одного сложного вещества образуется два и более новых веществ. Например, разложение нитрата калия: .
Реакции замещения — это реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе. Например, замещение меди железом в сульфате меди(II):
или взаимодействие оксида меди(II) с водородом:
Реакции обмена — это реакции, в результате которых два сложных вещества обмениваются своими составными частями, образуя два новых вещества:
Частным случаем реакций обмена является реакция нейтрализации, протекающая между кислотой с основанием:
Нередко эти простые типы реакций совмещаются в более сложные, например:
Эта реакция является одновременно и реакцией обмена и реакцией разложения, так как угольная кислота разлагается на углекислый газ и воду.
2. По признаку изменения степени окисления атомов, входящих в состав реагирующих веществ, реакции делятся на реакции, протекающие без изменения степени окисления, и окислительно-восстановительные.
Реакции, протекающие без изменения степени окисления. Например:
Здесь видно, что степени окисления кальция, углерода и кислорода в течение химической реакции остались неизменными.
Реакции окислительно-восстановительные — это реакции, в ходе которых происходит переход электронов от одних участников реакции (атомов, ионов, молекул) к другим, в результате чего изменяются степени окисления атомов. Процессы окисления и восстановления взаимосвязаны, другими словами — не бывает окисления без восстановления. Например:
Здесь железо 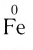
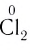
3. По признаку выделения или поглощения тепловой энергии в ходе химических превращений реакции делятся на экзотермические и эндотермические.
Такие реакции характеризуются тепловым эффектом.
Тепловым эффектом называют количество теплоты, которое выделяется или поглощается при химической реакции.
Тепловой эффект химических реакций обозначается буквой латинского алфавита Q и измеряется в килоджоулях.
Экзотермические реакции — это реакции, протекающие с выделением теплоты, или с положительным тепловым эффектом. Например, реакция образования хлороводорода из водорода и хлора:
К экзотермическим реакциям обычно относят большинство реакций соединения, горения, обмена и некоторые реакции разложения.
Эндотермические реакции — это реакции, протекающие с поглощением теплоты из окружающей среды. Иначе эти реакции можно назвать реакциями с отрицательным тепловым эффектом. Например, реакция образования оксида азота(II) из азота и кислорода протекает с поглощением теплоты и поэтому осуществима только при высокой температуре:
К таким реакциям также относятся реакции восстановления металлов из руд. фотосинтез в растениях и др. Для успешного протекания такие химические реакции требуют постоянной подачи энергии.
4. По признаку изменения направления протекания реакции делятся на обратимые и необратимые.
Обратимые химические реакции — это реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций знак равенства заменяется двумя стрелками, направленными в противоположные стороны. Например, реакция образования аммиака:
Необратимые реакции — это реакции, протекающие только в одном направлении, т. е. до полного превращения реагирующих веществ в продукты реакции. Например, к необратимым химическим реакциям можно отнести все реакции горения органических веществ:
5. По признаку участия катализатора реакции делятся на каталитические и некаталитические.
Еще в 8-м классе вы познакомились с веществами, которые ускоряли химическую реакцию, но сами не изменялись при этом. Эти вещества называются катализаторами.
Каталитические реакции — это реакции, протекающие в присутствии катализаторов. Например, реакция окисления оксида серы(1V) в оксид серы(V1) происходит в присутствии катализатора V205:
Многие химические реакции протекают только в присутствии катализаторов. Другие — не требуют участия катализатора и поэтому являются некаталитическими. К таким реакциям можно отнести все реакции ионного обмена в растворах:
а также большинство реакций термического разложения.
6. По наличию границ раздела фаз в реакционной системе реакции разделяются на гомогенные и гетерогенные.
Фазой называется однородная по составу и свойствам часть системы, отделенная от других фаз границей раздела.
Гомогенные (гомо — одинаковый) — это реакции в реакционной системе, где вещества находятся в одинаковом агрегатном состоянии (жидком или газообразном). Например, если в химическую реакцию вступают и образуются только газообразные вещества:
или вещества, находящиеся в растворенном состоянии:
Гетерогенные (гетеро — разный) — это реакции, участники которых имеют различное агрегатное состояние, например реакции между твердыми веществами и газами:
жидкими и газообразными веществами:
или твердыми и жидкими веществами:
Таким образом, все химические реакции классифицируются по различным признакам. Каждую отдельную химическую реакцию можно охарактеризовать на основе рассмотренных признаков. Так, например, реакции образования аммиака
может быть дана следующая характеристика.
- Реакция соединения, так как из двух веществ образуется одно новое — аммиак.
- Окислительно-восстановительная — атомы водорода и азота изменяют свои степени окисления.
- Обратимая, потому что образовавшийся аммиак разлагается на исходные вещества — водород и азот.
- Гомогенная, так как вступающие в химическую реакцию вещества и продукты реакции — только газы.
- Экзотермическая, потому что прямая реакция, протекающая с образованием аммиака, идет с выделением теплоты.
- Каталитическая, потому что для успешного протекания реакции необходимо участие катализатора — металлического железа.
Охарактеризуем реакцию термического разложения гидроксида магния:
- разложения;
- без изменения степеней окисления атомов;
- необратимая;
- гетерогенная;
- эндотермическая;
- некаталитическая.
Классификация химических реакций основывается на различных признаках: по изменению степеней окисления атомов, числа и состава исходных веществ, использованию катализатора, выделению или поглощению теплоты, однородности и неоднородности реагирующих веществ, обратимости и необратимости протекания процессов.
Тепловой эффект химической реакции
Выделение или поглощение теплоты при химической реакции является одним из важнейших признаков ее протекания. Мы уже познакомились с делением реакций на эндо- и экзотермические. Как уже было сказано, тепловые явления при химических реакциях называются тепловым эффектом. Тепловой эффект измеряется в килоджоулях и указывается в правой части уравнения со знаком «+» или «—». Таким образом, экзотермические реакции протекают с положительным тепловым эффектом (+Q), а эндотермические — с отрицательным тепловым эффектом (-Q). На основании этого можно составлять термохимические уравнения, в которых указывается, сколько теплоты выделяется или поглощается при данной реакции. Например, при полном сгорании ацетилена в кислороде на каждый 1 моль сгоревшего ацетилена выделяется 1300 кДж теплоты:
Химическое уравнение реакции
означает, что превращение газообразного азота химическим количеством I моль и газообразного кислорода таким же химическим количеством в оксид азота(II) (2 моль) сопровождается поглощением 180,8 кДж теплоты.
Очевидно, если реакция соединения протекает с выделением теплоты, то обратная ей реакция разложения будет идти с поглощением теплоты.
Откуда берется теплота в химических реакциях? При протекании химических реакций происходит разрыв химических связей в исходных веществах, который требует затраты энергии и сопровождается поглощением теплоты. Образование химических связей в продуктах реакций происходит с выделением энергии. Если разрушающиеся связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергии при образовании продуктов реакции выделяется больше, чем уходит на разрыв связей в исходных веществах. Тогда мы можем утверждать, что данная химическая реакция относится к экзотермическим. Например, реакция образования хлороводорода из водорода и хлора:
Выигрыш энергии’при образовании двух связей Н—Cl (2 -431,4 кДж) превышает расход энергии на разрыв связей Н—Н (435,9 кДж) и Cl—С1 (242,3 кДж):
Можно считать, что теплота, которая выделяется или поглощается в ходе химической реакции, является своеобразным ее участником. Термохимические уравнения используют для проведения различных расчетов.
Первые измерения теплового аффекта реакции, в частности горения угля, были проделаны знаменитым французским химиком А. Лавуазье. Он изобрел специальный прибор — калориметр и дал своему прибору название, состоящее из двух частей: калор (лат. жар) и метро (греч. измерять).
При составлении термохимических уравнений часто указывается агрегатное состояние участвующих в реакции веществ: (тв) — твердое, (ж) — жидкое, (г) — газообразное. Это объясняется тем, что тепловой эффект химических реакций зависит от агрегатного состояния реагирующих веществ и продуктов реакции, их природы.
С термохимическими уравнениями можно производить все действия, как и с алгебраическими: переносить значение теплового эффекта из одной части в другую с противоположным знаком:
Условлено все термохимические расчеты производить при одинаковом состоянии исходных веществ и продуктов. В качестве такого состояния, называемого стандартным, выбрали температуру 298 К (25 °С) и давление 101,325 кПа.
При помощи расчетов по термохимическим уравнениям мы можем узнать количество теплоты, выделяющееся при участии в реакции определенной массы или объема вещества, а также составить термохимическое уравнение по известному количеству теплоты. Это особенно важно для оценки эффективности различных видов топлива.
Пример №27
Термохимическое уравнение горения метана:
Рассчитайте, сколько теплоты выделится при сжигании метана объемом (н. у.) 134,4 дм 3 .
Дано:
Решение
1. Находим химическое количество метана:
2. Подформулой интересующего нас вещества указываем его химическое количество по уравнению реакции, над формулой — химическое количество вещества, данное в задаче:
3. Составляем и решаем пропорцию на основе рассуждения:
при сгорании 1 моль метана выделяется 804 кДж теплоты
при сгорании 6 моль метана выделяется х кДж теплоты
Ответ: при сгорании метана объемом 134,4 дм: —10 с). После этого начинается образование химических связей в веществе АВ, которое сопровождается выделением энергии.
Если энергия активации мала, то скорость реакции будет высокой, по если энергия активации велика, то реакция будет протекать медленно. Реакции между ионами протекают быстро, практически мгновенно. Величина энергии активации при взаимодействии ионов очень мала, так как ионы обладают зарядами и поэтому являются активными частицами.
Понятие о скорости химических реакций
Как вам уже известно, одни химические реакции протекают очень быстро (например, взрывы), а другие — медленно, в течение нескольких часов, дней и даже лет (например, коррозия металлов). Поэтому мы можем сказать, что химические реакции имеют разную скорость. Она обозначается, как и в физике, латинской буквой 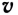
Скорость движения тел определяется в км/час, м/с, т. е. расстоянием, пройденным телом за единицу времени. А как измеряется скорость химических реакций?
В ходе химических реакций расходуются исходные вещества, уменьшается их химическое количество. Химическое количество продуктов реакции соответственно возрастает. При этом важно знать, в каком объеме системы происходит процесс.
Скорость химической реакции определяется химическим количеством вещества, прореагировавшего (или образовавшегося) в единицу времени в единице объема системы.
Как вы уже знаете, отношение величины химического количества жидких и газообразных веществ (X) к объему системы называется молярной концентрацией или просто концентрацией этих веществ:
Поэтому для измерения скорости химических реакций обычно используют величины: концентрация вещества в моль/дм 3 и время протекания реакции в секундах (с). Тогда скорость гомогенной реакции количественно можно характеризовать изменением концентрации любого участника реакции в единицу времени.
Рассмотрим, например, скорость гомогенной химической реакции между веществами А и В:
Изменение концентрации реагирующих веществ от времени протекания реакции можно проследить на графике (рис. 52). Пусть молярная концентрация вещества А до реакции была равна с1(А) моль/дм 3 , а после ее окончания, через промежуток времени (t2 — t1) (в секундах) она стала равна с2(А)моль/дм 3 . Тогда изменение концентрации будет с2(А) — с1(А), а изменение времени t2 — t1. Если скорость химической реакции 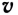
Знак «—» перед дробью ставится потому, что несмотря на убывание концентрации вещества А, т. е. на отрицательное значение разности с2(А) — с1(А), скорость реакции может быть только положительной величиной.
Скорость химической реакции можно измерять по изменению концентрации не только одного из реагентов, но и продуктов реакции. Концентрация продуктов реакции будет возрастать, поэтому в правой части уравнения необходимо поставить знак «+»:
По изменению концентрации одного вещества можно судить о соответствующих изменениях концентрации всех остальных, так как они связаны одним уравнением.
По мере уменьшения концентрации вещества А скорость реакции будет уменьшаться. Следовательно, скорость химической реакции не является постоянной величиной, и ее можно определить только для определенного промежутка времени
Изучение скорости протекания химических реакций очень важно для управления химическими процессами в промышленности, медицине и других сферах деятельности человека.
- Энергия активации — это та минимальная энергия, которую необходимо сообщить молекулам, чтобы они стали активными и их столкновение привело к химической реакции.
- Скорость химической реакции определяется изменением концентрации исходных веществ или продуктов реакции в единицу времени.
Факторы, влияющие на скорость химической реакции
Как мы убедились, реакции могут протекать с различной скоростью. На скорость химической реакции влияют самые различные факторы: природа реагирующих веществ, их концентрации, температура, присутствие катализатора, площадь поверхности соприкосновения (для твердых веществ) и др.
Природа реагирующих веществ
Каждая пара реагентов обладает своей особой способностью к химическому взаимодействию. Например, калий легко реагирует с кислородом при комнатной температуре, а реакция кислорода с азотом происходит только при очень высокой температуре. Почему? Различия связаны с особенностями строения веществ калия и азота, их природой.
Лабораторный опыт:
Исследование действия разбавленных серной и уксусной кислот на цинк
В две пробирки положите по грануле цинка. В одну пробирку прилейте раствор серной кислоты объемом примерно 1—2 см 3 , во вторую — такой же объем уксусной кислоты. Концентрации кислот в растворах должны быть одинаковыми. По интенсивности выделения водорода определите, в какой из пробирок реакция протекает с большей скоростью. Сделайте вывод о влиянии природы реагирующих веществ на скорость химической реакции.
Таким образом, мы убедились, что природа взаимодействующих веществ — один из факторов, от которого зависит, с большей или меньшей скоростью будут взаимодействовать вещества между собой.
Концентрация реагирующих веществ
Чтобы изучить влияние концентрации реагирующих веществ на скорость химической реакции, проведем небольшой эксперимент.
Лабораторный опыт:
Исследование влияния температуры и концентрации кислоты на скорость взаимодействия цинка и соляной кислоты
1. В пробирку положите гранулу цинка и прилейте небольшой объем соляной кислоты с молярной концентрацией растворенного вещества 0,1 моль/дм 3 . Отметьте интенсивность выделения водорода. Затем прилейте в пробирку столько воды, чтобы объем раствора увеличился в два раза. Таким образом, вы уменьшите концентрацию кислоты примерно в два раза. Сравните интенсивность выделения водорода с первоначальной и сделайте вывод о влиянии концентрации кислоты на скорость химической реакции.
2. Нагрейте содержимое пробирки и обратите внимание на увеличение интенсивности выделения водорода. Сделайте вывод о влиянии температуры на скорость химической реакции.
Как можно объяснить наблюдаемые явления? Химическое взаимодействие является результатом столкновения активных частиц. Рассмотрим два случая взаимодействия веществ А и В.
Пусть в первом случае концентрация вещества А равна с1(А), а во втором — в два раза меньше:
Концентрация вещества В одинакова в обоих случаях.
Логично предположить, что столкновений активных частиц в первом случае будет больше, чем во втором, во столько раз, во сколько раз выше концентрация вещества А, т. е. в два раза. Следовательно, и скорость реакции также будет больше в два раза. Отсюда можно сделать вывод о прямо пропорциональной зависимости скорости химической реакции от концентрации реагирующих веществ.
Впервые количественно зависимость скорости реакции от концентрации реагентов исследовали в 1867 г. норвежские ученые К. М. Гульдберг и П. Вааге. Данная зависимость определяется законом действующих масс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих коэффициентам перед их формулами в уравнении реакции.
Например, для реакции 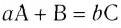
В этой формуле k — константа скорости, которая зависит от природы реагирующих веществ и определяется экспериментально для каждой реакции, с(А) и с(В) — концентрации исходных веществ. Это выражение закона действующих масс называется кинетическим уравнением реакции. Кинетические уравнения используются в основном только для гомогенных реакций. В гетерогенных реакциях концентрация твердых веществ считается равной единице. По кинетическим уравнениям можно рассчитать изменение скорости реакции при изменении концентрации исходных веществ.
Температура
Скорость химической реакции значительно зависит от температуры. Не всякое столкновение частиц реагирующих веществ приводит к их взаимодействию. В химическое взаимодействие вступают только активные молекулы (частицы), т. е. обладающие энергией, достаточной для осуществления данной реакции. При повышении температуры число активных молекул возрастает в геометрической прогрессии, так как нагревание сообщает частицам необходимую энергию активации Еакт. Чем больше энергия активации частиц для конкретной реакции, тем значительнее влияние температуры на скорость реакции.
Голландский химик Я. Вант- Гофф (1852—191 I), первый лауреат Нобелевской премии но химии, изучил зависимость скорости химических реакций от температуры. В 1884 г. он сформулировал эмпирическое правило: с ростом температуры на каждые 10 градусов скорость химических реакций увеличивается в 2—4 раза.
Якоб Хендрик Вант-Гофф
(1852—1911)
Голландский физикохимик. Создал теорию пространственного расположения атомов в молекуле. Открыл законы химической кинетики, вывел основные уравнения химической термодинамики. Заложил основы теории разбавленных растворов. Лауреат Нобелевской премии (1901).
Катализатор
Одно из наиболее эффективных воздействий на химические реакции — это применение катализатора. Как вы уже знаете, катализаторы — это вещества, ускоряющие химические реакции. Присутствие катализаторов изменяет скорость реакции в тысячи и даже миллионы раз. Катализаторы активно участвуют в химической реакции, но в отличие от реагентов в конце ее остаются неизменными.
Катализаторы — это вещества, которые изменяют скорость протекания реакции, но сами не расходуются в ходе реакции и не входят в состав конечных продуктов.
Важной характеристикой каталитической реакции (катализа) является однородность или неоднородность катализатора и реагирующих веществ. Различают гомогенные и гетерогенные каталитические процессы. При гомогенном (однородном) катализе между реагирующими веществами и катализатором отсутствует поверхность раздела. В данном случае катализ осуществляется через образование неустойчивых промежуточных продуктов.
Например, вещество А должно вступить в реакцию с веществом В. Однако для начала реакции необходимо сильное нагревание, и реакция далее протекает медленно. Тогда подбирают катализатор с таким расчетом, чтобы он с веществом А образовал активное промежуточное соединение, способное потом энергично реагировать с веществом В:
Процессы, в которых катализатор и катализируемые вещества находятся в разных агрегатных состояниях, относятся к гетерогенному (неоднородному) катализу. При адсорбции на поверхности катализатора газообразных или жидких реагентов ослабляются химические связи, возрастает способность этих веществ к взаимодействию (рис. 53).
Ускоряющее действие катализатора заключается в понижении энергии активации основной реакции. Каждый из промежуточных процессов с участием катализатора протекает с меньшей энергией активации, чем некатализируемая реакция (рис. 54). Катализ открывает иной путь протекания химической реакции от исходных веществ к продуктам реакции.
Опыт показывает, что катализаторы строго специфичны для конкретных реакций. Например, в реакции
катализатором является металлическое железо, а в реакции окисления оксида серы(IV) в оксид cepы (VI) катализатор — оксид ванадия(V) V205. Часто в качестве катализаторов используют платину, никель, палладий, оксид алюминия. Для ускорения процесса разложения пероксида водорода в качестве катализатора применяют оксид марганца(IV). Если в стакан с раствором пероксида водорода добавить немного оксида марганца(IV), сразу происходит бурное вспенивание жидкости в результате выделения кислорода.
В уравнениях химических реакций формулы катализаторов записывают над знаком «=» и «—»» или пишут «катализатор», «кат.», «к.».
Катализатором реакции взаимодействия алюминия и йода является обычная вода. Если к смеси алюминия и йода прилить воду, то вещества в смеси бурно реагируют.
Существуют вещества, способные замедлять химическую реакцию — осуществлять так называемый отрицательный катализ. Их называют ингибиторами. Такие вещества применяют при необходимости замедлить некоторые процессы, например коррозию металлов, окисление сульфидов при хранении и др.
Площадь поверхности соприкосновения реагирующих веществ
Для гетерогенных реакций, протекающих с участием твердых веществ, особую роль играет площадь соприкосновения реагирующих веществ.
Из повседневного опыта вы знаете, что быстрее сгорит, например, 1 кг стружек, чем 1 кг цельной древесины. Чем больше площадь соприкосновения реагирующих веществ, тем быстрее протекает химическая реакция. Поэтому в промышленности и лабораториях исходные вещества измельчают, растворяют в воде или переводят в парообразное состояние. Чтобы исследовать зависимость скорости химической реакции от площади соприкосновения реагирующих веществ, в две пробирки нальем равные объемы соляной кислоты с массовой долей 0,1. В первую пробирку положим измельченный в порошок кусочек писчего мела, основу его составляет карбонат кальция. Во вторую — примерно равный по массе кусочек мела или мрамора. Видно, что выделение углекислого газа более бурно происходит в пробирке с измельченным мелом, т. е. там, где площадь соприкосновения с кислотой большая.
Знание факторов, влияющих на скорость протекания химических реакций, имеет неоценимое значение в технике и быту, когда необходимо ускорить процессы с целью получения большего количества продукции, экономии сырья и энергии, увеличения рентабельности производства. В других случаях — борьбы с коррозией, окислением продуктов питания, старением — процессы можно замедлить.
На скорость химической реакции влияют температура, концентрация, природа реагирующих веществ, катализатор, площадь соприкосновения реагирующих веществ.
Обратимые химические реакции
Обычно мы изучаем химические реакции, полагая, что исходные вещества полностью превращаются в продукты реакции. Таких реакций в действительности в химии немного. Их называют необратимыми.
Например, это реакции горения или нейтрализации сильных кислот щелочами:
Большинство же химических реакций в природе и промышленности являются обратимыми, т. е. наряду с образованием новых веществ в таких реакциях происходит распад продуктов на исходные вещества.
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлениях.
Например, при взаимодействии йода с водородом при температуре 410° С лишь 78% исходных веществ превращаются в йодоводород, а 22% — остаются в виде простых веществ. Эти процессы можно выразить таким образом:
В суммарной схеме процесса между левой и правой частями уравнения ставят две стрелки, указывающие на обратимость реакций, т. е. возможность протекания процесса в обоих направлениях:
Химическое равновесие
В любой обратимой реакции обычно наступает состояние, когда скорости прямого и обратного процессов уравниваются. Такое состояние называется химическим равновесием. Например, в реакции получения йодоводорода равновесие наступает тогда, когда в единицу времени образуется столько же молекул йодоводорода, сколько их распадается на молекулы йода и водорода. В состоянии равновесия прямая и обратная реакции не прекращаются и в реагирующей смеси видимых изменений не происходит. Если скорость прямой реакции обозначим 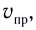
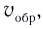
Скорость химической реакции прямо пропорциональна концентрации исходных веществ, следовательно, концентрации йодоводорода, водорода и йода в состоянии химического равновесия не будут изменяться со временем (рис. 55). Эти концентрации называют равновесными концентрациями.
Для обратимой реакции 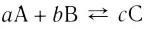
а скорость обратной реакции равна:
Поскольку в состоянии равновесия 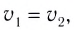
Поскольку константы скоростей прямой и обратной реакций — величины постоянные, то их отношение в состоянии равновесия также величина постоянная и называется константой равновесия (К) :
Численное значение константы равновесия характеризует выход продуктов реакции. Чем больше константа равновесия, тем больше выход продуктов реакции, тем полнее исходные вещества превращаются в продукты реакции.
Пример №30
Вычислите значение константы равновесия для реакции
если равновесные концентрации равны: 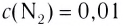
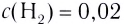
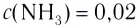
Решение
Ответ: К= 0,5.
Смещение химического равновесия. Принцип Ле Шателье
Состояние химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому очень важно для таких химических реакций создать условия, когда равновесие будет смещаться в нужную сторону. Внешнее воздействие на химическую реакцию, т. е. изменение условий (температура, давление, концентрация), вызывает нарушение равновесия в результате изменения скоростей прямой и обратной реакций.
Если при изменении условий протекания процесса увеличивается скорость прямой реакции (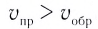
Если на систему, находящуюся в равновесии, оказать внешнее воздействие (изменить концентрацию, температуру или давление), то оно способствует протеканию той реакции — прямой или обратной, — которая ослабляет это воздействие.
Влияние температуры
Для начала большинства химических реакций необходимо нагревание исходных веществ, т. е. частицы веществ должны получить необходимую энергию, чтобы стать активными и вступить в химическую реакцию. Однако затем скорость прямой и обратной реакций зависит от того, являются эти реакции экзотермическими или эндотермическими.
Если прямая реакция, например:
эндотермическая, то постоянное повышение температуры способствует ее ускорению, что приводит к образованию большего количества оксида азота(II) N0. И наоборот, если реакция экзотермическая, как, например:
то повышение температуры смеси благоприятствует протеканию реакции с поглощением теплоты — разложению аммиака на азот и водород. Равновесие сместится влево (в сторону исходных веществ). Понижение температуры вызовет смещение равновесия вправо (в сторону образования аммиака).
Влияние давления
Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или, что то же самое, химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. Если реакция протекает с уменьшением химического количества газообразных веществ в системе, то наблюдается уменьшение давления. В этом случае повышение давления будет способствовать ее ускорению. Например, химическая реакция синтеза аммиака протекает с уменьшением количества газообразных веществ:
Проведем несложный расчет: 1 моль азота + 3 моль водорода = 4 моль газов до реакции. Из них образуется 2 моль аммиака, следовательно, из 4 моль газов образуется 2 моль газов. В этом случае повышение давления ускорит прямую реакцию и приведет к смещению равновесия вправо.
Очевидно, что уменьшение давления сместит равновесие влево. Если же в обратимой реакции химическое количество в левой части равно химическому количеству в правой части, например:
то изменение давления не приводит к смещению равновесия.
Рассмотрим этот случай на примере приведенной выше реакции синтеза аммиака. Если внешнее воздействие будет состоять в повышении концентрации азота и водорода, то это вызовет увеличение скорости прямой реакции:
т. е. приведет к уменьшению концентрации исходных веществ, и наоборот.
Но в равновесной системе нельзя изменить концентрацию одного из веществ, не вызывая изменений концентраций всех остальных ее компонентов. Концентрация продукта реакции в данном случае будет возрастать, следовательно, ускорится и обратная реакция. Это будет происходить до тех пор, пока скорости прямой и обратной реакций не уравняются. На практике для смещения равновесия в сторону прямой реакции добавляют в смесь исходные вещества и удаляют продукты химической реакции.
Следует отметить, что катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакции.
Химические реакции подразделяются на обратимые и необратимые.
При выравнивании скоростей прямой и обратной реакций наступает состояние химического равновесия.
Химическое равновесие в системе можно сместить воздействием следующих факторов: температуры,давления, концентрации.
Катализаторы на смещение химического равновесия не влияют.
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Теория электролитической диссоциации
- Электролиты и неэлектролиты в химии
- Металлы в химии
- Неметаллы в химии
- Химические связи
- Ковалентная связь
- Валентность и степень окисления
- Ионная связь
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/tipy-himicheskih-reaktsiy
http://www.evkova.org/himicheskie-reaktsii-v-himii










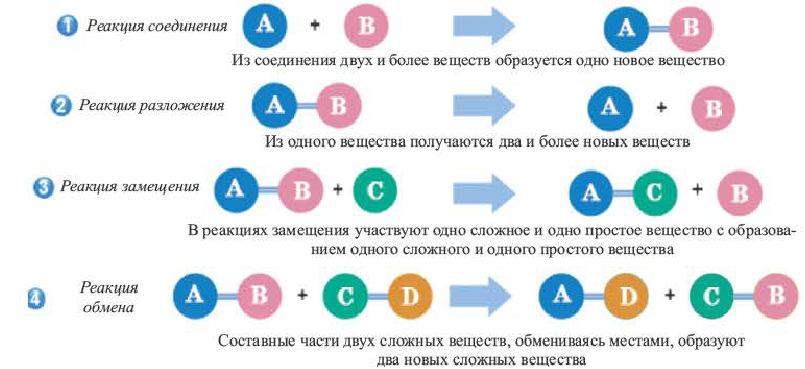
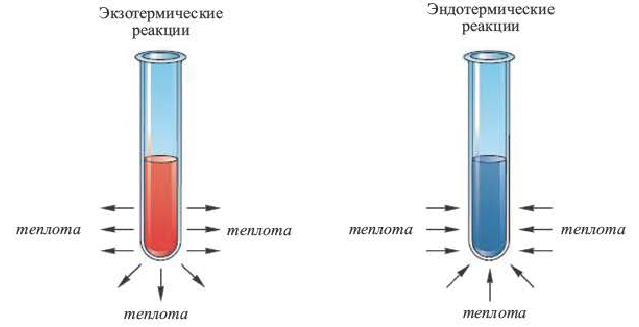
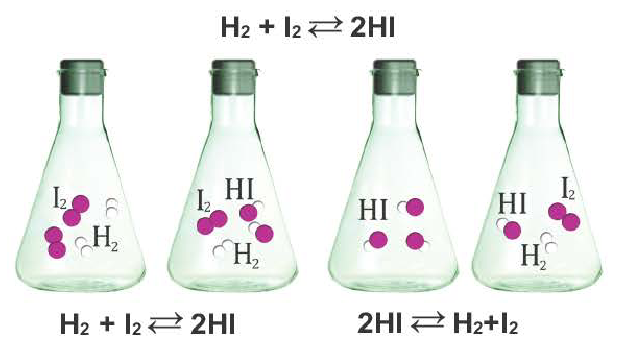
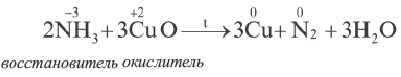
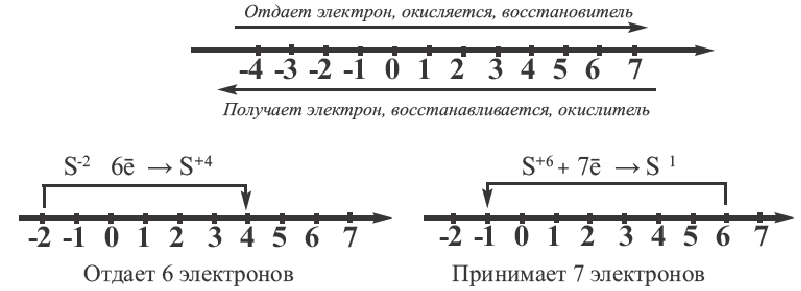

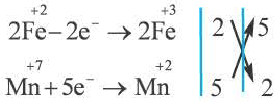
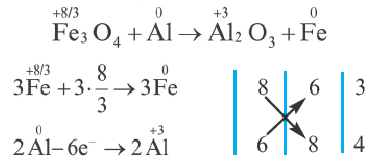
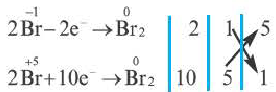
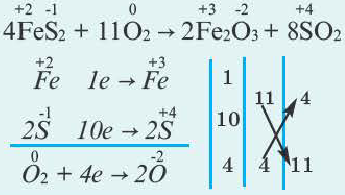
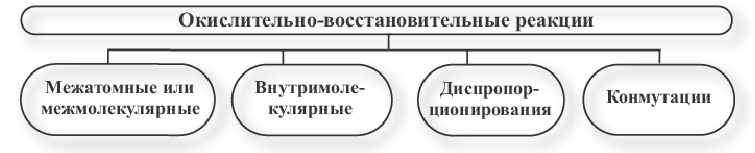
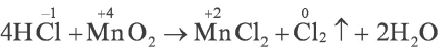
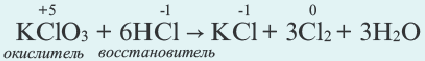

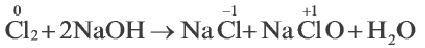
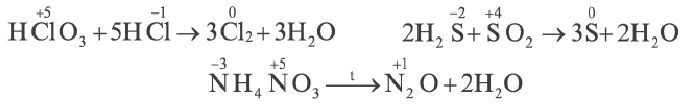
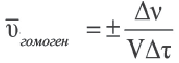
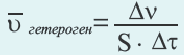

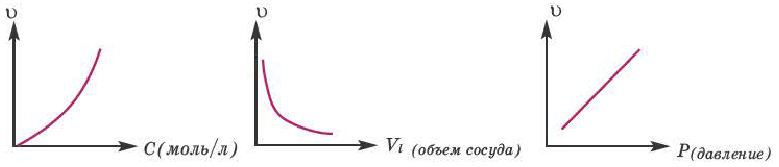
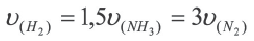
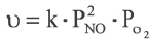
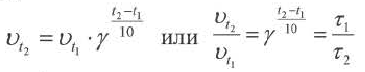
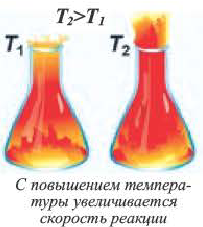
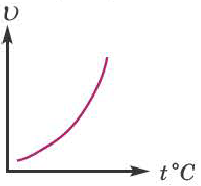
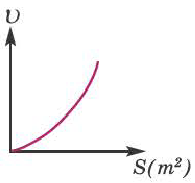
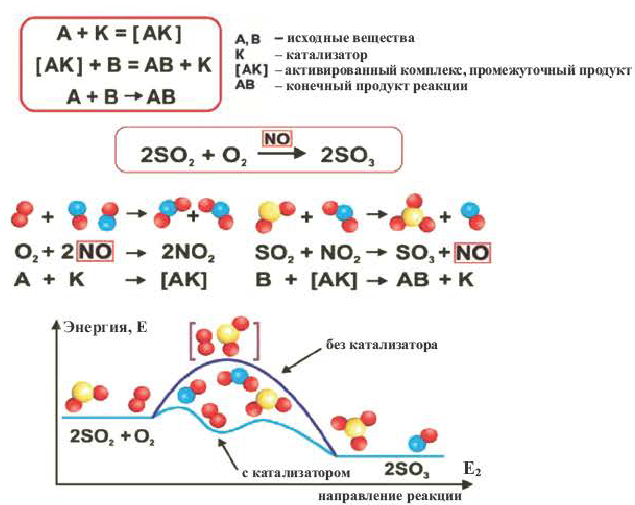
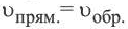
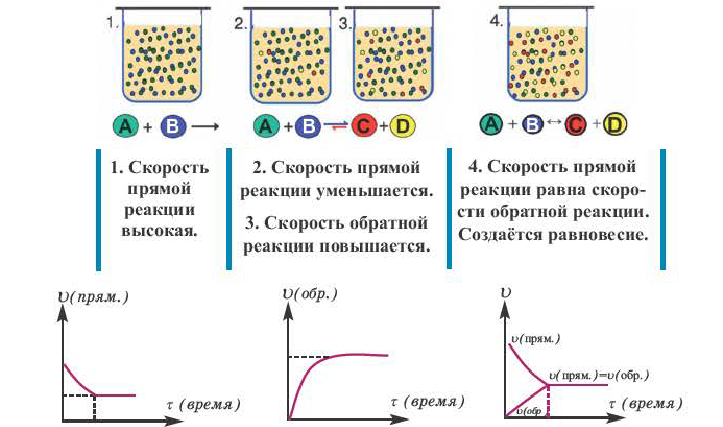
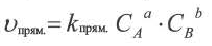
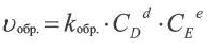
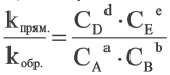
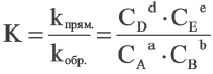
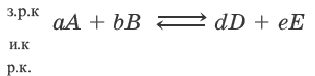

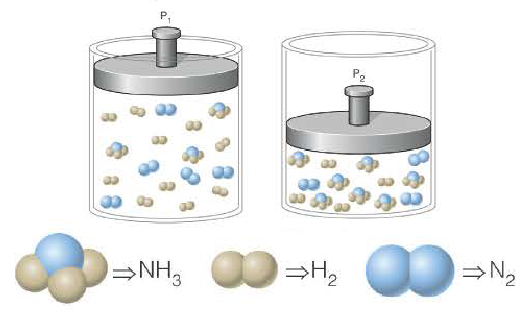
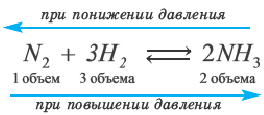
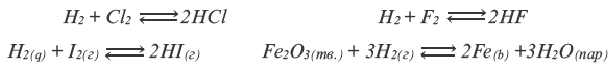
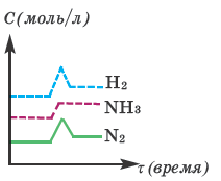

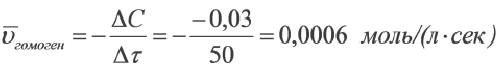
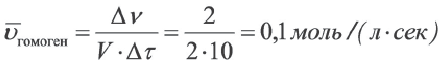
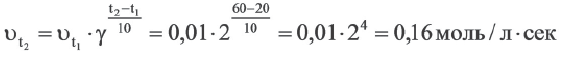
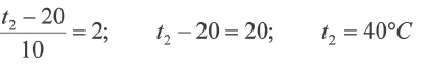
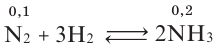
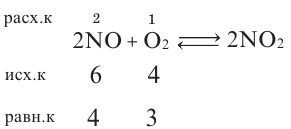
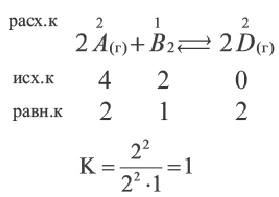
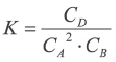
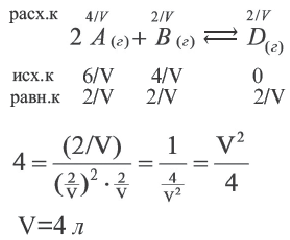
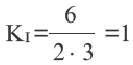
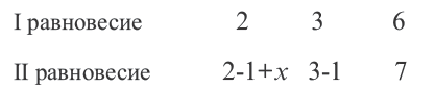
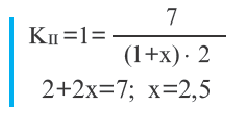
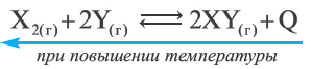
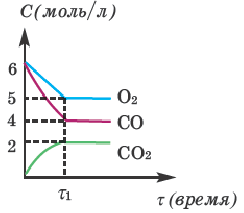
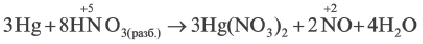
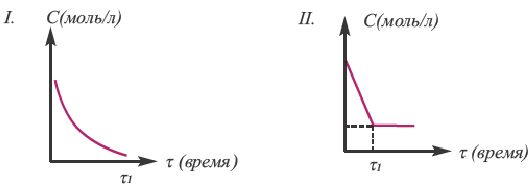
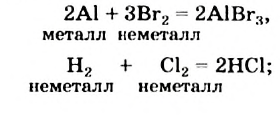
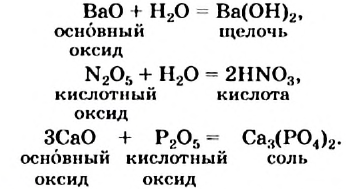

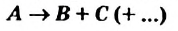
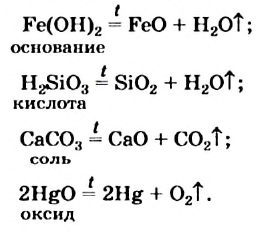
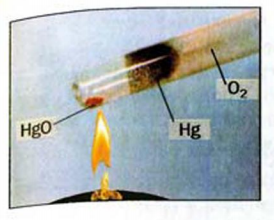
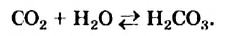
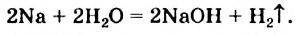
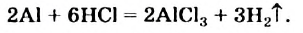
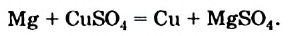
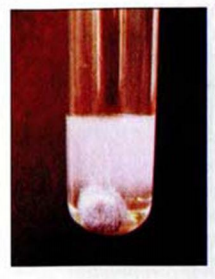
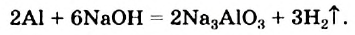
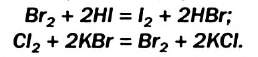
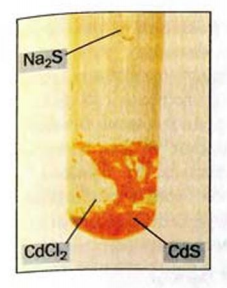
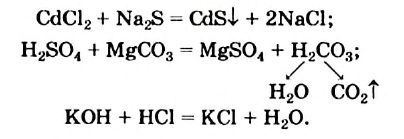
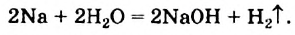
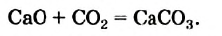
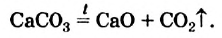
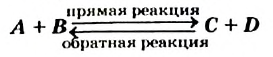
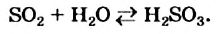
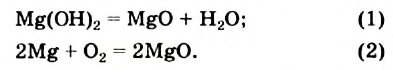
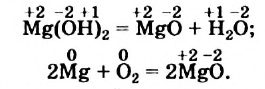
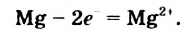
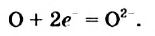
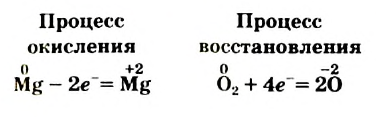
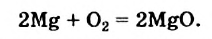
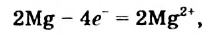
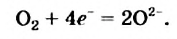
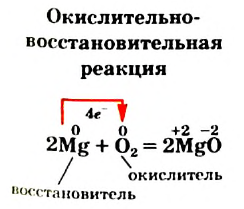
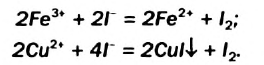


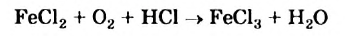
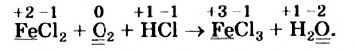
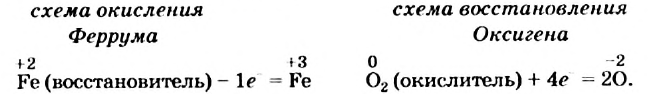
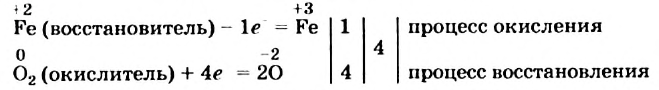
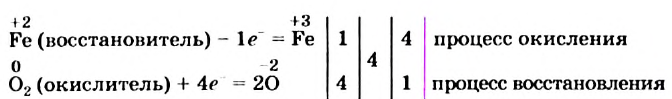
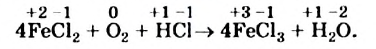
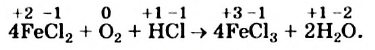
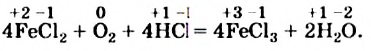
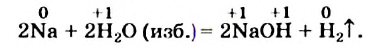
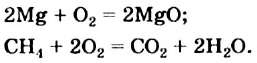

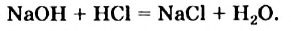
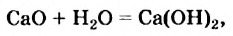
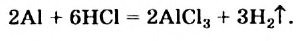
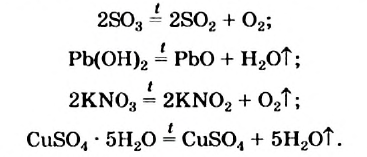
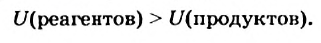
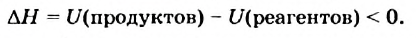
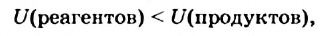
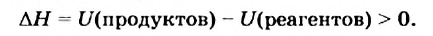
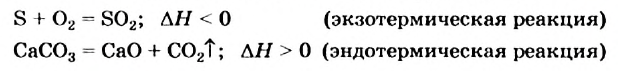

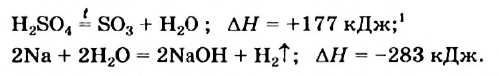
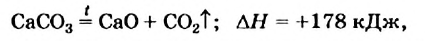
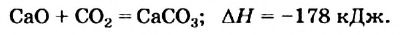
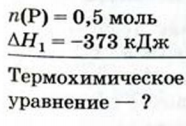
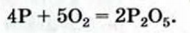

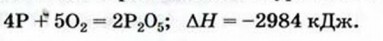

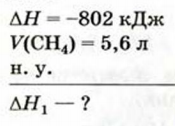
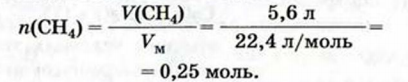
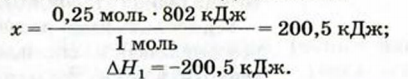
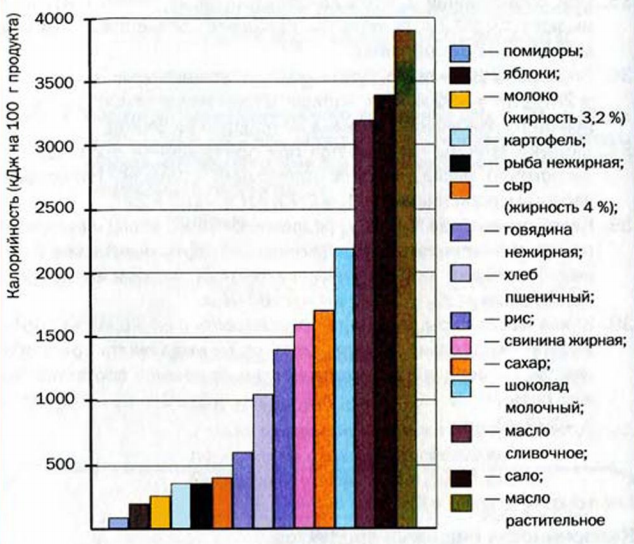
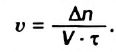
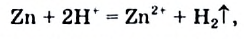
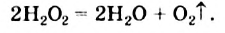
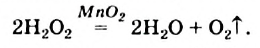
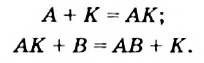
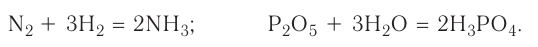
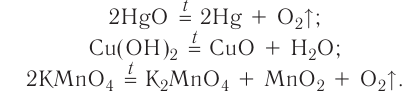
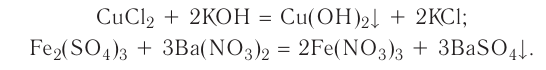
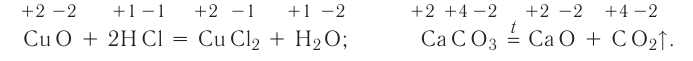
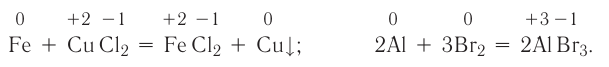
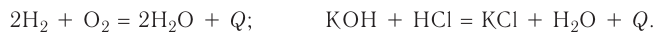


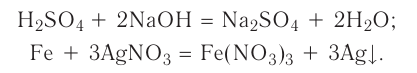
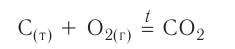
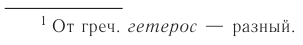

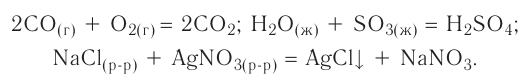
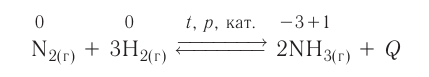

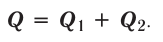
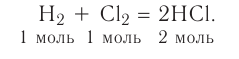
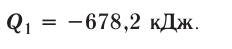
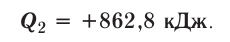
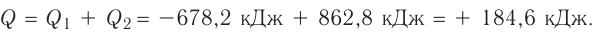
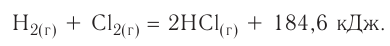
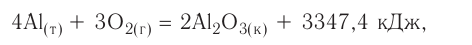
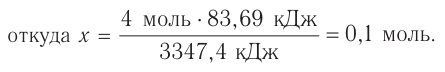
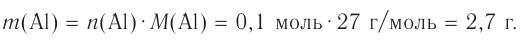
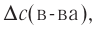
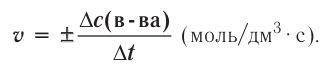
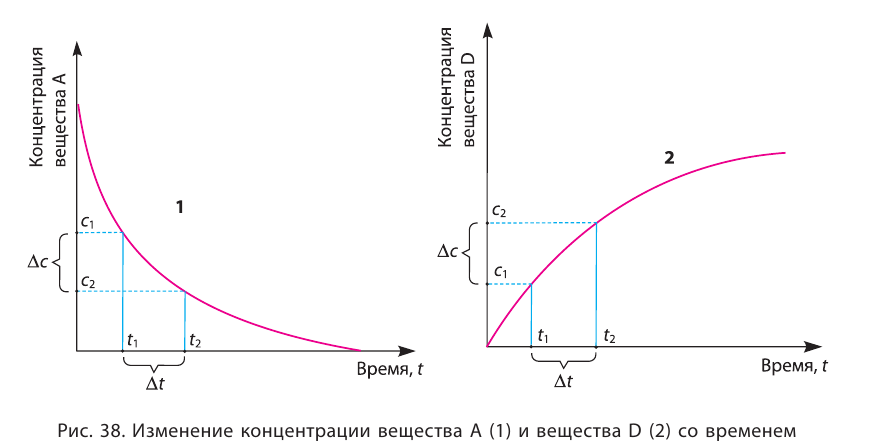
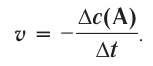
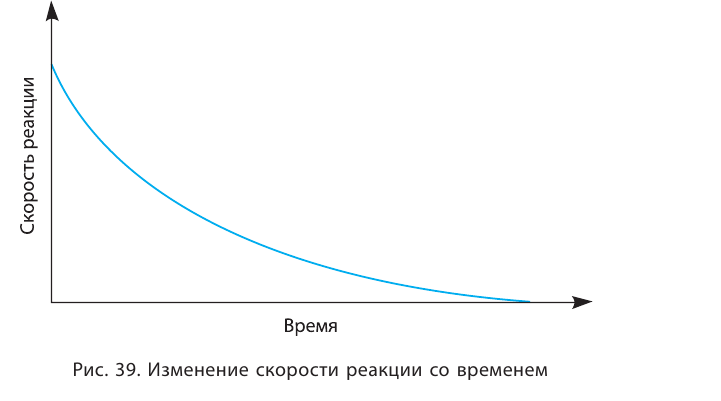
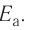
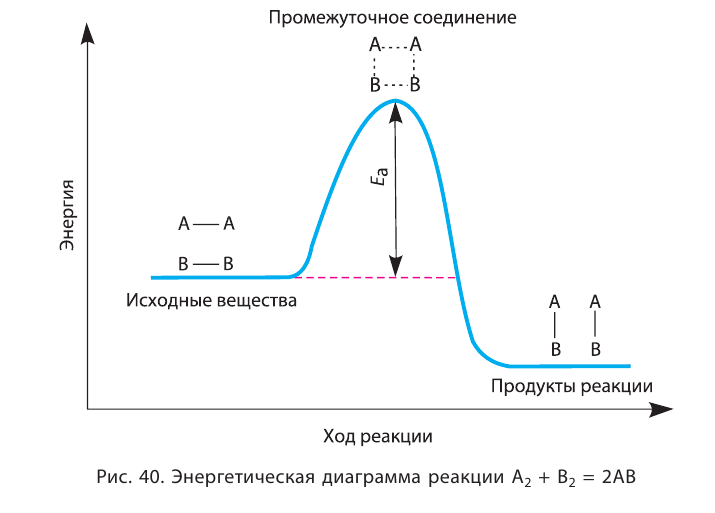
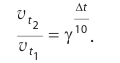
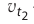 — скорость реакции при более высокой температуре
— скорость реакции при более высокой температуре 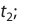
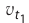 — скорость реакции при более низкой температуре
— скорость реакции при более низкой температуре 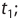
 — разность температур;
— разность температур; (гамма) — температурный коэффициент скорости реакции. Он принимает значения от 2 до 4 и показывает, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 °С.
(гамма) — температурный коэффициент скорости реакции. Он принимает значения от 2 до 4 и показывает, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 °С.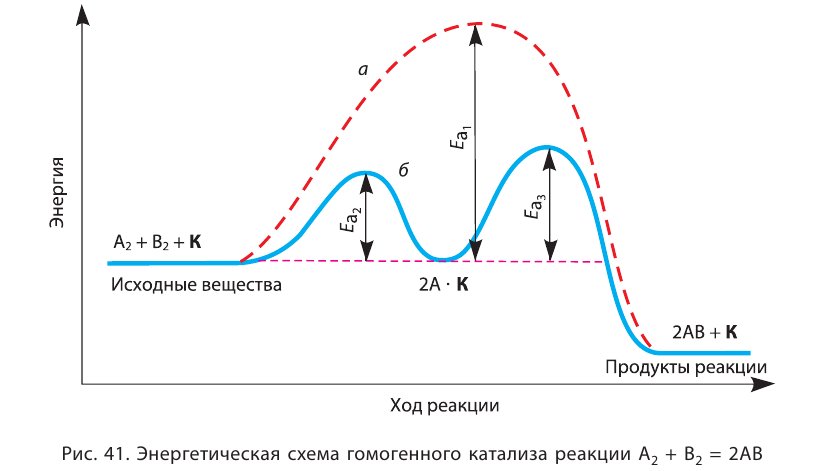
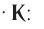
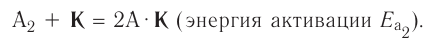
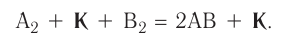
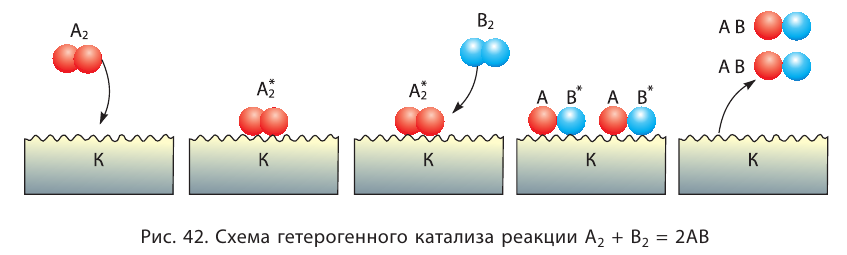
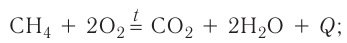
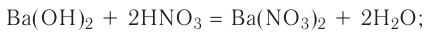
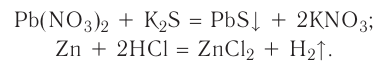
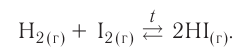
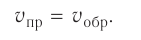
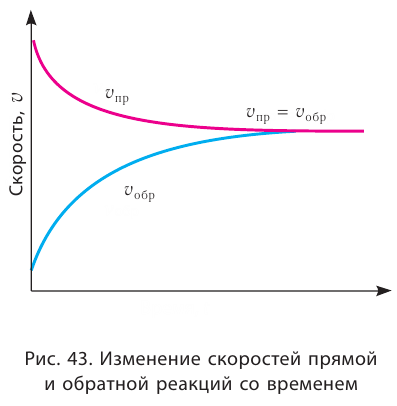
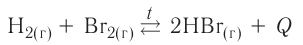
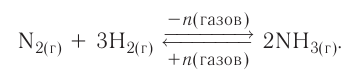
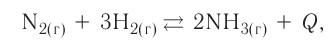
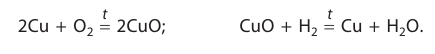
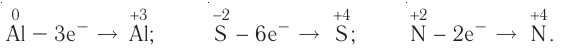
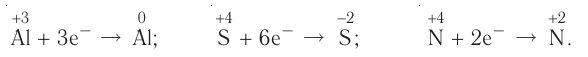
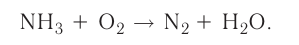
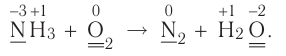
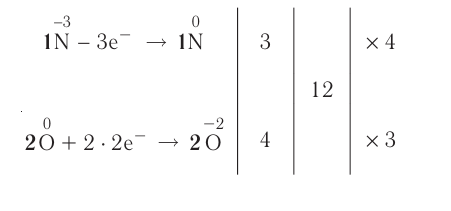
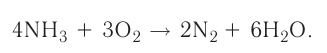
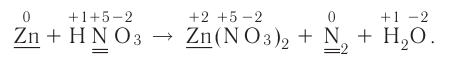
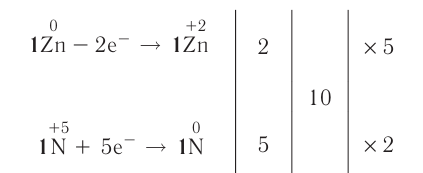
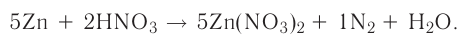
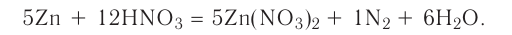
 , то за их счёт данное вещество проявляет только восстановительные свойства.
, то за их счёт данное вещество проявляет только восстановительные свойства.