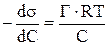Связь уравнений Гиббса, Ленгмюра и Шишковского
А и b – эмпирические константы.
(На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата).
Основы термодинамики адсорбции были созданы Дж.Гиббсом в 70-е гг. XIX в. По Гиббсу, в равновесной двухфазной системе вблизи поверхности раздела фаз происходит некоторое изменение локальных значений всех экстенсивных свойств (кроме объема). Однако фазы считаются однородными вплоть до некоторой геометрической поверхности, разделяющей их. Поэтому значение какого-либо экстенсивного свойства для системы в целом 





Изложенные представления позволяют привести фундаментальное термодинамическое уравнение к виду:
где G-гиббсова свободная энергия, S-энтропия, 


Величина 
Положение разделяющей поверхности может быть выбрано произвольно. В частности, выбор этого положения может удовлетворять условию Г1=0. Такая поверхность называется эквимолекулярной. Для нее вводится обозначение Г2 = Г2 (1) . Отсюда следует основное адсорбционное уравнение Гиббса:
Если адсорбтив совершенно не растворим в одной из двух фаз, 
Связь уравнений Гиббса, Ленгмюра и Шишковского.
Зависимость поверхностного натяжения от концентрации (изотерма поверхностного натяжения) в широком интервале концентраций описывается уравнением Шишковского:
σ = σ0 − b ln(1+ Ac) , (2.2)
где b и A – константы, характеризующие ПАВ, причем b является константой для всего гомологического ряда, а A — константа, характерная для данного вещества и возрастающая примерно в три раза при удлинении углеводородного радикала молекулы ПАВ на одну СН2 группу. Снижение поверхностного натяжения обусловлено адсорбцией ПАВ на поверхности раздела раствор/воздух. Адсорбцией называется процесс самопроизвольного концентрирования растворённого вещества в поверхностном слое. Универсальным термодинамическим соотношением, описывающим адсорбцию, является уравнение Гиббса:

Совместное решение уравнений (2.2) и (2.3) приводит к уравнению:

которое при условии 

Теория мономолекулярной адсорбции Ленгмюра
Адсорбция на твердой поверхности была известна уже в конце ХVIII века. Наиболее ранние работы по применению углей для очистки веществ методом адсорбции и разработке теории открытого им явления выполнены петербургским академиком Т.Е. Ловицем (1789). Для объяснения адсорбции Ловиц использовал существовавшую тогда теорию флогистона.
Первое уравнение, использующее молекулярно-кинетическую теорию и связывающее количество адсорбированного вещества с равновесным давлением его в газовой фазе, дал американский ученый И. Ленгмюр (1919).
и. Ленгмюр (1881-1957) разработал теорию адсорбции на твердом теле и вывел уравнение изотермы адсорбции. Достоинство уравнения Ленгмюра заключается в том, что оно имеет теоретическое обоснование и не содержит поверхностного натяжения, не поддающегося измерению для твердых поверхностей.
Выводя уравнение, Ленгмюр исходил из определенных представлений, сущность которых сформулирована в его теории.
Основные положения теории Ленгмюра:
– поверхность твердого тела в отличие от поверхности жидкости неоднородна вследствие того, что положение атомов (молекул, ионов) здесь фиксировано, поверхность имеет выступы, изломы, трещины (рис.9.22);
 |
Рис. 9.22. Поверхность твердого тела при большом увеличении
– адсорбция происходит не на всей поверхности, а только на активных центрах. Такими центрами служат узлы кристаллической решетки, выступы, возвышения на гладкой поверхности, размеры которых сами по себе очень невелики, но весьма значительны по сравнению с размерами атомов и молекул;
– каждый активный центр удерживает только одну молекулу силами остаточной валентности, действующими на расстоянии молекулярной сферы. Это значит, что адсорбционные силы отождествляются с химическими валентными силами;
– когда все активные центры заняты, наступает адсорбционное насыщение, и дальнейшая адсорбция невозможа. Отсюда следует, что адсорбтив располагается на поверхности адсорбента мономолекулярным слоем;
– адсорбированные молекулы остаются некоторое время связанными с активными центрами, а затем покидают поверхность (десорбируются);
– для упрощения силы межмолекулярного взаимодействия между адсорбированными молекулами не учитываются.
Свою теорию Ленгмюр вывел для случая адсорбции газообразных веществ на твердых поверхностях.
Состояние равновесия определяется равенством скоростей адсорбции и десорбции. Каждая молекула задерживается некоторое время на поверхности, поэтому поверхность всегда частично покрыта адсорбционным слоем. Величина покрытия растет с ростом продолжительности пребывания молекул на поверхности, что, в свою очередь, зависит от силы взаимодействия между адсорбированными молекулами и адсорбционными центрами.
Если число активных мест поверхности принять равным единице, а долю активных мест, занятых адсорбированными молекулами, обозначить через, Q то свободная часть поверхности равна 1- Q. Величина Q равна отношению количества адсорбированного вещества А к максимальной адсорбции А¥ при полном заполнении поверхности:
1 – число активных мест поверхности,
Q – доля активных мест, занятых адсорбированными молекулами,
(1 – Q) – свободная часть поверхности, тогда
При постоянной температуре в момент равновесия скорость адсорбции Va равна скорости десорбции Vд. Скорость адсорбции пропорциональна давлению газа Р и свободной поверхности (1 – Q), т.е.
где К а — коэффициент пропорциональности, или константа скорости адсорбции.
Десорбция происходит только с занятой поверхности, поэтому
где Кд — константа скорости десорбции.
Решая это выражение в отношении Q, получим:
Q = 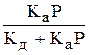
Разделив числитель и знаменатель на Кд, обозначив Ка/ Кд через К и заменив Q = A/A¥ , окончательно получим:
А = А¥ 
где К – константа адсорбционного равновесия.
В случае адсорбции из раствора уравнение Ленгмюра выводится аналогично и имеет вид:
А = А¥ 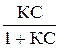
где С — равновесная концентрация адсорбируемого вещества в растворе.
Уравнения (9.50) и (9.51) носят название уравненияизотермы мономолекулярной адсорбции Ленгмюр. Они хорошо описывают адсорбцию как при малом, так и при большом давлении газа (или концентрации растворенного вещества).
Необходимо отметить, что константа адсорбционного равновесия в уравнении Ленгмюра (К) характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия.
Проанализируем уравнение, проэкстраполируем его на малые и большие значения давления адсорбируемого газа (Р).
Рассмотрим знаменатель дроби. При малом давлении газа 1 >> КР и величиной КР можно пренебречь, знаменатель прев-ращается в 1; тогда
т.е. уравнение приобретает вид, тождественный с уравнением Генри. При малом давлении адсорбция пропорциональна давлению (концентрации).
При большом давлении (концентрации) можно, наоборот, пренебречь единицей (по сравнению с КР), тогда
т.е. адсорбция количественно достигает такого предела, когда все активные центры заняты и адсорбция перестает зависеть от давления (концентрации). Соотношение (9.53) отвечает насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата.
Экспериментальное определение А¥ позволяет рассчитать удельную поверхность адсорбента:
где А¥ – предельная адсорбция, выраженная числом молей адсорбата на единицу массы адсорбента;
NA – число Авогадро;
w – площадь, занимаемая одной молекулой адсорбата.
Уравнению Ленгмюра соответствует простейшая форма изотермы адсорбции — кривая насыщения, отвечающая образованию мономолекулярного адсорбционного слоя (рис. 9.23).
Рассмотрим определение констант уравнения Ленгмюра (константы адсорбционного равновесия и величины предельной адсорбции).
Константы А¥ и К удобно определять графически. Для этого преобразуем уравнение изотермы адсорбции Ленгмюра: возведем обе части этого уравнения в степень « -1».


Рис. 9.23. Изотерма адсорбции по Ленгмюру
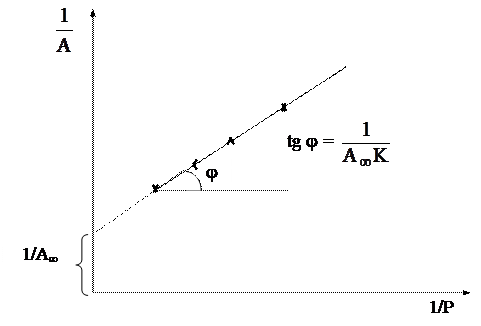 |
Рис.9.24. Графический способ определения констант А¥ и К
Полученное выражение представляет собой линейную зависимость : 1/А = f (1/Р) (рис.9.24), в которой 1/(К А¥) — тангенс угла наклона прямой, а 1/ А¥ — длина отрезка на оси ординат, отсекаемого продолжением графика функции 1/А = f (1/Р).
Для построения графика, приведенного на рис. 9.24, необходимо экспериментально определить величину адсорбции для нескольких значений давления газа (или для нескольких концентраций растворенного вещества).
Уравнение Ленгмюра описывает процесс адсорбции с молекулярно – кинетических позиций, в то время как уравнение Гиббса с термодинамических позиций. В уравнение Гиббса входит поверхностное натяжение, которое является практически не определяемой величиной для твердых поверхностей. Из уравнения Гиббса следует, что при адсорбции происходит уменьшение поверхностного натяжения, то есть уменьшение свободной поверхностной энергии (что и является причиной адсорбции).
Рассмотрим взаимосвязь уравнений Гиббса и Ленгмюра, с разных позиций описывающих процесс адсорбции.
Снижение поверхностного натяжения s с возрастанием концентра-ции Сописывается эмпирическим уравнением Б.А. Шишковского, предложенным им в 1908 году:
Ds = s0 — s = В ln (КС + 1) (9.56)
где Ds — разность поверхностного натяжения чистого растворителя (s0) и раствора (s) с концентрацией С;
А и В — постоянные, значения которых находят из опыта.
Пользуясь уравнением Шишковского в дифференциированном виде, можно перейти от уравнения Гиббса к уравнению Ленгмюра.
Продифференцируем уравнение Шишковского, учитывая, что дифференциал от постоянной величины s0 равен 0, а дифференциал d(Bln(KC + 1)) = (ВК/(КС+1)) dС.
d(s – s0) = d(Bln(KC + 1)), отсюда
ds = 
Разделим обе части на dС

Из уравнения Гиббса
Г = 
и подставим в выражение (9.58)

Выразим из этого уравнения величину Г

Это уравнение аналогично уравнению Ленгмюра при условии, что Г = А (это практически одно и то же);

К – константа адсорбционного равновесия.
Отсюда А = А¥
Таким образом, мы пришли к уравнению Ленгмюра. Следовательно, уравнение Шишковского является тем переходным мостом, который соединяет уравнение Гиббса, выведенное исходя из термодинамических представлений, и уравнение Ленгмюра, выведенное на основе молекуляр-но-кинетических положений.
Из выражения (9.60) становится ясным смысл эмпирических констант К и В из уравнения Шишковского:
К – константа адсорбционного равновесия, которая будет иметь разное значение для разных представителей одного гомологического ряда;
Так как величина А¥ одинакова для всех членов любого гомологического ряда (молекулы ПАВ занимают одинаковую площадь в мономолекулярном адсорбционном слое) и мало различается для обычных ПАВ (жирные кислоты, спирты и т.д.), становится понятным, почему В является постоянной величиной для всего гомологического ряда при постоянной температуре.
Таким образом, уравнение Гиббса, характеризующее изменение поверхностного натяжения растворов при адсорбции, может быть приведено к уравнению Ленгмюра, выведенному для адсорбции газов на твердых адсорбентах.
Отсюда следует, что адсорбция различных веществ на различных поверхностях раздела фаз подчиняется одним и тем же закономерностям.
Очевидно, что адсорбция молекул на твердых поверхностях приво-дит к уменьшению поверхностного натяжения на границе твердое тело – газ, хотя в отличие от жидких поверхностей опытным путем это установить невозможно.
Отсюда становится очевидной и причина адсорбции – это стремление к уменьшению свободной поверхностной энергии (т.е. поверхностного натяжения).
Лекция №3
План лекции:
1.Поверхностное натяжение — физический смысл.
АДСОРБЦИЯ
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения ( s )
Вследствие этого стремления происходит адсорбция.
Адсорбция — процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Т.е. адсорбция может происходить в многокомпонентных системах, в слой переходит тот компонент, который сильнее уменьшает s .
Адсорбент — фаза определяющая форму поверхности, более плотная, может быть твердой или жидкой.
Адсорбат — вещество которое перераспределяется (газ или жидкость).
Десорбция — переход вещества из поверхностного слоя в объемную фазу.
Количественно адсорбцию описывают величиной Гиббсовской адсорбции (избыток вещества в поверхностном слое по сравнению с его количеством в объемной фазе, отнесенный к единице площади поверхности или единице массы адсорбента)

Г i -Гиббсовская адсорбция,
V -объем системы,
с0 -исходная концентрация адсорбата ,
с i — концентрация адсорбата в объеме,
S — площадь поверхности раздела.
Все величины в (3.1) могут быть установлены экспериментально.
Адсорбцию можно рассматривать как процесс превращения поверхностной энергии в химическую.
Выведем соотношение между поверхностным натяжением и химическими параметрами компонентов.
Если объем поверхностного слоя равен 0, то
т.к. внутр. энергия пропорциональна экстенсивным величинам, то:
полный дифференциал от тех же переменных запишется следующим образом:
dU=T dS + S dT + s dS +S d s + å m i dn i + å n i d m (3.3)
Подставляя dU из 3.2 в 3.3, получим:
3.4 и 3.5 — уравнения Гиббса для межфазной поверхности (поверхностного слоя).
Все экстенсивные величины поверхности зависят от площади поверхности , поэтому удобнее относить эти параметры к единице площади поверхности. Разделив уравнение 3.5 на площадь поверхности, получим:


Г i — поверхностный избыток компонента i в поверхностном слое (по сравнению с его равновесной концентрацией в объемной фазе), то есть величина Гиббсовской адсорбции.
Уравнение 3.6 — фундаментальное адсорбционное уравнение Гиббса. Это строгое термодинамическое соотношение, написанное для многокомпонентной системы. Однако, практиче ское его использование неудобно. Оно, например, не раскрывает зависимость поверхностного натяжения от адсорбции конкретного вещества при постоянных химических потенциалах других веществ.. Единицы величины гиббсовской адсорбции определяются единицами химического потенциала. Если потенциал отнесен к молю вещества, то величина адсорбции выражается в молях на единицу площади.
Адсорбция конкретного вещества при постоянных химических параметрах других веществ:
Принимая во внимание , что m i = m i o + RT ln ai, m i и m i o — равновесное и стандартное значения химического потенциала адсорбата i , а i — термодинамическая активность адсорбата, d m i = RT d ln ai ,получим :
для Гиббсовской адсорбции:

3.7. применяют только тогда, когда можно использовать концентрации вместо активностей и пренебречь изменениями концентраций других веществ при изменении концентрации одного вещества. Этим условиям удовлетворяет разбавленный раствор относительно данного компонента. В таком растворе при изменении концентрации растворенного вещества практически не изменяется концентрация растворителя. Поэтому для растворенного вещества уравнение 3.7 переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов и электролитов


УРАВНЕНИЕ ГЕНРИ, ФРЕЙНДЛИХА, ЛЕНГМЮРА
Для описания процесса адсорбции, помимо фундаментального уравнения адсорбции Гиббса, применяют ряд других аналитических уравнений, которые называются по имени их авторов.
При незначительном заполнении адсорбента адсорбатом отношение концентрации вещества в адсорбционном слое и в объеме стремится к постоянному значению, равному кГ:
Это уравнение характеризует изотерму адсорбции при малых концентрациях адсорбата (рис.3.1, участок 1) и является аналитическим выражением закона Генри. Коэффициент кГ не зависит от концентрации и представляет собой константу распределения, характеризующую распределение вещества в адсорбционном слое по отношению к его содержанию в объемной фазе. Уравнение Генри соблюдается приближенно, но это приближение достаточно для практики.
В более общем виде зависимость адсорбции от концентрации адсорбата можно определить с помощью уравнения Фрейндлиха.
http://lektsia.com/5x38c0.html
http://www.trotted.narod.ru/collchem/lec-3.htm