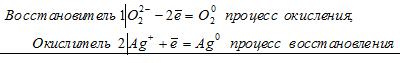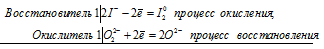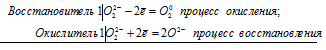Что будет если смешать Перекись водорода и йод? Что это за реакция? Чем опасна?)
знаю, что менял цвет, при добавлении перекиси в йод, потом появлялся осадок, при накрытии (листком или крышки) на листе филеолетовые круги.
Йод реагирует с пероксидом ( причем частично и не очень быстро ). Так же изменение цвета обусловлено окислением иодида калия из настойки йода ( до элементарного йода ), при этом разрушается окрашенный в коричневый цвет комплекс KI x I2, часть йода выпадает в осадок, жидкость приобретает светло-коричневый цвет ( типа цвета некрепкого чая ).
Одновременно выделяется газ ( кислород ) — это разлагается пероксид водорода ( примеси сильно ускоряют этот процесс) .
Фиолетовые круги на крышке/листе — испарившийся йод.
Реакция не опасна, если не пить получившийся раствор и не нюхать газ прямо из реакционного сосуда
Небольшую опасность представляет возможность образования йодоформа ( из спирта настойки и йода ), но скорость её очень мала и опасаться практически нечего.
На будущее — не следует смешивать всё подряд, не просчитав продуктов реакции.
Реакция взаимодействия иода, пероксида водорода и гидроксида натрия
Реакция взаимодействия иода, пероксида водорода и гидроксида натрия
Уравнение реакции взаимодействия иода, пероксида водорода и гидроксида натрия:
Реакция взаимодействия иода, пероксида водорода и гидроксида натрия.
В результате реакции образуется йодид натрия, кислород и вода.
Для проведения реакции используется горячий водный раствор гидроксида натрия.
Реакция протекает при нормальных условиях.
Формула для поиска по сайту: I2 + H2O2 + 2NaOH → 2NaI + O2 + 2H2O
Реакция взаимодействия железа и теллура
Реакция взаимодействия хлорида титана (IV) и магния
Реакция взаимодействия углерода и кислорода
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Пероксид водорода в окислительно-восстановительных реакциях
Решение задач по химии на составление уравнений реакций окисления-восстановления на примере пероксида водорода
Задание 325.
Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2O;б) с КI.
Решение:
В пероксиде водорода Н2О2 кислород находится в своей промежуточной степени окисления -1, поэтому в зависимости от условий он может быть как восстановителем (когда увеличивает свою степень окисления атом кислорода), так и окислителем (когда атом кисло-рода уменьшает свою степень окисления). Например:
Здесь в пероксиде атом кислорода увеличивает свою степень окисления от -1 до 0, т.е. Н2О2 – восстановитель.
Здесь в пероксиде атом кислорода уменьшает свою степень окисления от -1 до -2, т.е. Н2О2 – окислитель.
Задание 326
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
Решение:
Реакции самоокисления-самовосстановления (реакции диспропорционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента в соединении. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления промежуточной между минимально и максимально возможной. Например, реакция самоокисления-самовосстановления:
В пероксиде водорода Н2О2 атом кислорода находится в своей степени окисления -1, про-межуточной между максимальной (0) и минимальной (-2).
http://chemicalstudy.ru/reaktsiya-vzaimodejstviya-ioda-peroksida-vodoroda-i-gidroksida-natriya/
http://buzani.ru/zadachi/khimiya-shimanovich/973-peroksid-vodoroda-zadachi-325-326