Лабораторная работа № 7.
Цель: — изучение частных реакций анионов I, II, III групп.
Ход работы:
Задание 1: Проделать частные реакции анионов I, II, III групп. Результаты работы оформить в виде таблицы:
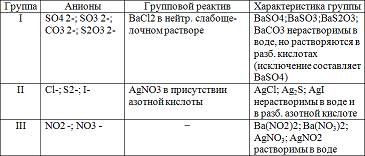
Реакции анионов первой аналитической группы: SO4 2-, SO3 2-, S2O3 2-, CO3 2-. Реакции сульфат — иона SO4 2-. Реакция с хлоридом бария ВаCl2. Хлорид бария ВаСl2 с сульфат — ионами SO4 2- образует кристаллический осадок сульфат бария BaSO4 белого цвета, нерастворимый в кислотах и щелочах:
Проведение реакции: В пробирку прилить2 — 3 капли раствора сульфата натрия Na2SO4 и хлорида бария ВаСl. Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части добавить 2-3 капли раствора серной кислоты H2SO4, а к Другой — столько же раствора соляной кислоты HCl. Осадок не растворяется.
Реакции сульфит-иона SO3 2-.
Сернистая кислота H2SO3 существует только в водном растворе. Она нестойкая и разлагается на воду и оксид серы (IV). Сернистая кислота образует два типа солей: сульфиты и гидросульфиты (HSO3 -). Сернистая кислота и её соли — сильные восстановители и слабые окислители.
Реакция с хлоридом бария ВаС12.
Хлорид бария ВаС12 с сульфит- ионами SO3 2- образует кристаллический осадок сульфит бария BaSO3 белою цвета:
Осадок сульфита бария растворяется в соляной и азотной кислотах с выделением оксида серы (IV), обладающего характерным запахом:
Проведение реакции: К 2 — 3 каплям раствора сульфита натрия Na2SO3 прилить столько же раствора хлорида бария ВаС12. Наблюдать выпадение осадка белого цвета. Осадок разделить на две части, к одной части добавить раствор соляной кислоты HCl, а к другой раствор азотной кислоты HNO3. Наблюдать растворение осадка в обеих пробирках.
Реакция с кислотами. Кислоты разлагают все сульфиты с выделением оксида серы (IV):
Выделяющийся оксид серы (IV) обесцвечивает растворы йода или перманганата калия, например:
Эта реакция используется для определения общего количества SO? о сыром очищенном, сульфитированом картофеле.
Проведение реакции: В пробирку прилить 2 — 3 капли раствора йода и добавить раствор крахмала. Наблюдать окрашивание раствора йода в синий цвет. К смеси прилить 2 — 3 капли раствора сульфита натрия Na2SO3 и 2 — 3 капли раствора соляной кислоты. Исчезновение синей окраски указывает на присутствие оксида серы (IV) SO2. Реакция с окислителями (йод или перманганат калия). Сульфит — ионы обесцвечивают раствор йода и перманганата калия. Реакции протекают в кислой среде. Реакции протекают по уравнениям:
Проведение реакции: В одну пробирку прилить 1 — 2 кайли раствора перманганата калия KMnO4, прибавить 3 — 4 капли раствора серной кислоты ll2S04 и по каплям раствор сульфита натрия Na2SO3 до обесцвечивания реакционной смеси. В другую пробирку прилить 1 — 2 капли раствора йода I2, каплю раствора крахмала и по каплям прибавлять раствора сульфита натрия Na2SO3 до обесцвечивания реакционной смеси.
Реакции тиосульфат — иона S2O3 2-. Тиосерная кислота H2S2O3 неустойчива, разлагается на оксид серы (IV), серу и воду:
Разлагается даже в разбавленных водных растворах. Соли тиосерной кислоты — тиосульфаты — более устойчивы и являются более сильными восстановителями.
Реакция с хлоридом бария ВаС12. Тиосульфат — ионы с хлоридом бария ВаС12 образуют белый осадок тиосульфата бария BaS2O3. Осадок образуется только в избытке хлорида бария:
Осадок тиосульфата бария растворяется при нагревании в минеральных кислотах с выделением серы:
Проведение реакции: К 2 — 3 каплям раствора тиосульфата натрия Na2S203 прилить столько же капель раствора хлорида бария BaCl2. Наблюдать выпадение осадка белого цвета. К осадку добавить 2 — 3 капли раствора соляной кислоты HCl. Наблюдать растворение осадка.
Реакция с кислотами. Минеральные кислоты разлагают тиосульфаты, при этом выделяются в виде осадка бледно-желтого цвета и оксид серы (IV);
Проведение реакции: К 3 — 5 каплям раствора тиосульфата натрия Na2S2O3 cтолько же раствора серной кислоты H2SO4. Наблюдать выпадение осадка бледно-желтого цвета
Реакция с окислителями (йод I2 или перманганат калия KMnO4). Окислители (KMnO4, I2) окисляют ионы S2O3 2- до S4O6 2- — тетратионат — ионов. Реакцию проводят в нейтральной среде:
Эта реакция лежит в основе иодометрического метода определения содержания сахара в продуктах питания
Проведение реакции: В одну пробирку прилить 1 — 2 капли раствора перманганата калия KMnO4, прибавить 3 — 4 капли раствора серной кислоты H2SO4 и по каплям раствор тиосульфата натрия Na2S2O3 до обесцвечивания реакционной смеси. В другую пробирку прилить 1 — 2 капли раствора йода I2, каплю раствора крахмала и по каплям прибавлять раствора тиосульфата натрия Na2S2О3 до обесцвечивания реакционной смеси.
Реакции карбонат — ионов CO3 2-. Угольная кислота неустойчива, разлагается на оксид углерода (IV) и воду по уравнению
Угольная кислота дает два типа солей: карбонаты и гидрокарбонаты (НСО3). Карбонаты щелочных металлов и аммония растворимы в воде. Нерастворимые в воде карбонаты растворяются в уксусной и минеральных кислотах.
Реакция с хлоридом бария ВаС12. Хлорид бария ВаС12 с ионами СО3 2- дает осадок белого цвета, растворимый в минеральных и уксусной кислотах:
Проведение реакции: К 2 — 3 каплям раствора карбоната натрия Na2CO3 прилить 2 — 3 капли раствора хлорида бария ВаСl2. Наблюдать выпадение осадка белого цвета. К осадку добавить 4 — 5 капель раствора серной кислоты Наблюдать бурное выделение газа.
Реакция с кислотами. Карбонаты разлагаются разбавленными кислотами с выделением оксида углерода (IV) по уравнению:
Выделяющийся оксид углерода (IV) открывают по помутнению известковой или баритовой воды
Не следует продолжительное время пропускать оксид углерода (IV) через известковую пли баритовую воду, так как избыток СO2 превращает карбонаты в растворимые гидрокарбонаты
Проведение реакции: Реакцию выполняют в пробирке с газоотводное трубкой, в которую по метают 5 — 6 капель раствора карбоната натрия Na2CO3 и равный объем раствора соляной кислоты НCl. Пробирку закрывают пробкой с газоотводной трубкой, конец которой помещают в пробирку с известковой или баритовой водой. Наблюдать образование белого осадка или помутнение раствора.
Реакции анионов второй аналитической группы: Сl-, I-, S2-.
Реакции хлорид — ионов Cl-.
Соляная кислота НCl — сильный электролит. Образует нормальные соли – хлориды. Все хлориды растворимы в воде, за исключением AgCl, PbCl2, Ионы Сl- бесцветны.
Реакция с нитратом серебра AgNO3. Нитрат серебра AgNO3 с ионами Сl- образует белый творожистый осадок хлорида серебра:
Осадок хлорида серебра хорошо растворяется в растворе гидроксида аммония:
При подкислении азотной кислотой аммиачного раствора хлорида серебра вновь выпадает белый творожистый осадок хлорида серебра.
Проведение реакции: К 2 — 3 каплям раствора хлорида натрия NaCl прилить столько же раствора нитрата серебра AgNO3. Наблюдать выпадение белого осадка. К осадку добавим, раствор гидроксида аммония NH4OH до полного растворения. В полученном растворе открыть анноны Сl- действием 3 — 5 капель раствора азотной кислоты.
Реакции иодид — ионов I-.
Иодоводородная кислота HI — сильная кислота и сильный восстанови гель. Соли её называют иодидами. Все они, за исключением AgI, HgI2 PbI2, растворимы в воде. Ионы I- бесцветны.
Реакция с нитратом серебра AgNO3,
Нитрат серебра AgNO3 с ионами I- образует желтый творожистый осадок иодида серебра:
Осадок нерастворим в минеральных кислотах и растворе аммиака.
Проведение реакции: К 2 — 3 каплям раствора иодида калия КI прилить 3 — 4 капли раствора жирата серебра AgNO3. Наблюдать выпадение желтого осадка.
Реакции сульфид — иона S2-.
Ионы S2- бесцветны. Сероводородная кислота H2S образует два вида солей: сульфиды и гидросульфиды (HS-). Сульфиды щелочных и щелочно-земельных металлов и аммония растворимы в воде. Сероводородная кислота и сё соли — сильные восстановители, сами окисляются до свободной серы или до серной кислоты.
Реакция с нитратом серебрa AgNO3. Нитрат серебра AgNO3 с попами S2- образует черный осадок сульфида серебра:
Осадок сульфида серебра нерастворим в растворе NH4OH, но растворяется при нагревании в растворе азотной кислоты HNO3
Проведение реакции: К 2 — 3 каплям раствора сульфида натрия Na2S прилить 3 — 4 капли раствора нитрата серебра AgNO3. Наблюдать выпадение осадка черного цвета.
Реакция с кислотами. Разбавленные кислоты HCl, H2SO4 разлагают сульфиды с выделением сероводорода H2S:
Сероводород можно обнаружить по запаху (тухлых яиц) и по почернению бумажки, пропитанной солью свинца Эта реакция используется для определения сероводорода в мясных полуфабрикатах и полуфабрикатах из соленой рыбы. Присутствие сероводорода указывает на глубокий распад белков.
Проведение реакции: Смочить полоску фильтровальной бумаги раствором соли свинца В пробирку прилить 2 — 3 капли раствора сульфида натрия Na2S и 3 — 4 капли раствора соляной кислоты. Пробирку накрыть подготовленной полоской фильтровальной бумаги и слегка нагреть. Наблюдать почернение фильтровальной бумажки.
Реакции анионов третьей аналитической группы; NO3 -, NO2 -. Реакции нитрат — ионов NO3 -.
Азотная кислота HNO3 — сильный электролит. Разбавленная и концентрированная кислота — сильный окислитель. Соли азотной кислоты называют нитратами и хорошо растворимы в воде. Ионы NO3 — бесцветны. Реакция с сульфатом железа (II) FeSO4. Сульфат железа (II) FeSО4 восстанавливает азотную кислоту и её соли до оксида азота (II) NO:
Выделяющийся оксид азота (II) образует с FeSO4 непрочное комплексное соединение [Fe(NO)]SO4 бурого цвета.
Проведение реакции, в пробирку прилить 2 — 3 капли раствора нитрата калия KNO3, 3 — 4 капли концентрированного раствора сульфата железа (II) FeSO4. Затем осторожно по стенке пробирки добавить концентрированную серную кислоту. В месте соприкосновения жидкостей появляется темно-бурое окрашивание.
Реакция с дифениламином.
Дифениламин с ионами NO3 — даст интенсивное васильково — синее окрашивание Реакция весьма чувствительна, но не специфична, гак как такое же окрашивание дают и другие окислители, например, нитриты, хроматы, перманганаты.
Проведение реакции: В небольшую фарфоровую чашку поместить один кристалл дифениламина и 1 мл химически чистой концентрированной серной кислоты H2SO4. Сюда же осторожно прилить 1 — 2 капли раствора нитрата калия KNO3. Наблюдать появление интенсивного васильково — синего окрашивания.
Реакции ширит — ионов NO2 -.
Азотистая кислота HNO2 и её соли могут быть и окислителями, и восстановителями. Соли азотистой кислоты называются нитритами. Нитриты хорошо растворимы в воде, исключением является интриг серебра AgNO2, Ионы NO2 — бесцветны.
Реакция с перманганатом калин КМnО4. Перманганат кадия KMnO4 окисляет ноны NO2 — до NO3 -, при этом происходит обесцвечивание раствора перманганата калия.
Проведение реакции: В пробирку прилить 3 — 4 капли раствора нитрита калия, раствор подкислить раствором серной кислоты H2SO4. Затем к смеси добавить по каплям раствор перманганата калия КМnО4. Наблюдать обесцвечивание малиновой окраски перманганата калия
Контрольные вопросы:
1. Почему анионы I руины нельзя осаждать ВаСl2 в кислой среде?
2. Почему анионы II группы необходимо осаждать AgNO3 в присутствии HNO3?
3. Чем отличаются анионы III группы от анионов I и II групп?
4. Реакции ионов NO3 и NО2 — с соответствующими реактивами являются окислнтельно — восстановителными. Расставьте в них коэффициенты методом электронного баланса.
5. Какие анионы служат окислителями, и какие восстановителями?
Дата добавления: 2015-11-10 ; просмотров: 9089 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Перманганат калия и тиосульфат натрия уравнение реакции
Репетитор по химии и биологии
Богунова В.Г.
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Хватит бояться ОВР! 9.6. Галерея классических окислителей. Перманганат
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня мы начинаем знакомиться с портретами известных окислителей, вернее, с продуктами их восстановления. Их нужно помнить, чтобы написать ОВР методом полуреакций. Не нужно нервничать. Точек продуктов восстановления окислителей очень мало (около 15). Остальное — технология написания окислительно-восстановительных реакций.
Вначале давайте вспомним, кто такие окислители и чем они отличаются от восстановителей?
1) Окислитель — атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
2) Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
3) Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (равна номеру группы).
1) Перманганат калия KMnO4 — черное кристаллическое вещество, растворы которого имеют интенсивно фиолетовую окраску.
2) KMnO4 — очень сильный окислитель.
3) Степень восстановления атома Mn+7 зависит от рН среды
На схеме хорошо видно, чем выше кислотность среды, тем выше окислительные способности перманганат-иона MnO4 — . Это объясняется тем, что ионы Н + внедряются в анионы MnO4 — и ослабляют связь между атомами марганца и кислорода, деформируют анионы (за счет их поляризации) и облегчают, тем самым, действие восстановителя. Гидроксид-ионы в щелочной среде способствуют упрочнению связи между атомами марганца и кислорода Mn-О, поэтому перманганат-ион восстанавливается «совсем чуть-чуть».
Хотите научиться писать ОВР? Первое задание — выучить три точки продукта восстановления перманганат-иона (в разных средах).
Внимательно прочитайте примеры ОВР с участием перманганата калия в различных средах и попробуйте прописать их самостоятельно.
1) Перманганат в кислой среде
2) Перманганат в нейтральной среде
3) Перманганат в щелочной среде
На закуску дарю небольшую подборку вариантов 30-х заданий ЕГЭ с перманганатом калия. Попробуйте выполнить задания и написать ОВР методом полуреакций. Правильность написания ОВР можно проверить по готовым молекулярным уравнениям реакции.
Задание 30 (5 вариантов с решением)
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Допустимо использование водных растворов веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) перманганат калия, иодид калия, сульфат аммония, ацетат натрия, сульфат магния
2) бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия
3) перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия
4) нитрит калия, перманганат калия, нитрат натрия, хромат натрия, хлорид бария
5) перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова (II)
Ссылки на статьи, в которых очень подробно разобрана технология написания окислительно-восстановительных реакций:
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья ВК, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Пишите мне в WhatsApp +7(903)186-74-55
Приходите ко мне на занятия, я помогу вам изучить химию и биологию, научу решать любые задачи, даже самые сложные.
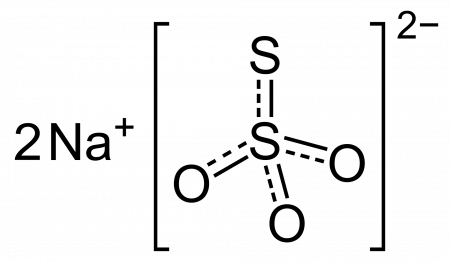
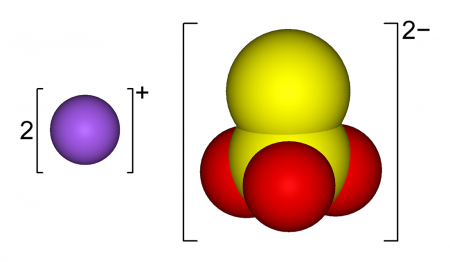
Тиосульфат натрия
| Тиосульфат натрия | |||
|---|---|---|---|
| |||
| Систематическое наименование | тиосульфат натрия | ||
| Традиционные названия | гипосульфит | ||
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) | ||
| Молярная масса | 158,11 г/моль | ||
| Плотность | 2,345 г/см³ | ||
| Температура | |||
| • плавления | 48,5 °С (пентагидрат) | ||
| • разложения | 300 °C | ||
| Растворимость | |||
| • в воде | 70,1 20 ; 229 80 г/100 мл | ||
| Рег. номер CAS | 7772-98-7 | ||
| PubChem | 24477 | ||
| Рег. номер EINECS | 231-867-5 | ||
| SMILES | |||
| Кодекс Алиментариус | E539 | ||
| RTECS | XN6476000 | ||
| ChEBI | 132112 | ||
| ChemSpider | 22885 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Тиосульфат натрия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
Содержание
Получение
- окислением полисульфидов Na;
- кипячение избытка серы с Na2SO3:
Na2SO3 + S → Na2S2O3
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
4SO2 + 2H2S + 6 NaOH → 3 Na2S2O3 + 5H2O
- кипячение избытка серы с гидроксидом натрия:
4 S + 6 NaOH → 2Na2S + Na2S2O3 + 3H2O
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
2NaNO2 + 2 S → Na2S2O3 + N2O
- растворение сульфида натрия в воде в присутствии кислорода воздуха:
2Na2S + 2 O2 + H2O → Na2S2O3 + 2 NaOH
Физические и химические свойства
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль.
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C)).
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100 о С.
При нагревании до 220 °C распадается по схеме:
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, йодом, переводится в соли тетратионовой кислоты:
Приведённая реакция очень важна, так как служит основой йодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия йодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
http://repetitor-him.ru/sthim_ssh_9(6).htm
http://chem.ru/tiosulfat-natrija.html

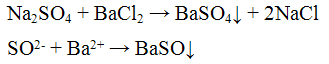
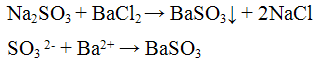
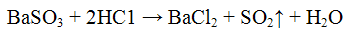
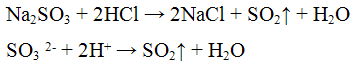
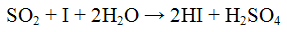
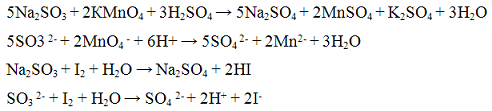
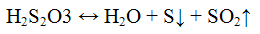
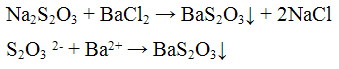
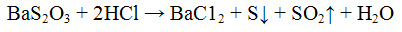
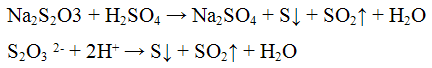
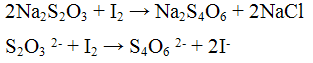
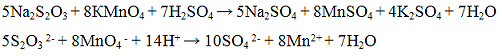
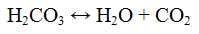
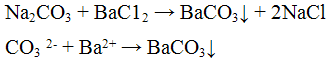
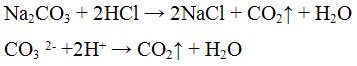
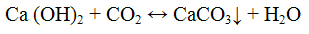
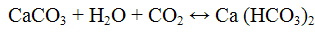

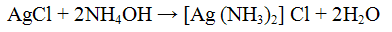
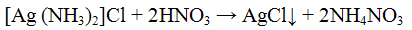
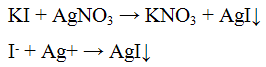
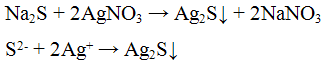
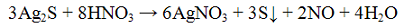

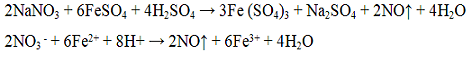





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)


_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)