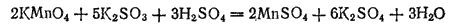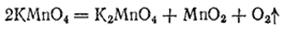Соединения Марганца(VI) И (VII).
При сплавлении диоксида марганца с карбонатом и нитратом калия получается зеленый сплав, растворяющийся в воде с образованием красивого зеленого раствора. Из этого раствора можно выделить темно-зеленые кристаллы манганита калия K2MnO4 — соли марганцовистой кислоты H2MnO4, очень нестойкой даже в растворе.
Реакцию образования манганата калия можно выразить уравнением:
Если раствор манганата оставить стоять на воздухе, то окраска его постепенно изменяется, переходя из зеленой в малиновую, причем образуется темно-бурый осадок. Это объясняется тем, что в водном растворе манганаты самопроизвольно превращаются в соли марганцовой кислоты HMnO4 (перманганаты) с одновременным образованием диоксида марганца. Реакция выражается уравнением
или в ионно-молекулярной форме:
При этой реакции один ион MnO42- окисляет два других таких же иона в ионы MnO4-, а сам восстанавливается, образуя MnO2.
Процесс превращения манганата в перманганат обратим. Поэтому в присутствии избытка гидроксид-ионов зеленый раствор манганата долгое время может сохраняться без изменения. Если же прибавить кислоту, связывающую гидроксид-ионы, зеленая окраска почти мгновенно изменяется на малиновую.
При действии сильных окислителей (например, хлора) на раствор манганата последний полностью превращается в перманганат:
Перманганат калия KMnO4 — наиболее широко применяемая соль марганцовой кислоты. Кристаллизуется он в виде красивых темно-фиолетовых, почти черных призм, умеренно растворимых в воде. Растворы KMnO4 имеют темно-малиновый, а при больших концентрациях — фиолетовый цвет, свойственный ионам MnO4-. Как и все соединения марганца (VII), перманганат калия — сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т. д.
Вступая в окислительно-восстановительные реакции, KMnO4 (ион MnO4-) может восстанавливаться в различной степени. В зависимости от pH среды продукт восстановления может представлять собою ион Mn2+ (в кислой среде), MnO2 (в нейтральной или в слабощелочной среде) или ион MnO42- (в сильнощелочной среде).
Проиллюстрируем эти три случая реакциями взаимодействия KMnO4 с растворимыми сульфитами. Если к подкисленному серной кислотой фиолетовому раствору KMnO4 прибавить сульфит калия K2SO3, то жидкость становится почти бесцветной, так как образующаяся соль марганца (II) имеет бледно-розовую окраску. Реакция выражается уравнением
или в ионно-молекулярной форме:
При действии сульфита калия на нейтральный раствор перманганата калия тоже происходит обесцвечивание раствора, но, кроме того, выпадает бурый осадок диоксида марганца и раствор приобретает щелочную реакцию
или в ионно-молекулярной форме:
При большой концентрации щелочи и малом количестве восстановителя образуются ионы манганата согласно уравнению:
Как энергичный окислитель перманганат калия широко применяют в химических лабораториях и производствах; он служит также прекрасным дезинфицирующим средством.
При нагревании в сухом виде перманганат калия уже при температуре около 200°C разлагается согласно уравнению:
Этой реакцией иногда пользуются в лаборатории для получения кислорода.
Соответствующая перманганатам свободная марганцовая кислота HMnO4 в безводном состоянии не получена и известна только в растворе. Концентрацию ее раствора можно довести до 20%. Это очень сильная кислота, в водном растворе полностью диссоциированная на ионы: ее кажущаяся степень диссоциации в 0,1 н. растворе равна 93%.
Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 может быть получен действием концентрированной серной кислоты на перманганат калия:
Марганцовый ангидрид — зеленовато-бурая маслянистая жидкость. Он очень неустойчив: при нагревании или при соприкосновении с горючими веществами он со взрывом разлагается на диоксид марганца и кислород.
Разложение перманганата калия. Свойства солей марганцевой кислоты
Окислительно-восстановительные процессы лежат в основе важнейших явлений живой и неживой природы: горения, разложения сложных веществ, синтеза органических соединений. Перманганат калия, свойства которого мы изучим в нашей статье, относится к наиболее сильным окислителям, применяемым в лабораторных и промышленных условиях. Его окислительные способности зависят от степени окисления атома, которая меняется в ходе реакции. Рассмотрим это на конкретных примерах химических процессов, происходящих с участием молекул KMnO4.
Характеристика вещества
Рассматриваемое нами соединение (перманганат калия) является одним из наиболее применяемых в промышленности веществ – соединений марганца. Соль представлена кристаллами в виде правильных призм темно-фиолетового цвета. Она хорошо растворяется в воде и образует раствор малинового цвета, обладающий прекрасными бактерицидными характеристиками. Поэтому вещество нашло широкое применение как в медицине, так и в быту в качестве бактерицидного средства. Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
Опыты с марганцовкой
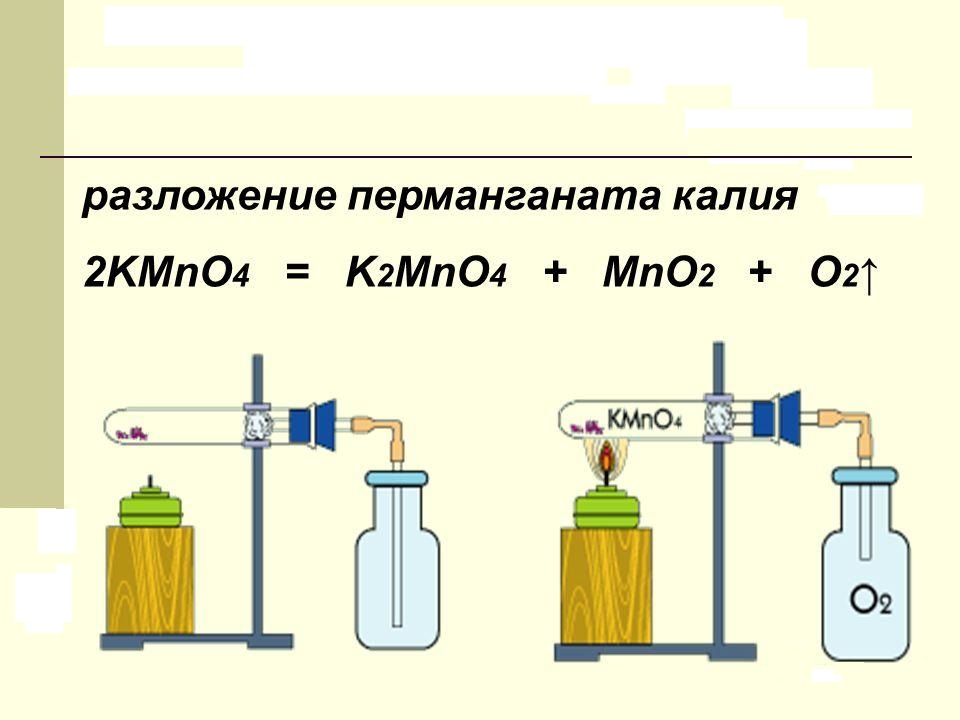
Вещество, в быту называемое марганцовкой, при нагревании разлагается. В продуктах реакции обнаруживается свободный кислород, двуокись марганца и новая соль – K2MnO4. В лаборатории этот процесс проводят для получения чистого кислорода. Химическое уравнение разложения перманганата калия можно представить так:
Сухое вещество, представляющее собой фиолетовые кристаллы в виде правильных призм, нагревают до температуры +200 °C. Катион марганца, находящийся в составе соли, имеет степень окисления, равную +7. Она снижается в продуктах реакции до величин +6 и +4 соответственно.
Окисление этилена
Газообразные углеводороды, относящиеся к различным классам органических соединений, имеют как одинарные, так и кратные связи между атомами углерода в составе своих молекул. Как определить присутствие пи-связей, лежащих в основе непредельного характера органического соединения? Для этого проводят химические опыты, пропуская исследуемое вещество (например, этен или ацетилен) через фиолетовый раствор перманганата калия. Наблюдается его обесцвечивание, так как непредельная связь разрушается. Молекула этилена окисляется и из непредельного углеводорода превращается в двухатомный предельный спирт – этиленгликоль. Данная реакция является качественной на наличие двойных или тройных связей.
Особенности химических проявлений KMnO4
Если степени окисления реагентов и продуктов реакции изменяются, значит происходит реакция окисления-восстановления. В ее основе лежит явление перемещения электронов от одних атомов к другим. Как и в случае с разложением перманганата калия, так и в других реакциях, вещество проявляет ярко выраженные свойства окислителя. Например, в подкисленном растворе сернистокислого натрия и перманганата калия образуется сульфаты натрия, калия и марганца, а также вода:
В этом случае ион серы является восстановителем, а марганец, входящий в сложный анион MnO4 — , проявляет свойства окислителя. Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Влияние среды на протекание химической реакции
В зависимости от концентрации ионов водорода или гидроксильных групп различают кислый, щелочной или нейтральный характер раствора, в котором происходит окислительно-восстановительная реакция. Например, при избыточном содержании катионов водорода, ион марганца со степенью окисления +7 в перманганате калия понижает ее до +2. В щелочной среде, при высокой концентрации гидроксильных групп, сульфит натрия, взаимодействуя с перманганатом калия, окисляется до сульфата. Ион марганца со степенью окисления +7 переходит в катион с зарядом +6, находящийся в составе K2MnO4, раствор которого имеет зеленую окраску. В нейтральной среде сульфит натрия и перманганат калия реагируют между собой, при этом осаждается двуокись марганца. Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.
Применение солей марганцевой кислоты
Реакция разложения перманганата калия при нагревании и другие окислительно-восстановительные процессы, проходящие с участием солей марганцевой кислоты, часто используются в промышленности. Например, окисление многих органических соединений, выделение газообразного хлора из соляной кислоты, превращение солей двухвалентного железа в трехвалентное. В сельском хозяйстве раствор KMnO4 применяют для предпосевной обработки семян и почвы, в медицине им обрабатывают поверхность ран, дезинфицируют воспаленные слизистые оболочки носовой полости, используют для обеззараживания предметов личной гигиены.
В нашей статье мы не только подробно изучили процесс разложения перманганата калия, но также рассмотрели его окислительные свойства и применение в быту и промышленности.
Марганец (Manganum)
Ат. вес 54,94. Марганец принадлежит к довольно распространенным элементам, составляя 0 ,1% веса земной коры. Из соединений, содержащих марганец, наиболее часто встречается минерал пиролюзит, представляющий собой двуокись марганца МnО2. Большое значение имеют также минералы гаусманит Мn3О4 и браунит Мn2О3. Месторождения марганцовых руд с высоким содержанием марганца имеются в Южной Африке, Индии и Бразилии.
Добыча марганцовой руды (в пересчете на металлический марганец) составила в 1956 г. только в капиталистических странах 2,57 млн. г. СНГ располагает особенно большими запасами марганца. Богатейшие залежи пиролюзита находятся у нас в Закавказье (Чиатурское месторождение) и на Украине в районе Никополя; значительные запасы марганцовых руд выявлены также на Урале и в Западной Сибири. По запасам руд с высоким содержанием марганца СНГ стоит на первом месте в мире.
Металлический марганец получается восстановлением его окислов алюминием. Он представляет собой твердый блестящий металл уд. веса 7,4, по внешнему виду похожий на железо, плавящийся при 1250°. На воздухе марганец покрывается тонкой пленкой окислов. В ряду напряжений марганец находится между алюминием и цинком; он легко растворяется в разбавленных кислотах с выделением водорода и образованием ионов Мn •• .
Главное применение марганец имеет в металлургической промышленности. Прибавка марганца к чугуну при переработке его на сталь способствует удалению из чугуна содержащейся в нем серы, которая при этом переходит в шлак; в отсутствие марганца сера остается в стали и сильно понижает ее механические качества. При выплавке стали пользуются не чистым марганцем, а его сплавами с железом — зеркальным чугуном и ферромарганцем. Зеркальный чугун получается путем восстановления углем смеси железных и марганцовых руд в доменной печи и содержит 10—25% марганца, а ферромарганец, содержащий до 80% марганца, готовится из пиролюзита и железных руд в электрических печах. Сталь, содержащая 12—15% марганца, отличается очень большой твердостью и высоким сопротивлением к ударам и изнашиванию; ее применяют для изготовления дробильных машин, железнодорожных рельсов и т. п. В технике широко применяются также легированные стали, к которым, кроме марганца, в качестве присадки добавлены хром и ванадий . В электротехнике большое значение имеет сплав манганин (83% меди, 13% марганца и 4% никеля); из манганиновой проволоки делают катушки сопротивления, так как ее электропроводность почти не изменяется с температурой.
Марганец образует пять простых окислов: МnО, Мn2O3, МnO2, МnO3, Мn2O7 и смешанный окисел Мn3O4 (или МnО•Мn2O3). Первые два окисла имеют основной характер, двуокись марганца Мn02 амфотерна, а высшие окислы МnO3 и Мn2O7 являются ангидридами кислот. Таким образом, и здесь наблюдается такое же изменение характера окислов с увеличением валентности, как и в подгруппе хрома.
В практическом отношении наиболее важны производные двухвалентного марганца, двуокись марганца и соли марганцо рой кислоты — перманганаты, в которых марганец семивалентен.
двухвалентного марганца получаются при растворении марганца в разбавленных кислотах или при действии кислот на различные природные соединения марганца. Так, например, из раствора,, остающегося после получения хлора действием соляной кислоты на двуокись марганца, выкристаллизовывается хлористый марганец МnСl2 в виде бледнорозовых кристаллов. В твердом виде соли двухвалентного марганца обычно розового цвета; растворы же их почти бесцветны.
При действии щелочей на растворы солей двухвалентного марганца выпадает белый осадок —гидрат закиси марганца Мn(ОН)2. Осадок легко растворяется в кислотах, но нерастворим в щелочах так как гидрат закиси марганца обладает только основными свойствами. На воздухе осадок быстро темнеет, окисляясь в бурый гидрат двуокиси марганца Мn(ОН)4 . Закись марганца МnО получается в виде зеленого порошка при восстановлении окислов марганца водородом.
http://fb.ru/article/375419/razlojenie-permanganata-kaliya-svoystva-soley-margantsevoy-kislotyi
http://znaesh-kak.com/x/x/%D0%BC%D0%B0%D1%80%D0%B3%D0%B0%D0%BD%D0%B5%D1%86-manganum