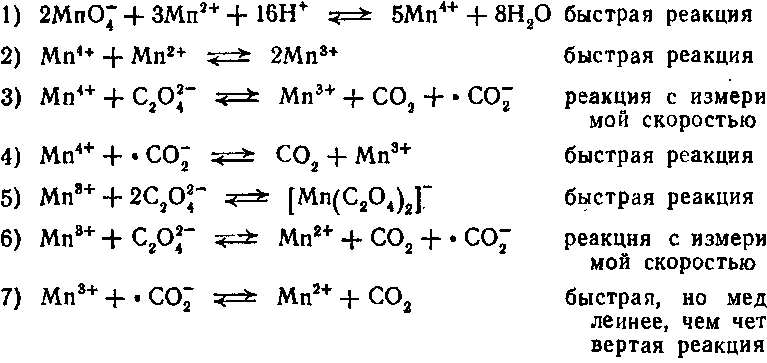Определение нормальности перманганата калия по щавелевой кислоте
Реакция между перманганатом калия и щавелевой кислотой протекает по уравнению:
Реакция автокаталитическая, катализатором являются ионы Mn 2+ , поэтому для ускорения реакции смесь необходимо подогреть до температуры 80-90ºС.
Бюретку заполняют рабочим раствором KMnO4, предварительно ополоснув ее дистиллированной водой и рабочим раствором KMnO4. Уровень жидкости в бюретке устанавливают на нуле по верхнему краю мениска, ввиду темной окраски раствора
Мерную пипетку вместимостью 10 мл промыть дистиллированной водой и ополоснуть раствором щавелевой кислоты. В колбу для титрования отмеряют пипеткой 10 мл раствора щавелевой кислоты, добавляют цилиндром 7-10 мл 2н раствора H2SO4 и подогревают до 80-90º С на асбестовой сетке над газовой горелкой или на электрической плитке с закрытой спиралью. Доводить до кипения раствор в колбе нельзя. Горячий раствор H2C2O4 титруют раствором перманганата калия при постоянном перемешивании, добавляют очередную каплю KMnO4 после обесцвечивания раствора. Скорость реакции постепенно увеличивается. Титрование заканчивают в тот момент, когда бледно-розовая окраска раствора в колбе, появляется от одной избыточной капли раствора KMnO4 и не исчезает в течение 1-2 минут.
Титруют до получения не менее трех сходящихся результатов.
Запись результатов титрования и вычисление нормальности и титра перманганата калия по железу выполняют в следующей последовательности:
г-экв(Fe 2+ ) =1 · 55,85 =55,85 г
T (KMnO4/ Fe 2+ ) = N(KMnO4)·55,85 / 1000 [г/мл]
Контрольная задача
Определение количества железа (II) в растворе соли Мора
Реакция между солью двухвалентного железа и перманганатом калия в кислой среде протекает по уравнению:
В мерную колбу вместимостью 100 мл получают у преподавателя или инженера-химика контрольный раствор соли Мора. Доводят до метки дистиллированной водой, и плотно закрыв колбу пробкой, тщательно перемешивают.
Устанавливают бюретку, вставляют в неё воронку и промывают сначала дистиллированной водой, затем ополаскивают рабочим раствором КMnO4. Бюретку наполняют рабочим раствором перманганата калия, предварительно заполнив носик. Уровень жидкости на нуле устанавливают по верхнему краю мениска.
Пипетку емкостью 10 мл промывают дистиллированной водой, ополаскивают раствором соли Мора. В колбу для титрования отмеряют пипеткой 10 мл раствора соли Мора, добавляют цилиндром 5 – 7 мл 2 н раствора H2SO4 и титруют раствором КMnO4 до появления не исчезающей в течение 1-2 минут бледно-розовой окраски, появившейся от одной избыточной капли раствора КMnO4.
Титрование проводят до получения не менее трех сходящихся результатов.
Запись результатов титрования и вычисления проводят в следующей последовательности:
Q(Fe) = VСР(KMnO4) · T (KMnO4/ Fe 2+ )·Vколбы / Vпипетки [г].
Определив практическую массу железа в контрольном растворе соли Мора, возьмите у инженера-химика теоретическое значение и вычислите погрешности.
Примеры решения типовых задач
Задача 4. Вычислить нормальность и титр перманганата калия (KMnO4) по железу, зная, что на титрование раствора щавелевой кислоты, содержащего 0,01399 г Н2С2О4 · 2Н2О, израсходовано 12,44 см 3 раствора перманганата калия.
Решение. 1) Задача на метод окислительно-восстановительного титрования – перманганатометрия.
2 │MnO4 − + 8H + +5ē → Mn 2+ + 4H2O
2) Метод прямого титрования
g / г-экв = N·V /1000;
N = g · 1000 / г-экв · V;
г-экв (Fe) = 55,85 г.
3) N(KMnO4) = 0,01399 ∙ 1000 / 63,03 ∙ 12,44 = 0,01784 н.
T( KMnO4/Fe) = 0,01784 ∙ 55,85 / 1000 = 0,0009962 г/с
Задача 5. Вычислить количество меди, содержащееся в 250 см 3 раствора медного купороса, если на титрование 25,00 см 3 этого раствора израсходовано 27,75 см 3 0,01848 н раствора тиосульфата натрия.
Решение. 1) Задача на метод окисления-восстановления – йодометрия.
2) Титрование по методу замещения
N(CuSO4) = 0,01848 · 27,75 / 25,00 = 0,02051н.
g(Cu) = 0,02051 · 250 · 63,55 / 1000 = 0,3259 г
МЕТОДЫ КОМПЛЕКСООБРАЗОВАНИЯ
В основе методов лежат реакции образования комплексных соединений, в результате которых определяемый ион количественно выводится из раствора.
Перманганат калия щавелевая кислота уравнение реакции
Опыт 1. Стандартизация раствора перманганата калия по щавелевой кислоте.
Принцип метода. Титрованный раствор перманганата калия нельзя приготовить из точной навески, т. к. перманганат калия содержит примеси. Кроме того, концентрация этого титранта со временем понижается, т. к. он расходуется на взаимодействие с аммиаком, органическими веществами и другими восстановителями, присутствующими в воде. Поэтому точную концентрацию раствора перманганата калия устанавливают обычно через несколько дней после его приготовления. Исходными веществами для его стандартизации служат свежеперекристаллизованная щавелевая кислота (H2C2O4 · 2H2O) или её соли.
Реакция между оксалат-ионами и перманганат-ионами протекает сложно, и упрощённо может быть представлена уравнением:
5С2O42- + 2MnO4-+ 16H+ ® 2Mn2+ + 8H2O + 10CO2.
5 С2O42- — 2e — ® 2CO2
2 MnO4-+ 8H+ + 5e- ® Mn2+ + 4H2O
В действительности реакция протекает в несколько стадий и для её начала необходимо присутствие катиона марганца (II):
MnO4-+ MnС2O4 ® MnO42-(манганат-ион) + MnС2O4+.
Манганат-ион в кислом растворе быстро диспропорционирует:
А) Mn(VI) + Mn(II) ® 2Mn(IV); б) Mn(IV) + Mn(II) ® 2Mn(III). Марганец (III) образует оксалатные комплексы состава Mn(С2O4)n(3-2n)+, где n=1,2,3; они медленно разлагаются с образованием Mn(II) и CO2. Таким образом, пока в растворе не накопится в достаточных концентрациях марганец (II), реакция между MnO4- и С2O42- протекает очень медленно.
Реагенты и оборудование: раствор перманганата калия (»0,05 н); 2 н раствор серной кислоты; стандартный 0,05 н раствор щавелевой кислоты (Мэ=1/2М(H2C2O4)); бюретка; стеклянная воронка; конические колбы ёмкостью 100 мл; пипетки Мора; стеклянный цилиндр ёмкостью 50 мл; электроплитка.
Ход анализа. В чистую бюретку заливают раствор перманганата калия и подготавливают к титрованию. В коническую колбу для титрования отбирают пипеткой Мора 10,00 мл раствора щавелевой кислоты, прибавляют 10 мл 2 н серной кислоты и нагревают раствор в колбе до 70-80° С (не допуская кипения, при котором щавелевая кислота разлагается) и горячий раствор титруют раствором перманганата калия. Раствор перманганата калия нужно добавлять медленно, по каплям, при непрерывном взбалтывании раствора. Каждую следующую каплю добавляют лишь после того, как обесцветилась предыдущая. Вначале обесцвечивание перманганата калия будет происходить медленно, но по мере образования марганца (II), оно ускорится.
Титрование прекращают, когда избыточная капля перманганата калия сообщит раствору бледную малиновую окраску, не исчезающую в течение 1-2 минут. Отсчёт по бюретке удобно брать по верхнему краю мениска, т. к. нижний плохо виден. Повторяют титрование 2-3 раза.
Обработка результатов. Из сходящихся отсчётов берут средний результат титрования и вычисляют нормальность (Сэ) раствора перманганата калия по формуле:
Автокаталитическое окисление щавелевой кислоты перманганатом калия
Индуцированная реакция окисления оксалатов перманганатом калия довольно сложна. Механизм реакции пока еще полностью не выяснен. Реакция, по всей вероятности, является сопряженной, причем марганец(II) выполняет роль индуктора (поэтому реакцию относят к типу автокаталитических). В отсутствие марганца(II) реакция характеризуется длительным индукционным периодом, в течение которого происходит накопление ионов марганца в различной степени окисления. В присутствии марганца (II) реакция протекает практически мгновенно. По-видимому, наиболее вероятна следующая схема процесса [12]:
Марганец(III), кроме указанного комплекса с окса-лат-ионом, образует также комплексы состава

которые разлагаются с измеримой скоростью и замедляют окислительно-восстановительные реакции.
Щавелевая кислота, насыщенный раствор. Перманганат калия, 0,01 н. раствор. Сульфат марганца, 20%-иый раствор.
Выполнение опыта. В цилиндр поместить 200 мл раствора перманганата калия и 200 мл воды. На лекции разделить раствор на две части. К первой части добавить раствор щавелевой кислоты. Цвет не меняется. Ко второй части добавить столько же щавелевой кислоты и 50 мл раствора сульфата марганца. Раствор буреет, затем желтеет и, наконец, полностью обесцвечивается. Отметить, что приблизительно через 1 ч раствор и в первом цилиндре также обесцвечивается.
Примечание. Для успеха лекционного опыта рекомендуется в раствор сульфата марганца добавить равный объем 18 н. раствора серной кислоты.
http://po-teme.com.ua/khimiya/okislitelno-vosstanovitelnoe-titrovanie/1172-standartizaciya-rastvora-permanganata-kaliya-po-shhavelevoj-kislote.html
http://www.himikatus.ru/art/demo-exp/0175.php