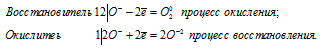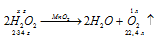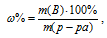Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
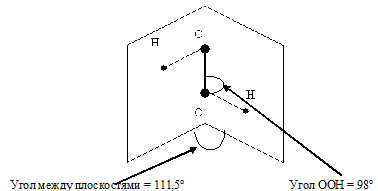
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e0fec653a7221b7 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
РАЗЛОЖЕНИЕ ПЕРОКСИДА ВОДОРОДА В РАЗБАВЛЕННЫХ ВОДНЫХ РАСТВОРАХ НА МЕМБРАНАХ С НАНЕСЁННЫМ КАТАЛИТИЧЕСКИ АКТИВНЫМ СЛОЕМ ДИОКСИДА МАРГАНЦА Текст научной статьи по специальности « Химические науки»
Аннотация научной статьи по химическим наукам, автор научной работы — Донина Мария Владимировна, Буйнова Елена Владимировна, Мотузенко Николай Дмитриевич, Яровая Оксана Викторовна
В данной работе было изучено разложение пероксида водорода на плоских керамических мембранах с нанесённым каталитически активным слоем наночастиц диоксида марганца . Рассмотрена зависимость каталитических свойств мембран от различных факторов.
Похожие темы научных работ по химическим наукам , автор научной работы — Донина Мария Владимировна, Буйнова Елена Владимировна, Мотузенко Николай Дмитриевич, Яровая Оксана Викторовна
DECOMPOSITION OF HYDROGEN PEROXIDE IN DILUTE AQUEOUS SOLUTIONS ON MEMBRANES WITH A CATALYTICALLY ACTIVE MANGANESE DIOXIDE LAYER
In this paper, the decomposition of hydrogen peroxide on flat ceramic membranes with a catalytic active layer of manganese dioxide nanoparticles was studied. The dependence of the catalytic properties of membranes on various factors is considered.
Текст научной работы на тему «РАЗЛОЖЕНИЕ ПЕРОКСИДА ВОДОРОДА В РАЗБАВЛЕННЫХ ВОДНЫХ РАСТВОРАХ НА МЕМБРАНАХ С НАНЕСЁННЫМ КАТАЛИТИЧЕСКИ АКТИВНЫМ СЛОЕМ ДИОКСИДА МАРГАНЦА»
Донина М.В., Буйнова Е.В., Мотузенко Н.Д., Яровая О.В.
РАЗЛОЖЕНИЕ ПЕРОКСИДА ВОДОРОДА В РАЗБАВЛЕННЫХ ВОДНЫХ РАСТВОРАХ НА МЕМБРАНАХ С НАНЕСЁННЫМ КАТАЛИТИЧЕСКИ АКТИВНЫМ СЛОЕМ ДИОКСИДА МАРГАНЦА
Донина Мария Владимировна, студентка 4 курса факультета биотехнологии и промышленной экологии, email: ethersv@vandex.ru;
Буйнова Елена Владимировна, студентка 3 курса факультета инженерной химии; Мотузенко Николай Дмитриевич, студент 3 курса факультета инженерной химии; Яровая Оксана Викторовна, к.х.н., доцент кафедры коллоидной химии.
В данной работе было изучено разложение пероксида водорода на плоских керамических мембранах с нанесённым каталитически активным слоем наночастиц диоксида марганца. Рассмотрена зависимость каталитических свойств мембран от различных факторов.
Ключевые слова: диоксид марганца, катализ, разложение пероксида водорода, /высокодисперсные частицы/.
DECOMPOSITION OF HYDROGEN PEROXIDE IN DILUTE AQUEOUS SOLUTIONS ON MEMBRANES WITH A CATALYTICALLY ACTIVE MANGANESE DIOXIDE LAYER
Donina M.V., Buynova E.V., Motuzenko N.D., Yarovaya O.V.
Mendeleev University of Chemical Technology of Russia, Moscow, Russia
In this paper, the decomposition of hydrogen peroxide on flat ceramic membranes with a catalytic active layer of manganese dioxide nanoparticles was studied. The dependence of the catalytic properties of membranes on various factors is considered.
Keywords: manganese dioxide, catalysis, decomposition of hydrogen peroxide, /fine particles/.
В настоящее время большое развитие в области очистки сточных вод получили мембранные технологии. Однако для эффективного проведения процесса необходимо соблюдать ряд требований. В частности, в настоящее время стадии отделения грубодисперсных примесей (микрофильтрация) и доочистка от растворенных соединений проводятся в различных аппаратах. Использование мембран с нанесенным каталитически активным слоем может позволить совместить эти стадии.
Особенности очистки сточных вод с применением микрофильтрационных мембран достаточно хорошо изучены, тогда как данные о проведении каталитических реакций при фильтрации жидкости через мембрану крайне отрывочны.
В качестве модельной реакции была выбрана реакция разложения пероксида водорода в разбавленных водных растворах в присутствии гетерогенного катализатора. Выбор данной реакции обусловлен тем, что кроме практической значимости она достаточно хорошо изучена [1]. Скорость данной реакции описывается уравнением первого порядка [2]. В качестве катализатора был предложен диоксид марганца. На кафедре коллоидной химии РХТУ им. Д.И. Менделеева были разработаны методики синтеза агрегативно устойчивых водных дисперсий наночастиц диоксида марганца (золей). В основе
метода получения лежит реакция взаимодействия перманганата калия с пероксидом водорода в водном растворе. Одним из основных условий синтеза золей является мольное соотношение реагентов [3], которое оказывает существенное влияние на агрегативную устойчивость наночастиц. Для получения мембран с нанесенными слоями диоксида марганца были использованы золи с соотношением [Н202]:[КМп04] от 4,5 до 7,0 моль/моль.
В качестве подложек использовали керамические микрофильтрационные мембраны диаметром 60 и толщиной 3 мм, полученные по технологии, разработанной на кафедре химической технологии керамики и огнеупоров РХТУ им. Д.И. Менделеева. Исходная шихта состояла из а-А1203 и глины Дружковского месторождения, конечная температура обжига составляла 1350 оС. Для повышения механической прочности так же были получены образцы подложек, где в качестве спекающей добавки использовали МпТЮз, что позволило снизить температуру обжига до 1100 оС. Все полученные подложки имели пористость около 45±3%, наивероятнейший радиус пор 0,8-0,9 мкм, максимальный радиус пор 2 мкм (в подложках имелись единичные дефекты радиусом до 3,5 мкм).
Реакцию разложения пероксида водорода проводили в проточном реакторе объемом 100 мл при комнатной температуре. Для оценки постоянства конверсии пероксида водорода пробы отбирали каждые 10 минут в течение 2 часов. Полученные данные усреднялись. Концентрация пероксида водорода определялась сразу после отбора фильтрата методом перманганатометрии
Поскольку в процессе нанесения в порах мембраны накапливается гидроксид калия, содержащийся в дисперсионной среде золей, было необходимо провести предварительную
подготовку мембран перед началом эксперимента. Было установлено, что полное удаление гидроксида калия из пор мембраны можно произвести двумя способами: либо при двукратном кипячении в течение 30 минут, либо при выдержке в дистиллированной воде при постоянном перемешивании в течение 50 минут.
Для оценки влияния мольного соотношения реагентов на каталитические свойства нанесенного слоя были использованы мембраны с содержанием диоксида марганца 18 г/м2. Начальная концентрация пероксида водорода составляла 0,25 моль/л. Предварительными экспериментами было показано, что при использовании подложки без нанесенного слоя в аналогичных условиях конверсия пероксида водорода не превышала 2%. В ходе испытаний было установлено, что при данных условиях конверсия пероксида водорода практически не зависит от мольного соотношения [Н202] :[КМп04] исходных золей, используемых для получения слоев, и составляет 99,4±0,5%.
Для оценки влияния массы катализатора на конверсию пероксида водорода в проточном реакторе были испытаны мембраны, содержащие 9 и 18 г/м2 диоксида марганца (использовали золь, синтезированный при мольном соотношении [Н202]:[КМп04] равном 7,0 моль/моль). Процесс проводили при комнатной температуре и объемной скорости раствора 0,4 мл/мин, начальная концентрация пероксида водорода составляла 0,25 моль/л. Было установлено, что при выбранных условиях наблюдалась конверсия пероксида водорода 99,4±0,1%.
Для подтверждения влияния массы катализатора на разложение пероксида водорода был сконструирован реактор периодического действия, позволяющий испытывать мембраны с нанесенным в качестве гетерогенного катализатора слоем диоксида марганца (схема, рис. 1).
Рис. 1. Принципиальная схема ячейки для проведения кинетического испытания мембраны.
1 — корпус; 2 — дно; 3 — крышка; 4 — штуцер; 5 — пробка;
6 — магнитный якорь; 7 — стержни для крепления; 8 -гайка; 9 — шайба; 10 — керамическая мембрана; 11 -прокладка
Для получения кинетических кривых в качестве измеряемого параметра был выбран объем кислорода, образовавшегося при разложении пероксида водорода. Волюмометрическая установка, позволяющая фиксировать объем газа до 100±0,05 мл подсоединялась к штуцеру 4. Концентрированный раствор пероксида водорода вносили в собранную ячейку, содержащую мембрану и необходимое количество воды, через отверстие в крышке, которое быстро закрывали пробкой 5. Объем раствора пероксида водорода составлял 100 мл, начальная концентрация пероксида водорода 0,082 моль/л. На рис. 2 в качестве примера приведены типичные кинетические кривые, начальные участки которых в дальнейшем обрабатывались в координатах уравнения первого порядка, константы скорости реакции при пересчёте на мг катализатора практически совпадают: 1,6 10-5 для мембраны с содержанием катализатора 9 г/м2 и 1,4 10-5 для мембраны с содержанием катализатора 18 г/м2.
Рис. 2. Типичные кинетические кривые выделения кислорода в ходе разложения пероксида водорода
На следующем этапе работы были проведены эксперименты по разложению пероксида водорода в растворах различной концентрации при постоянной объемной скорости (0,4 мл/мин). Было установлено, что при выбранных условиях в диапазоне начальных концентраций от 0,1 до 1,0 М конверсия пероксида водорода составляет 99,4±0,4%. С учетом того, что содержание пероксида водорода в сточных водах даже специфических предприятий не превышает нескольких массовых процентов, дальнейшее увеличение концентрации нецелесообразно. Для интенсификации процесса была сделана попытка увеличить объемную скорость подачи раствора пероксида водорода к каталитически активному слою. Основной проблемой при использовании данных дисковых керамических мембран оказалась их хрупкость при подаче избыточного давления. Для увеличения механической прочности были сделаны попытки введения спекающей добавки МпТЮ3 на стадии синтеза подложек. Содержание добавки не превышало 10% от массы подложки. Реакцию разложения пероксида водорода проводили в условиях, описанных ранее. Было показано, что при содержании добавки от 3 до 10% мас. конверсия пероксида водорода на подложках без нанесенного слоя составляет порядка 10%. Для проведения испытаний была выбрана мембрана, содержащая 10% спекающей добавки и 18 г/м2 диоксида марганца (использовали золь, синтезированный при мольном соотношении [Н202]:[КМп04] равном 7,0 моль/моль). Процесс проводили при комнатной температуре и объемной скорости раствора 0,4 мл/мин, начальная концентрация пероксида водорода составляла 0,25 моль/л. Было показано, что при проведении эксперимента в течение 6,5 часов конверсия пероксида водорода поддерживалась постоянной и составляла 99,7±0,2%.
Таким образом, в ходе работы были получены керамические дисковые мембраны с нанесенным
слоем диоксида марганца, который проявляет каталитическую активность в реакции жидкофазного окисления пероксида водорода в водных растворах. Полученные мембраны были испытаны как в реакторе периодического действия, так и в проточном реакторе. Показано, что в выбранных условиях наблюдается практически полное разложение пероксида водорода. Рассчитана константа скорости реакции, которая в пересчете на 1 мг катализатора составила (1,5±0,1)10-5 с-1.
Работа выполнена при финансовой поддержке РХТУ им. Д.И. Менделеева. Номер проекта 0462018.
1. Гайфуллин А. А. и др. Влияние примесей на разложение пероксида водорода в среде сточных вод //Вестник Казанского технологического университета. — 2011. — №. 15.
2. Вершаль В. В. и др. Исследование разложения пероксида водорода в щелочной среде и его влияние на отбелку лигноцеллюлозы и гомогенное окисление лигнина //Химия растительного сырья. — 1998. — №. 1.
3. Бондарева Г.М., Люлина А.А., Вержичинская С.В., Яровая О.В., Яремчук М.С. Применение наночастиц Со304 и MnO2 для получения каталитически активных слоев на поверхности плоских керамических мембран. //Химическая технология функциональных наноматериалов: Сб. Матер. Междунар. конф. со школой и мастер-классами для мол. ученых. — М.:РХТУ им. Д.И. Менделеева, 2017. — С. 297 — 299.
Домина Н.Г., Зуйкова С.А., Хлебников А.И., Чемери с Н.А. Аналитическая химия. Химические методы анализа. Барнаул: Типография АлтГТУ, 2010. — 176 с.
http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/lab/9.html
http://cyberleninka.ru/article/n/razlozhenie-peroksida-vodoroda-v-razbavlennyh-vodnyh-rastvorah-na-membranah-s-nanesyonnym-kataliticheski-aktivnym-sloem-dioksida