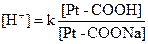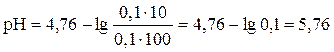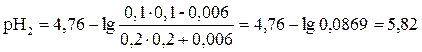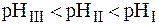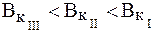Расчет рН буферного раствора
Расчета рН буферных растворов осуществляется по уравнению Гендерсона – Гассельбаха:
– для кислотного буфера уравнение имеет вид

– для основного буфера
Уравнения показывают, что рН буферного раствора данного состава определяется отношением концентраций кислоты и соли или основания и соли, поэтому не зависит от разбавления. При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз.
Буферная емкость
Способность буферных растворов сохранять постоянство рН ограничена. Т.е. прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в ограниченных количествах.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочи, называют буферной ёмкостью раствора (В).
Буферная ёмкость измеряется количеством молей эквивалентов сильной кислоты или щелочи, добавление которой к 1 л буферного раствора изменяет рН на единицу.
Математически буферная ёмкость определяется следующим образом:
В по кислоте (моль/л ил ммоль/л):

где n(1/z HA) – количество моль эквивалентов кислоты, рН0 и рН – рН буферного раствора до и после добавления кислоты, VБ – объем буферного раствора.
В по щелочи (моль/л или ммоль/л):

где n (1/z ВОН) – количество моль эквивалентов щелочи, остальные обозначения те же.
Буферная ёмкость зависит от ряда факторов:
1. От природы добавляемых веществ и компонентов буферного раствора. Т.к. некоторые вещества могут образовывать нерастворимые соединения или комплексы или давать другие нежелательные реакции с компонентами буферной системы, тогда понятие буферной ёмкости теряет смысл.
2. От исходной концентрации компонентов буферной системы.
Чем больше количества компонентов кислотно-основной пары в растворе, тем больше буферная ёмкость этого раствора.
Предел соотношения концентраций компонентов буферного раствора, при котором система все еще сохраняет свои свойства. Интервал рН = рК ± 1, называется зоной буферного действия системы. Это соответствует интервалу соотношения Ссоли/Ск-ты от 1/10 до 10/1.
Вк (крови) = 0,05моль/л; Вк (плазмы) = 0,03 моль/л; Вк (сыв.крови) = 0,025 моль/л
Буферные системы крови
Особенно большое значение буферные системы имеют в поддержании кислотно-основного равновесия организмов. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8.
Кислотно – основное равновесие в крови человека обеспечивается гидрокарбонатной, фосфатной, белковой и гемоглобиновой буферными системами. Нормальное значение рН плазмы крови 7,40 ± 0,05.
Гемоглобиновая буфернаясистемана 35% обеспечивает буферную емкость крови: 
Карбонатная буферная система: 
Фосфатная буферная система 
Белковая буферная системаосуществляет роль нейтрализации кислот и щелочей благодаря амфотерным свойствам: в кислой среде белки плазмы ведут себя как основания, в основной – как кислоты:
Буферные системы имеются и в тканях, что способствует поддержанию рН тканей на относительно постоянном уровне. Главными буферами тканей являются белки и фосфаты. Поддержание рН осуществляется также с помощью легких и почек. Через легкие удаляется избыток углекислоты. Почки при ацидозе выделяют больше кислого одноосновного фосфата натрия, а при алкалозе – больше щелочных солей: двухосновного фосфата натрия и бикарбоната натрия.
Примеры решения задач
Пример 1.
Рассчитать рН буферного раствора, приготовленного смешением 10 мл 0,1М раствора уксусной кислоты и 100 мл 0,1М раствора ацетата натрия (рК(сн3 соон) =4,76).
Рассчитываем рН кислотного буферного раствора по формуле 
Пример 2.
Рассчитать буферную емкость по кислоте, если на титрование 10 мл сыворотки крови пошло 5 мл 0,1 моль/л соляной кислоты, если при титровании рН изменился от 7,36 до 5,0.
Рассчитываем буферную емкость по формуле:
Ответ: 0,021 моль/л
Пример 3.
Буферный раствор состоит из 100 мл 0,1моль/л уксусной кислоты и 200 мл 0,2моль/л ацетата натрия. Как изменится рН этого раствора, если к ней добавить 30 мл 0,2моль/л раствора гидроксида натрия.
Рассчитываем рН буферного раствора по формуле:
При добавлении к буферному раствору NaOH увеличивается количество соли и уменьшается количество кислоты в буферном растворе:
Рассчитываем n(NaOH) = 0,03 л · 0,2 моль/л = 0,006 моль, следовательно в буферном растворе количество кислоты уменьшается на 0,006 моль, а количество соли увеличится на 0,006 моль.
Рассчитываем рН раствора по формуле:
Отсюда: рН2 – рН1 = 5,82 – 5,3 = 0,52
Ответ: изменение рН буферного раствора = 0,52.
Задачи для самостоятельного решения
1. Рассчитать рН буферного раствора, приготовленного смешением 100 мл 0,1М раствора дигидрофосфата натрия и 10 мл 0,1М раствора гидрофосфата натрия (рК(Н2РО4 — ) = 7,21).
2. Рассчитать молярную концентрацию уксусной кислоты, если на приготовление ацетатного буфера с рН= 5,76 к 100 мл 0,1М раствора ацетата натрия прилили 10 мл уксусной кислоты (рК(сн3 соон) =4,76).
3. Рассчитать Рн желудочного сока, если концентрация НС1 0,365%, плотность 1г/мл.
4. На титрование 2 мл крови для изменения рН от начального значения (7,36) до конечного значения (7,0) потребовалось добавить 1,6 мл 0,01 М раствора HCl. Рассчитайте буферную емкость по кислоте.
5. Сколько моль ацетата натрия необходимо добавить к 300 мл уксусной кислоты, чтобы понизить концентрацию ионов водорода в 300 раз (Кдис (сн3 соон) = 1,85.10 -5 ).
6. При биохимических исследованиях используют фосфатный буфер с рН= 7,4. В каком соотношении надо смешать растворы гидрофосфата натрия и дигидрофосфата натрия с концентрацией по 0,1 моль/л каждый, чтобы получить такой буферный раствор (рК(Н2РО4 — ) = 7,4).
7. Какие нарушения КОС наблюдаются при следующих показателях: рН крови = 7,20, Рсо2 = 38 мм рт. ст., БО = 30 ммоль/л, СБО = -4 ммоль/л. Как устранить данное нарушение КОС?
8. Рассчитать Рн ацетатного буферного раствора, состоящего из 60 мл 0,2М раствора уксусной кислоты и 120 мл 0,01М раствора ацетата натрия при рК(сн3соон) = 4,76.
9. Рассчитать рН 0,01М раствора уксусной кислоты, если степень диссоциации кислоты равна 0,1.
10. Рассчитать объем 5% раствора гидрокарбоната натрия, необходимого для коррекции метаболического ацидоза, если сдвиг буферных оснований (ВЕ) составляет — 10 ммоль/л при массе больного 68 кг.
РН буферных растворов.
Для буферной системы I типа НА/A — концентрацию ионов Н + в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для 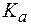
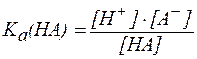 , , |
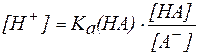 . . |
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A — равна концентрации соли.
В таком случае можно записать:
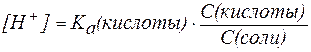 , , | (3) |
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:
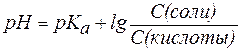 . . | (4) |
Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
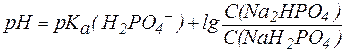 , , |
где 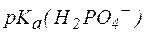
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение:
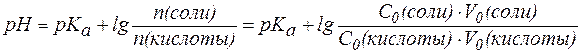 , , | (5) |
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН + , например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
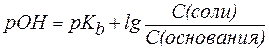 , , | (6) |
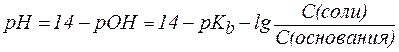 , , | (6¢) |
где 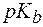
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
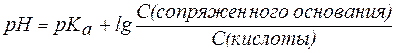 , , | (7) |
и называется уравнениемГендерсона-Гассельбаха.
Из уравнения Гендерсона-Гассельбаха следует, что:
1. Величина рН буферных растворов зависит от константы диссоциации кислоты или основания и от соотношения количеств компонентов, но практически не зависит от разбавления или концент-рирования растворов. Действительно, в этих процессах концентрации компонентов буферного раствора изменяются пропорционально, поэтому их соотношение, которое определяет значение рН буферного раствора, остается неизменным.
Если концентрации компонентов буферных растворов превы-шают 0,1 моль/л, то в расчетах необходимо учитывать коэффициенты активности ионов системы.
2. Показатель константы диссоциации слабого электролита опре-деляет область буферного действия раствора, т.е. тот интервал значе-ний водородного показателя, в котором сохраняются буферные свой-ства системы. Поскольку буферное действие продолжается, пока не израсходовано 90% компонента (т.е. его концентрация не уменьши-лась на порядок), то область (зона) буферного действия отличается от 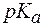
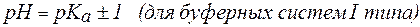
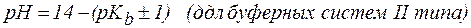
Амфолиты могут иметь несколько зон буферного действия, каждая из которых отвечает соответствующей константе 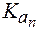
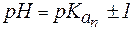
Таким образом, максимально допустимое соотношение компонентов раствора, при котором он проявляет буферное действие, составляет 10:1.
Пример 1. Можно ли приготовить ацетатный буфер с рН = 6,5, если 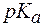
Поскольку зона буферного действия определяется как 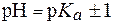
Буферная емкость.
Прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в относительно небольших коли-чествах, так как способность буферных растворов сохранять постоян-ство рН ограничена.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью (В).Различают буферную емкость по кислоте ( 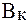
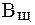
Буферная емкость (В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
На практике буферную емкость определяют титрованием. Для этого определенный объем буферного раствора титруют сильной кислотой или щелочью известной концентрации до достижения точки эквивалентности. Титрование проводят в присутствии кислотно-основных индикаторов, при правильном выборе которых фиксируют состояние, когда компонент буферной системы прореагирует полностью. По полученным результатам рассчитывают величину буферной емкости ( 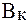
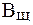
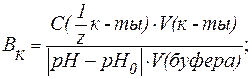 | (8) |
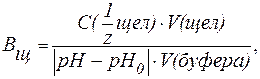 | (9) |
где С( 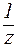
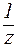
V(к-ты ), V(щел) — объемы добавленных растворов кислоты или щелочи (л; мл);
V(буфера) — объем буферного раствора (л; мл);
pH0 и pH — значения рН буферного раствора до и после титрования кислотой или щелочью (изменение рН берется по абсолютной величине).
Буферную емкость выражают в [моль/л] или в [ммоль/л].
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буфер-ного раствора.
Буферная емкость зависит от соотношения количеств компо-нентов буферного раствора, а следовательно, и от рН буфера. Буфер-ная емкость максимальна при равных количествах компонентов бу-ферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются. Так, в буферном растворе I типа чем больше содержание кислоты, тем больше буферная емкость по щелочи, а чем больше содержание соли, тем больше буферная емкость по кислоте. В буферном растворе II типа чем больше содержание соли, тем больше буферная емкость по щелочи, а чем больше содержание основания, тем больше буферная емкость по кислоте.
Пример 2. Для приготовления ацетатных буферных смесей растворы кислоты и соли одинаковой молярной концентрации были смешаны в следующих объемных соотношениях:
| Состав буферной системы | Объемные соотношения компонентов буферной системы | |
| раствор I | раствор II | раствор III |
| CH3COOH | ||
| CH3COONa |
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться:
а) наибольшее значение рН;
б) максимальная буферная емкость;
в) наибольшая буферная емкость по кислоте.
В случае равных концентраций компонентов уравнение (5) принимает вид:
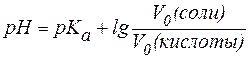
Так как 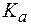
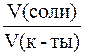
Максимальной буферной емкостью характеризуется II раствор, так как в нем соотношение количеств компонентов составляет 1:1.
Буферная емкость по кислоте для ацетатного буфера определя-ется содержанием сопряженного основания, т.е. соли: чем оно больше, тем больше буферная емкость раствора по кислоте. Поэтому:
Таким образом, наибольшую емкость по кислоте будет иметь I раствор.
Рассчеты, связанные с приготовлением буферных растворов
Вычисление буферной емкости по кислоте
Задача 51.
Какова буферная емкость по кислоте, если прибавление к 80 мл буферного раствора 30 мл 0,1 М раствора HCl вызвало изменение pH на единицу?
Решение:
Буферная емкость (buffer capacity) ß – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу. Буферную емкость рассчитывают по уравнению:
ß = n/(z • V • ∆pH)
HCl — кислота одноосновная, поэтому z = 1:
n(HCl) = CV = 0,030 • 0,1 = 0,003 моль;
V(буфера) = 0,08 л
ß = 0,003/(1 • 0.08 • 1) = 0,0375 моль/л.
Ответ: ß = 0,0375 моль-экв/л.
Вычисление рН буферного раствора
Задача 52.
Вычислите рН раствора, полученного при смешивании 29 см 3 6,2 Н. раствора уксусной кислоты и 1 см 3 2,0 Н. раствора ацетата натрия.
Решение:
Получается буферный раствор — смесь слабой кислоты и ее соли (анионов слабой кислоты):
рН = рКа + lg[CM(соли)/CM(кислоты)];
CM = СH/z, где z — число эквивалентности.
Для кислоты z равно основности, для соли — числу катионов или анионов, умноженному на заряд соответствующего иона.
Уксусная кислота — одноосновная, поэтому z = 1.
В формуле ацетата натрия имеется по 1 иону с единичным зарядом, поэтому z = 1.
Соответственно, для обоих веществ СН = СМ.
При смешивании раствора получен буферный раствор объемом 29 + 1 = 30 мл = 0,03 л.
Ответ: рН = 6,71.
Расчет количества (моль) одноосновной кислоты
Задача 53.
Какое количество (моль) одноосновной кислоты необходимо ввести больному с рН крови 7,6 объемом 4л и буферной емкостью по кислоте 0,06 моль/л для нормализации рН крови?
Решение:
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40. Рассчет будем производить по формуле:
ß = n/(z • V • ∆pH), где
ß — буферная емкость, n — количество вещества кислоты или соли, z — основность кислоты, V — объем раствора, ∆pH — изменене системы.
ß = 0,06 моль/л;
z = 1, потому что кислота одноосновная;
∆pH = (7,6 — 7,4) = 0,2;
V = 4л.
Рассчитаем количество (моль) одноосновной кислоты, получим:
ß = n/(z • V • ∆pH);
n(кислоты) = ß • (z • V • ∆pH) = 0,06 моль/л • (1 • 4 л •0,2) = 0,048 моль.
Ответ: n(кислоты) = 0,048 моль.
http://helpiks.org/6-25734.html
http://buzani.ru/zadachi/obshchaya-khimiya/1578-bufernye-rastvory-zadachi-51-53