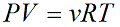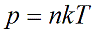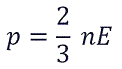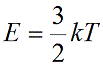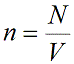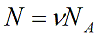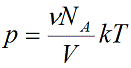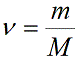План-конспект открытого урока «Уравнение Менделеева-Клапейрона»
При проведении урока используются активные формы и методы работы
Просмотр содержимого документа
«План-конспект открытого урока «Уравнение Менделеева-Клапейрона»»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
УПРАВЛЕНИЕ ОБРАЗОВАНИЯ ВОСТОЧНО-КАЗАХСТАНСКОГО ОБЛАСТНОГО АКИМАТА
КГУ «ИНДУСТРИАЛЬНО-ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ»
Методическая разработка открытого урока
тема: «Уравнение Менделеева-Клапейрона»
Специальность: 1201000 «Техническое обслуживание, ремонт и эксплуатация автомобильного транспорта»
Квалификация: 1201072 «Слесарь по ремонту автомобилей»
Преподаватель: Тихоненко С.А.
Рассмотрено на заседании ПЦК Согласовано
Общеобразовательных дисциплин Председатель УМО преподавателей
Протокол №2 от 9 сентября 2019 г физики и математики
Председатель ПЦК ООД _____________ Сапаргалиева Г.С.
____________ Тихоненко С.А. «_____» октября 2019 г.
Внедрение инновационных технологий, сотрудничество, сотворчество обеспечивает возможность усвоения системы научных понятий, которая позволяет учащимся стать реальными субъектами учения. Технологии активных форм обучения, КМ, ИКТ используются, чтобы организовать и поддерживать учебную активность учащихся. Обучение учащихся выбору, поиску наиболее рационального способа решения, не навязывая единственный путь, по которому им следует идти, создание комфортных условий для сравнительно самостоятельного разрешения учащимися проблем являются прочной основой для формирования у них интеллектуальных навыков, творческого мышления.
Урок направлен на реализацию требований нового стандарта и концепции личностно-ориентированного обучения, на обеспечение формирования важнейшей компетенции личности – умения учиться. Учебный процесс на занятии организуется так, что в групповой работе, в процессе самостоятельной познавательной деятельности, организованной учителем, учащиеся овладевают системой знаний и умений, востребованных в повседневной жизни. Они измеряют физические величины, проводят опыты и экспериментальные исследования, создают знаковые и математические модели, применяют физические знания на практике.
Данный урок нацелен на развитие работы учащихся в команде и индивидуально, призван расширить мировоззрение студентов в области молекулярной физики посредствам применения новых информационных технологий, развивать умения и навыки выделять главное, обобщать знания по предмету, формировать компетентность и информационную культуру учащихся, активизировать внимание и познавательный интерес к предмету.
Опорными знаниями являются: Уравнение Клапейрона-Менделеева, формулы для вычисления объема, плотности и числа молекул.
Были обеспечены условия для создания ситуации успеха для каждого учащегося.
Ожидаемые результаты. После изучения данной темы учащиеся должны: знать уравнение Клапейрона-Менделеева; понимать смысл и его всеобщий характер; уметь применять уравнение в конкретных случаях при решении задач и тестировании; вычислять давление, массу газа, объем, температуру; знать числовое значение универсальной газовой постоянной; уметь вычислять массу газа и число молекул в нем.
Критерии оценки. Используется рейтинговая система оценки с автоматическим переводом баллов в отметки по 5-ти бальной системе.
Возможность развития. Продолжением этих уроков может быть урок решения задач «Уравнение Клапейрона — Менделеева» с использованием среды MS Excel для моделирования задач и проведения расчётов с составлением формул.
Тема урока: Уравнение Менделеева-Клапейрона.
Показать математическую зависимость между тремя макроскопическими параметрами p,V,T. Учить применять физические законы при решении задач. Научить применять полученные знания как язык науки, имеющий огромные возможности.
Формировать умение выделять главное, обобщать и связывать имеющиеся знания со знаниями из других областей.
Дать возможность почувствовать свой потенциал каждому учащемуся, чтобы показать значимость полученных знаний. Побудить к активной работе мысли. Развивать кругозор учащихся
Тип урока: комбинированный
Методы обучения: репродуктивный, учебно-познавательная деятельность учащихся, применение технологии сотрудничества и интегрированного обучения.
Форма проведения урока: групповая работа, индивидуальная работа.
СОТ: Развитие критического мышления, ИКТ.
Оборудование: компьютер, интерактивная доска, презентация, доска для записи формул, раздаточный материал.
Орг.момент – 3 мин.
Проверка домашнего задания – кластер 7 мин.
Объяснение новой темы – 20 мин.
Историческая справка о Д.И. Менделееве и Б. Клапейроне.
Работа с текстом – метод помет.
Закрепление. Кубик Блума — 5 мин.
Домашнее задание. – 2 мин.
Итог урока – 3 мин.
1. Организационный момент:
Приветствие учащихся, проверка готовности группы к уроку, наличие необходимых принадлежностей. Постановка целей и задач урока. Дерево ожиданий.
2.Проверка домашнего задания.
Создание кластера по группам:
Основное уравнение МКТ.
Основные положения МКТ.
3.Объяснение новой темы.
Историческая справка о Д.И. Менделееве и Б. Клапейроне – сообщение учащихся (опережающее задание).
Просмотр видеофрагмента «Связь между давлением, объёмом и температурой».
Работа с текстом. Метод помет.
Уравнение состояния идеального газа Менделеева-Клапейрона с выводом
Уравнение состояния идеального газа показывает корреляцию его основных макропараметров, а именно: объема V, давления P, а также температуры T.
ν — количество вещества [моль]
R – универсальная газовая постоянная, 8,31 [Дж/(моль · К)]
T – температура [K]
Данную формулу также называют уравнением Менделеева-Клапейрона для идеального газа в честь двух ученых впервые получившего (Бенуа Клапейрон (1799 – 1864)) и применившего (Дмитрий Иванович Менделеев (1834 – 1907)) его.
Вывод уравнения Менделеева-Клапейрона
Давление идеального газа зависит от концентрации частиц и температуры тела:
n — концентрация частиц [м -3 ]
k – константа Больцмана k = 1,38 · 10 -23 [Дж/К]
Т – абсолютная температура, в кельвинах [К]
Возьмем основное уравнение МКТ, выведенное через кинетическую энергию:
Подставим nkT вместо давления и выразим кинетическую энергию:
Концентрация частиц газа n равна:
N – число молекул газа в емкости объемом V [м 3 ]. N также можно представить как произведение количества вещества ν и числа Авогадро NA:
Подставим эти величины в уравнение давления идеального газа (p=nkT):
Произведение числа Авогадро NA и константы Больцмана k дает универсальную газовую постоянную R, которая равна 8,31 [Дж/(моль · К)].

Учитывая, что количество вещества ν также можно определить, если известны масса вещества m и его молярная масса M:
можно привести уравнение к следующему виду:
Частными случаями уравнения являются газовые законы, описывающие изопроцессы в идеальных газах, т.е. процессы, при которых один из макропараметров (T, P, V) в закрытой изолированной системе постоянный. Всего этих частных случаев 3.
О них мы будем говорить на следующем уроке.
Закрепление. Кубик Блума.
Выразить из уравнения Менделеева-Клапейрона следующий параметр:
Давление, объём, температура, масса, молярная масса, количество вещества.
Домашнее задание. Решение задач.
Работа по таблице «Определение недостающих величин»
В таблице приведены значения некоторых параметров состояния газа.
Определить недостающие параметры.
Конспект урока по физике на тему «Уравнение Клапейрона-Менделеева» (10 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.


Цель: вывести зависимость между тремя макроскопическими параметрами p , V , T .
– ознакомление с уравнением Менделеева – Клапейрона;
– применение полученных знаний при решении задач.
– формирование умения сравнивать, обобщать имеющиеся знания, анализировать;
– развивать логическое мышление обучающихся,
– развивать навыки самообразования.
– воспитывать самостоятельность, творческий подход, умение формулировать, формировать интерес к изучаемому предмету;
– находить решение проблемных ситуаций.
Оборудование: поурочные карты, тесты, компьютер, мультимедийный проектор, презентация PowerPoint .
Оглавление
Мотивация
Проверка домашнего задания
Сначала немного проверим ваши знания. Перед вами тесты. (Приложение 1) Вы должны за 5 минут ответить на предложенные вопросы. Сдать на проверку задания.
Назовите основную величину в теории тепловых явлений. ( температура)
Первый прообраз термометра демонстрировал … (Галилей, в 1592г.)
Назовите постоянные точки на шкале Фаренгейта и шкале Цельсия. (0 0 F — смесь льда и соли, 100 0 F — нормальная температура человека, 0 0 С- таяние льда, 100 0 С-кипение воды)
Кто ввел абсолютную шкалу температур? ( Кельвин)
Какой формулой связана абсолютная температура с температурой по шкале Цельсия? ( n 0 C = ( n – 273) 0 K = (1,8 n + 32) 0 F )
(слайд 3) Что является объектом изучения МКТ? (Идеальный газ)
Что в МКТ называется идеальным газом? (Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь.)
Вспомните уравнение зависимости p от концентрации и температуры. ( p = nkT )
Как определить концентрацию молекул? ( 
Какая формула позволяет вычислить число молекул N ? ( 
Чему равна постоянная Больцмана? ( k = 1.38 · 10 -23 Дж/К)
Какие три термодинамических параметра используют для того, чтобы описать состояние идеального газа? (Давление, объем и температура.)
Какое уравнение связывает между собой все три термодинамических параметра? (Уравнение состояния идеального газа)
Это мы узнаем сегодня на уроке
Изучение нового материала
Уравнение состояния идеального газа – это уравнение, связывающее макроскопические параметры состояния газа ( p , V , T ).
Как Вы считаете, какая основная задача стоит перед нами на уроке?
(Вывести закон, который связывает между собой макроскопические параметры)
Уверена, что Вы справитесь. Помогут Вам рабочие листы и план исследования .
Обучающиеся заполняют рабочие листы (Приложение 3)
На 5 слайде появляется пошаговое решение.
Запишите формулу зависимости давления газа от концентрации и температуры ( p = nkT );
В это уравнение поставьте значение концентрации 

Перенесите все макропараметры влево 
(гиперссылка 1, слайд 14) Это уравнение было открыто Клапейроном в 1834 г. Оно оказалось неудобным для практического применения, т.к. N – неизмеряемая величина
Запишите формулу для числа частиц 
(гиперссылка 2, слайд 15) (1874 год, Д.И. Менделеев вывел уравнение для произвольного числа молекул) )
В правой части произведение N A и k назвали универсальной газовой постоянной и обозначили R . (Вычислите значение R и выведите единицу измерения R ) N A · k = R = 8.31 Дж/(моль·К)
Подставьте R в предыдущую формулу, оставьте в левой части только p и V . Получим 
Сформулируйте уравнение состояния идеального газа. (Приложение 4)
Проанализируем это уравнение:
Какая единственная в этом уравнении величина, зависящая от рода газа? (М – молярная масса)
На какие вопросы уравнение состояния идеального газа позволяет ответить? (слайд 6)
Можно определить одну из величин, характеризующих состояние, например температуру, если известны две другие. Это используют в термометрах. (c лайд 7)
Зная уравнение, можно сказать, как будут протекать в системе различные процессы при определенных условиях, т.е. при изменениях одного из параметров. (слайд 8)
Можно определить, как меняется состояние системы, если она совершает работу, или получает теплоту от окружающих тел. (слайд 9)
Первичное закрепление материала .
— C какой новой величиной Вы сегодня познакомились? (Универсальная газовая постоянная)
— Что называют нормальными условиями? ( t = 0 0 C , p = 101325 Па)
Решение задач у доски с помощью учителя.
Найдите массу воздуха в кабинете, где вы занимаетесь при температуре 20 0 С и нормальном атмосферном давлении. Молярная масса воздуха равна 0,029 кг/моль.
Плотность некоторого газообразного вещества равна 2,5 кг/м 3 при температуре 10 0 С и нормальном атмосферном давлении. Найдите молярную массу этого вещества.
Домашнее задание (слайд 12)
§70, упр.13(5,6) ( Г.Я. Мякишев, Б.Б.Буховцев, Физика 10) (Приложение 6)
Рефлексия
Ребята, как Вы считаете, достигли мы цели урока?
(Да, вывели закон, устанавливающий зависимость между макропараметрами)
Завершить нашу работу мне бы хотелось словами из строк Б.Пастернака: (слайд 13)
Урок по теме: «Уравнение Менделеева-Клапейрона»
методическая разработка по физике (10 класс) по теме
Тезисы работы_Емелюковой.doc:
Урок по теме: «Уравнение Менделеева-Клапейрона»
Тип урока: Комбинированный урок с использованием современных информационных технологий, метода проектов.
Цель урока: Познакомить учащихся с понятием уравнения состояния идеального газа. Рассмотреть физический смысл универсальной газовой постоянной.
1. Обучающие задачи: учащиеся находят общую зависимость (формулу), связывающую между собой все три макроскопические величины (p, V, T);
Знакомятся с универсальной газовой постоянной.
2. Развивающие задачи: учащиеся развивают активную мыслительную деятельность, волю, память, интеллект через задания исследовательского и поискового характера; повышают уровень активности, самостоятельности и качества знаний, используя знания при решении практических задач.
3. Воспитывающие задачи: учащиеся знакомятся с работой учёных в развитии физики; повышают умение слушать и говорить перед незнакомой аудиторией; рассматривают практическую значимость приобретённых знаний; формулируют мотивацию учения.
План урока:
- Этап. Организация начала урока.
- Этап. Проверка выполнения домашнего задания.
- Этап. Подготовка к активной У.П.Д. на основном этапе урока.
- Этап. Усвоение новых знаний.
5. Этап. Первичная проверка понимания учащимися нового учебного материала. 6. Этап. Закрепление знаний.
7 Этап. Подведение итогов урока.
Рекомендации: При просмотре плана урока необходимо обратить внимание на выделенные синим цветом ключевые слова ( при нажатии на них мы имеем связь с гиперссылкой на презентацию или приложение к данной части урока).
Выводы по уроку:
- Проведено углубление и расширение учебного материала, учащиеся ознакомлены с новыми сведениями за счёт обращения к разным источникам информации. Проведено обобщение вместе с учащимися по эффективности использования метода проектов на уроке.
- Показана роль физики в изучении природы. Выполнены упражнения на применение знаний об уравнении состояния идеального газа при решении задач.
- Был показан вклад учёных в исследовании общей зависимости (формулы), связывающей между собой три макроскопические величины(p, V, T) и развитии физики.
- Были использованы нестандартные ситуации в применении проверяемых знаний.
- Цель урока достигнута за счёт использования современных информационных технологий.
Скачать:
| Вложение | Размер |
|---|---|
| statya_emelyukovoy.doc.doc | 104.5 КБ |
| prilozhenie_1_emelyukovoy.doc_urok_uravnenie_mendeleeva-klapeyrona.ppt | 952 КБ |
| prilozhenie_3_emelyukovoy.doc_skhema_po_formulam-10_klass.doc | 519.25 КБ |
| prilozhenie_4_emelyukovoy.doc_uravnenie_mendeleeva-klapeyrona.doc | 20 КБ |
| prilozhenie_5_emelyukovoy.doc_fizicheskiy_smysl_universalnoy_gazovoy_postoyannoy.doc | 124 КБ |
| prilozhenie_6_emelyukovoy.doc_zadachi_po_teme_uravneniya_sostoyaniya_idealnogo_gaza.doc | 26 КБ |
| prilozhenie_7_emelyukovoy.doc_zadachi.doc | 46 КБ |
Предварительный просмотр:
Урок по теме: «Уравнение Менделеева-Клаперона»
Тип урока: Комбинированный урок с использованием современных информационных технологий, метода проектов .
Цель урока: Познакомить учащихся с понятием уравнения состояния идеального газа. Рассмотреть физический смысл универсальной газовой постоянной.
1 . Обучающие задачи: учащиеся находят общую зависимость (формулу), связывающую между собой все три макроскопические величины ( p, V, T);
Знакомятся с универсальной газовой постоянной.
2. Развивающие задачи : учащиеся развивают активную мыслительную деятельность, волю, память, интеллект через задания исследовательского и поискового характера; повышают уровень активности, самостоятельности и качества знаний, используя знания при решении практических задач.
3. Воспитывающие задачи: учащиеся знакомятся с работой учёных в развитии физики; повышают умение слушать и говорить перед незнакомой аудиторией; рассматривают практическую значимость приобретённых знаний; формулируют мотивацию учения.
I этап : Приветствие учащихся (учитель отмечает отсутствующих, готовность к уроку)
II этап: (на экране слайды, презентации):
- Тема урока: «Уравнение Менделеева-Клапейрона»
- Цель урока.
- Задачи урока.
- домашнее задание: параграф 52, задачи №2,4 с листа. Образец вклеить в тетрадь.
Учащиеся записывают в дневник.
Учитель: для того, чтобы познакомиться с выводом Уравнения М-К, нам необходимо вспомнить понятия, формулы, изученные на предыдущих уроках.
- Назовите основные положения МКТ.
- Доказательством, какого положения МКТ служит явление, показанное в фильме? ( Видеофильм 2мин (см. приложение № 2), ответ: второго) А ещё?
- Как можно доказать первое положение МКТ? Третье положение МКТ?
Учитель открывает левую часть доски сзади:
7 человек выходят по очереди к доске.
- Как называется данная физическая величина?
- В каких единицах она измеряется?
Учитель: Мы с вами повторили все физические величины и их единицы измерения, теперь я хочу обратить ваше внимание на схему на доске (см. приложение № 3 ).
IV этап: Учитель устно задаёт вопросы и на правой части доски с помощью магнитов вывешивает схему (см. приложение № 4):
- Какие три макроскопические параметра вы знаете? (ответ: P, V, T)
- Почему их назвали макроскопическими? (ответ: Эти параметры характеризуют большие масштабы)
- Назовите единицы измерения каждой из этих величин.(ответ: 1Па, 1м 3 , 1К)
Учитель перед классом ставит проблему – найти общую зависимость (формулу), связывающую между собой три макроскопические величины.
Учитель: Нам известны три формулы, которыми мы пользуемся:
p =n k T; n=N/V; N=m/M*Na
Учитель начинает вывод сам на основной доске:
p =N/V* k *T=1/V*m/M*Na* k *T
Далее: Мы видим произведение двух постоянных величин в физике.
Учитель переходит на левую переднюю часть доски, делает вывод универсальной газовой постоянной( вывешивает на магнитах листы):
Na=6, 02*10 23 моль -1
k =1, 38*10 -23 Дж/ k
- Как называются данные постоянные величины? (Постоянная Авогадро, постоянная Больцмана)
- Каков физический смысл постоянной Авогадро? (физический смысл постоянной Авогадро-число атомов (или молекул), содержащихся в 1 моле любого вещества)
- Каков физический смысл постоянная Больцмана? (физический смысл постоянной Больцмана — является коэффициентом, переводящим температуру из градусной меры ( k) в энергетическую (Дж) и обратно)
Учитель: В физике произведение двух постоянных величин заменяют универсальной газовой постоянной и её обозначают:
На доске : R (эр)-универсальная газовая постоянная.
Давайте найдём её числовое значение:
R=Na*k=6, 02*10 23 моль -1 * 1, 38*10 -23 Дж/k = 8, 31*10 23 *10 -23 1/моль * Дж/k=8, 31 Дж/моль*k
учитель вывешивает на правую часть доски
Рассмотрим её физический смысл:
Характеризует внутреннюю энергию моля идеального газа в расчёте на один Кельвин.
Учитель снова возвращается на основную доску и завершает вывод Уравнение Менделеева-Клапейрона
Учитель:
это и есть уравнение Менделеева-Клапейрона, его ещё называют уравнением состояния идеального газа.
Клапейрон — французский физик, работавший около 10 лет в России.
Менделеев — великий русский учёный.
Учитель : Какой газ называют идеальным ? (ответ: идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало)
Учитель: Не только идеальный газ, но и любая реальная система – газ, жидкость, твёрдое тело – характеризуется своим уравнением состояния.
Знать уравнение состояния необходимо при исследовании тепловых явлений.
Что оно позволяет определить? Предоставляю слово докладчику.
Учащийся с докладом:
- одну из физических величин, если две другие известны (это используют в терминах)
- зная уравнение состояния, можно сказать, как протекают в системе в различные процессы при определённых внешних условиях.
- зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
Например: учитель демонстрирует опыт с колоколом воздушного насоса (шарик):
Опыт: меняем p, изменяется V, при T=Const
Учитель: Я предоставляю слово учащемуся:
Демонстрация опыта: шарик с водой, двухлитровая банка, сжечь бумагу, поместить в банку. Шарик сам опускается вниз.
Учащийся : вопрос классу:
Слайды: 1.почему шар оказался в банке? Как изменяются p, V, T?
2. составить вопросы по опыту: какая связь просматривается с другими темами физики? (домашнее задание)
Учащиеся сами читают условие задачи:
1. Если T идеального газа увеличить в 2 раза, то как изменится p? (ответ в 2 раза).
2. если v идеального газа уменьшить в 3 раза, то как изменится p? (домашнее задание), (ответ в 3 раза).
VI этап : закрепление.
Учитель: вопросы: (слайд)
- что нового вы сегодня узнали на уроке? ( ответ: уравнение Менделеева-Клапейрона, универсальное газовое постоянное)
- Назовите мне все физические величины. Входящие в уравнение Менделеева-Клапейрона и их единицы измерения.
VII этап: выводы по уроку.
Слайд с задачами на урок. Учитель обращает внимание учащихся, что все поставленные задачи выполнены, цель достигнута.
Поблагодарить за урок.
Слайд: спасибо за урок.
Учитель сам у доски
Дано: СИ Решение:
M h2 = 2*10 -3 кг/моль
V = 20 л = 0, 02м -3 m= (p*V*M)/(R*T)
t º = 17 º C = 290 К m= (830*0, 02*2*10 -3 )/8,31*290=
R=8,31Дж/моль*К 0, 014*10 -3 =1, 4* 10 -5 кг = 14 мг
[m] = Па*м 3 *(кг/моль) / (Дж/моль*К)*К = кг
Предварительный просмотр:
Подписи к слайдам:
Предварительный просмотр:
Предварительный просмотр:
Предварительный просмотр:
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Физический смысл универсальной газовой постоянной: характеризует внутреннюю энергию моля идеального газа в расчете на один Кельвин.
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Дано: Решение: Вычисления:
N 2 P= 1 / 3 ρ P = 1 / 3 · 1, 35 ·500 2 = 0,11МПа
ρ = 1, 35 кг\м 3 [Р] = = Па
Предварительный просмотр:
Задачи по теме: « Уравнения состояния идеального газа».
1. Если T идеального газа изменить, увеличить в 2 раза, то как измениться P-?
- Если V идеального газа уменьшить в 3 раза, то как измениться P-?
- Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240 К его объем равен 40 л?
- Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л при 12 º С, если масса этого воздуха 2 кг?
- В каких слоях атмосферы воздух ближе к идеальному газу: у поверхности Земли или на больших высотах?
- Определите массу водорода, находящегося в баллоне вместимостью
20 л под давлением 830 Па при температуре 17 º С.
- Газ занимает объем 100 л при нормальном атмосферном давлении и комнатной температуре 20 º С. Каково количество вещества газа? Сколько молекул газа в этом сосуде?
- Определите температуру азота, имеющего массу 2 г, занимающего объем 830 см ³ при давлении 0,2 МПа.
- Баллон, вместимостью 40 л содержит 1,98 кг углекислого газа. Баллон выдерживает давление не выше 30 · 10 5 Н/м 2 . При какой температуре возникает опасность взрыва?
- Газ массой 16 г при давлении 1 МПа и температуре 112 º С занимает объем1,6 л. Определите, какой это газ.
- В баллоне вместимостью 200 л находится гелий под давлением 100 кПа при температуре 7 º С. После подкачивания гелия его давление поднялось до 300 кПа, а температура увеличилась до 47 º С. На сколько увеличилась масса гелия?
- Найти массу природного горючего газа объемом 64 м ³ , считая, что объем указан при н.у. Молярную массу природного горючего газа считать равной молярной массе метана (СН 4 ).
- Воздух объемом 1,45 м ³ , находящийся при температуре 20 º С и давлении 100 кПа, превратили в жидкое состояние. Какой объем займет жидкий воздух, если его плотность 861 кг/м ³ ?
- Баллон, какой вместимости нужен для содержания в нем газа, взятого в количестве 50моль, если при максимальной температуре 360 К давление не должно превышать 6 МПа?
- Определите плотность азота при температуре 27 º с и давлении 100 кПа.
Предварительный просмотр:
Дано: СИ: Решение: Вычисления:
р=200кПа =2 ∙ 10 5 Па P · V= √· R ∙ T 2 ∙ 10 5 · 4 · 10 -2
Т=240К P ∙ V √ = 8,31 · 240 =4 Моль
V=40л =4 · 10 -2 м ³ √= R∙T Па· м 3
[√] = Дж ·К =
R=8, 31 Моль ∙к = Н ·м 3 ·моль·К
м ² =
= Н · м · м ² =Моль
Дано: СИ: Решение: Вычисления:
р=200кПа =2 ∙ 10 5 Па P · V= √· R ∙ T 2 ∙ 10 5 · 4 · 10 -2
Т=240К P ∙ V √ = 8,31 · 240 =4 Моль
V=40л =4 · 10 -2 м ³ √= R∙T Па· м 3
[√] = Дж ·К =
R=8, 31 Моль ∙к = Н ·м 3 ·моль·К
м ² =
= Н · м · м ² =Моль
Дано: СИ: Решение: Вычисления:
р=200кПа =2 ∙ 10 5 Па P · V= √· R ∙ T 2 ∙ 10 5 · 4 · 10 -2
Т=240К P ∙ V √ = 8,31 · 240 =4 Моль
V=40л =4 · 10 -2 м ³ √= R∙T Па· м 3
[√] = Дж ·К =
R=8, 31 Моль ∙к = Н ·м 3 ·моль·К
м ² =
= Н · м · м ² =Моль
Дано: СИ: Решение: Вычисления:
р=200кПа =2 ∙ 10 5 Па P · V= √· R ∙ T 2 ∙ 10 5 · 4 · 10 -2
Т=240К P ∙ V √ = 8,31 · 240 =4 Моль
V=40л =4 · 10 -2 м ³ √= R∙T Па· м 3
[√] = Дж ·К =
R=8, 31 Моль ∙к = Н ·м 3 ·моль·К
м ² =
= Н · м · м ² =Моль
Дано: СИ: Решение: Вычисления:
р=200кПа =2 ∙ 10 5 Па P · V= √· R ∙ T 2 ∙ 10 5 · 4 · 10 -2
Т=240К P ∙ V √ = 8,31 · 240 =4 Моль
V=40л =4 · 10 -2 м ³ √= R∙T Па· м 3
[√] = Дж ·К =
R=8, 31 Моль ∙к = Н ·м 3 ·моль·К
м ² =
= Н · м · м ² =Моль
Дано: СИ: Решение: Вычисления:
р=200кПа =2 ∙ 10 5 Па P · V= √· R ∙ T 2 ∙ 10 5 · 4 · 10 -2
Т=240К P ∙ V √ = 8,31 · 240 =4 Моль
V=40л =4 · 10 -2 м ³ √= R∙T Па· м 3
[√] = Дж ·К =
R=8, 31 Моль ∙к = Н ·м 3 ·моль·К
м ² =
= Н · м · м ² =Моль
http://infourok.ru/konspekt_uroka_po_fizike_na_temu_uravnenie_klapeyrona-mendeleeva_10_klass-550200.htm
http://nsportal.ru/shkola/fizika/library/2014/01/21/urok-po-teme-uravnenie-mendeleeva-klapeyrona