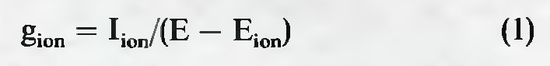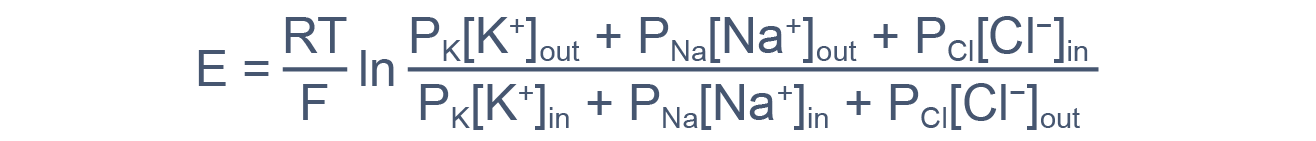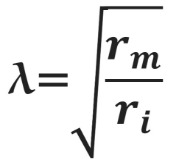Плотность суммарного тока через мембрану описывается уравнением
Во время потенциала действия происходит кратковременное изменение проницаемости мембраны для ионов, определяющих величину потенциала покоя. Когда речь идет об электрических свойствах мембраны, удобной мерой проницаемости мембраны для иона служит проводимость мембраны g(ion). Проводимость определяется отношением тока I(ion) к движущему потенциалу. При равновесном потенциале для рассматриваемого иона, E(ion) , движущий потенциал и суммарный ток равны нулю; следовательно, E(ion) является референтным потенциалом, и отклонение мембранного потенциала Е от E(ion) составляет ту разность потенциалов, которая создает ток I(ion) Следовательно, проводимость g(ion) описывается уравнением
Теперь мы можем продолжить описание ионных токов во время потенциала действия, пользуясь только что введенным понятием проводимости для индивидуальных ионов.
Ионные токи во время потенциала действия.
Потенциал покоя, как было показано в предыдущем разделе, очень близок к уровню равновесного потенциала для ионов калия (K), для которых мембрана в состоянии покоя наиболее проницаема. Если во время потенциала действия внутренняя среда клетки приобретает положительный заряд по отношению к внеклеточной среде, то проводимость мембраны для натрия (Na+) (gNa) должна возрастать, потому что только равновесный потенциал для натрия (Na+) имеет более положительное значение ( + 60 мВ), чем пик потенциала действия. Это заключение подтверждается экспериментальными данными, согласно которым потенциалы действия могут генерироваться только при высокой внеклеточной концентрации натрия (Na+).
При недостатке внеклеточного натрия (Na+) входящий натриевый ток не может нарастать, независимо о г того, в какой мере увеличивается gNa, и, следовательно, не может развиваться деполяризационная фаза потенциала действия. Таким образом, в основе возбуждения лежит повышение проводимости мембраны для натрия (Na+), вызываемое ее деполяризацией до порогового уровня. Однако в данном случае затрагивается также и проводимость мембраны для калия (K). Если повышение проводимости для калия (K) предотвратить некоторыми веществами, например тетраэтиламмонием, мембрана после потенциала действия реполяризуется гораздо медленнее. Это показывает, что повышение проводимости для калия (K) является важным фактором реполяризации мембраны. Итак, потенциал действия обусловлен циклическим процессом поступления натрия (Na+) в клетку и последующего выхода калия (K) из нее.
Мембранный потенциал
Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки [1] . В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
Потенциал покоя
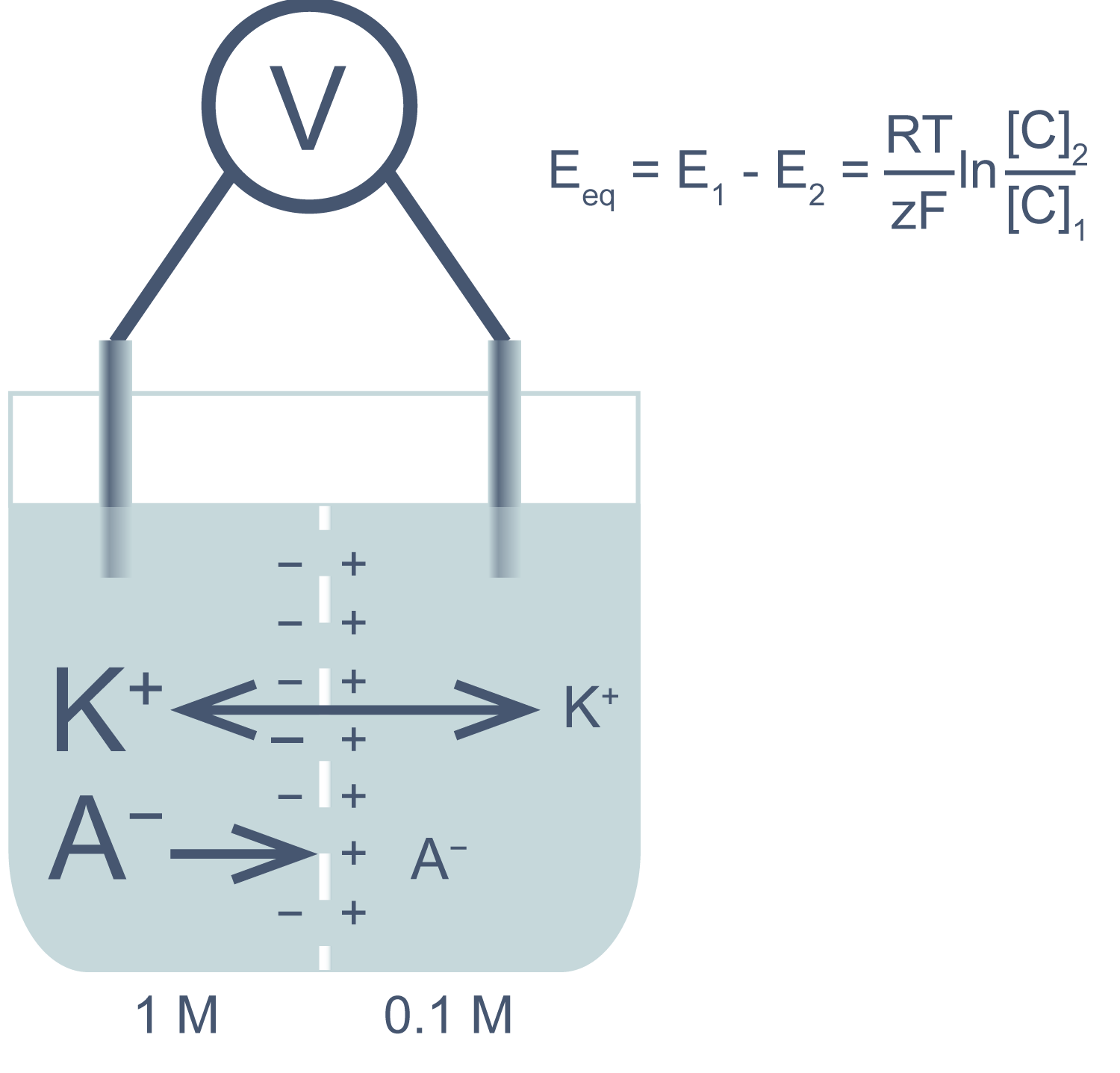
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K + , но не анионы Cl − . Ионы K + в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl − , неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K + из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль –1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K + в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
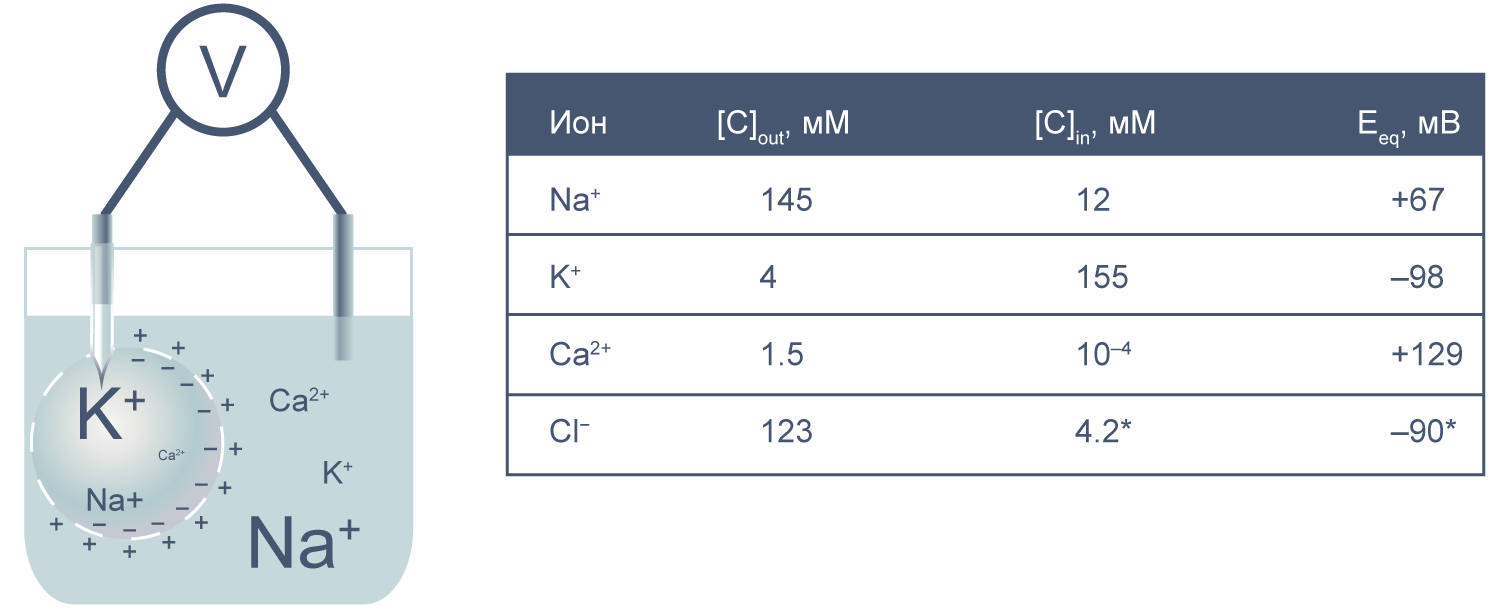
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки [2] .
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
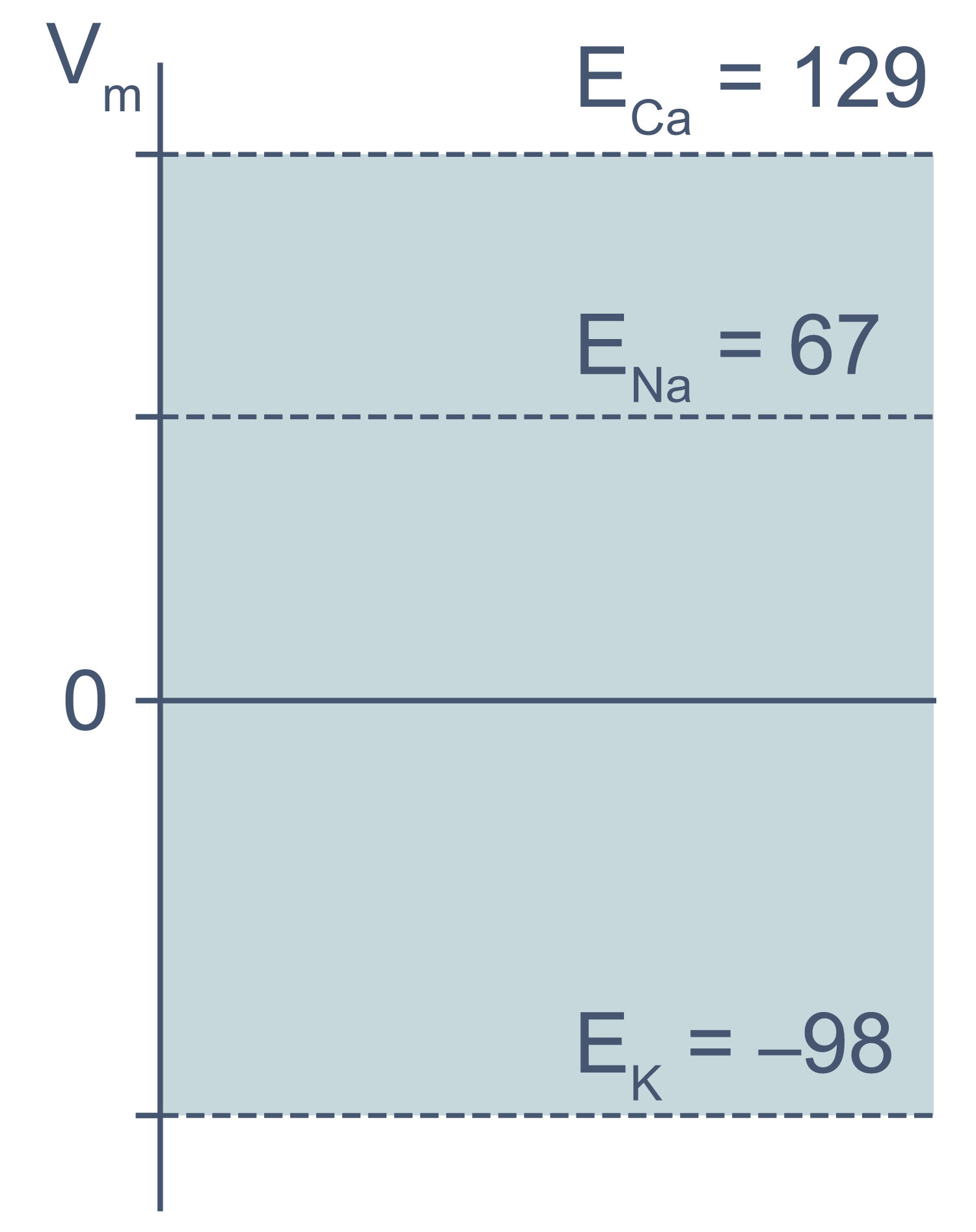
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na + , Ca 2+ ) и анионов (в первую очередь для Cl – и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K + , однако строго не равна ему, поскольку в реальности другие катионы и Cl – могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K + будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль –1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K + channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K + channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K + (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C [3] , кислым pH [4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum) [3] , эндоканнабиноидом анандамидом [5] , окситоцином [6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии [7] , муковисцидоза [8] , некоторых аритмий [9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na + наружу и два K + внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ [11] .
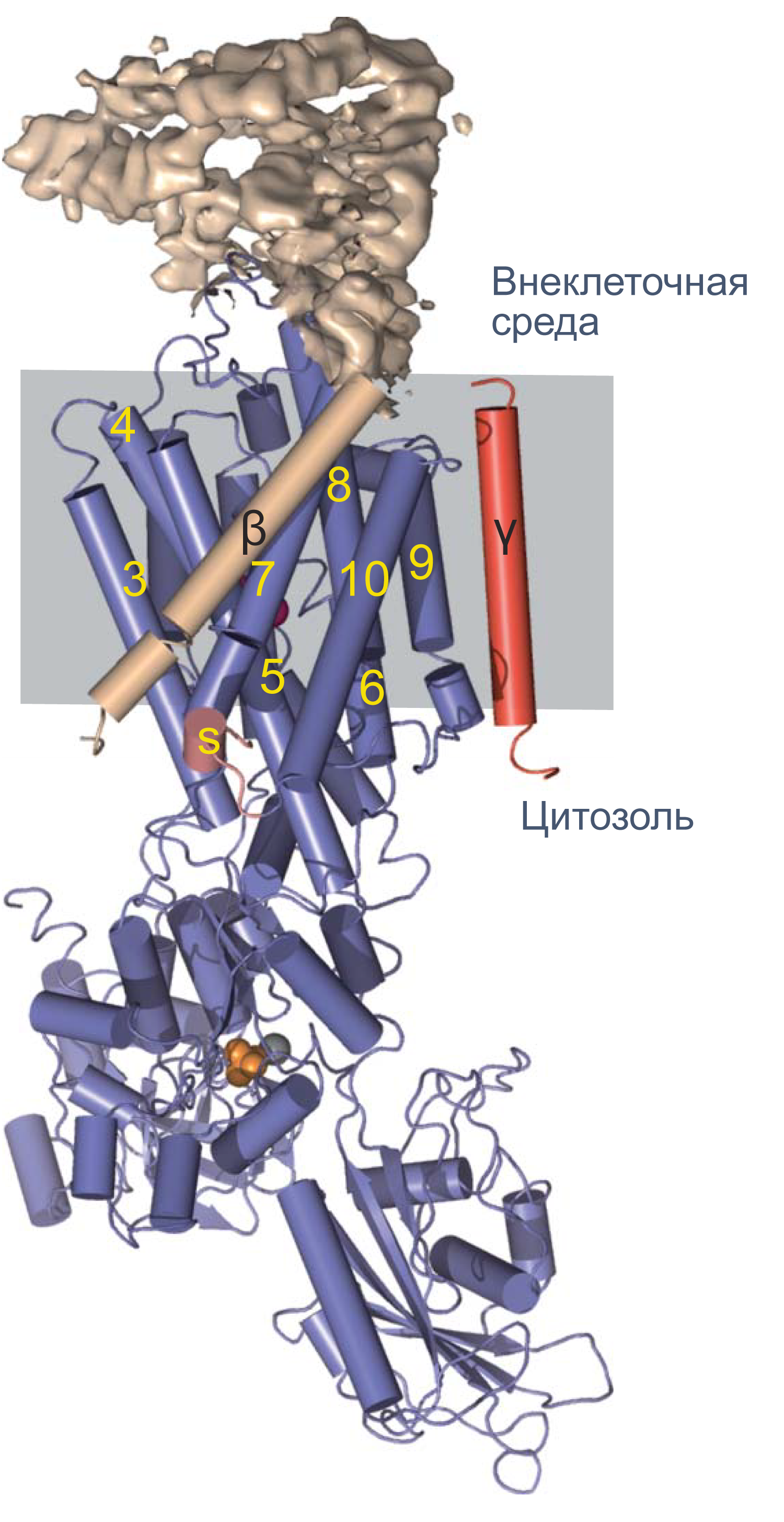
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками [12] .
Активный и пассивный транспорт веществ через мембрану
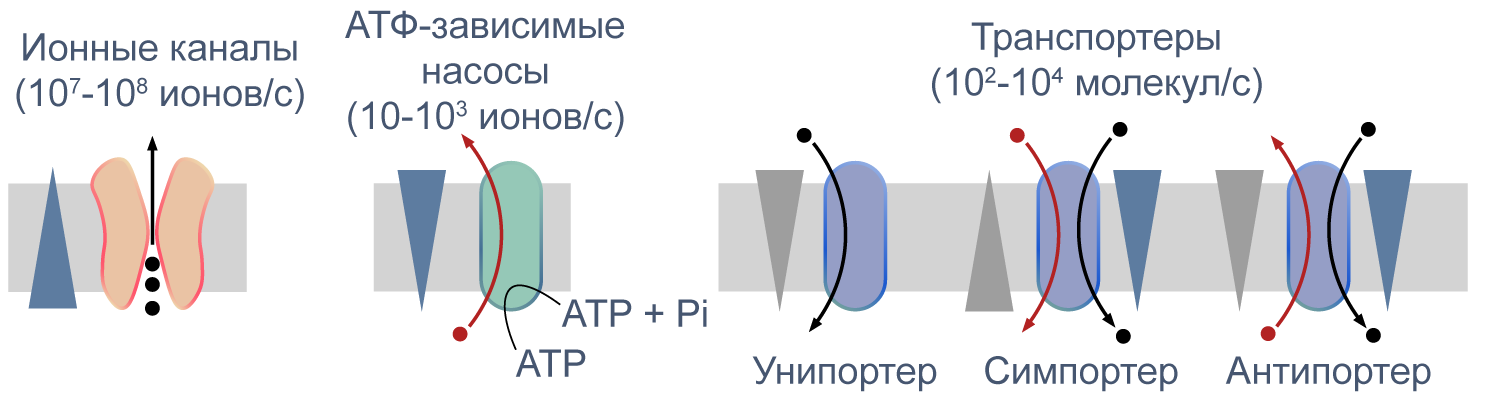
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×10 6 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na + и 200 K + в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина [15] . Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала [16] . Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl − [17] .
Клеточная мембрана как электрическая цепь
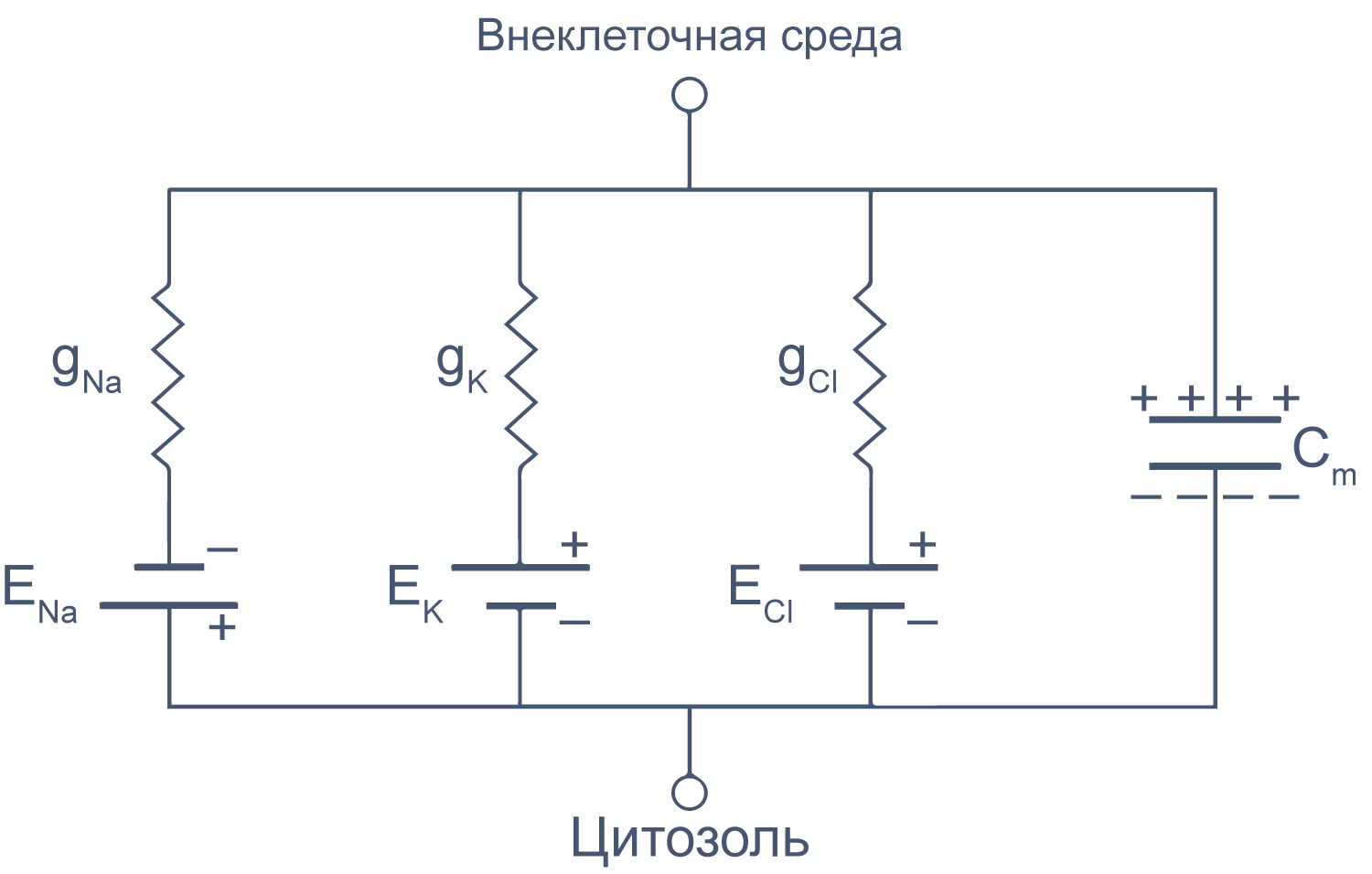
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na + , K + и Cl – , соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
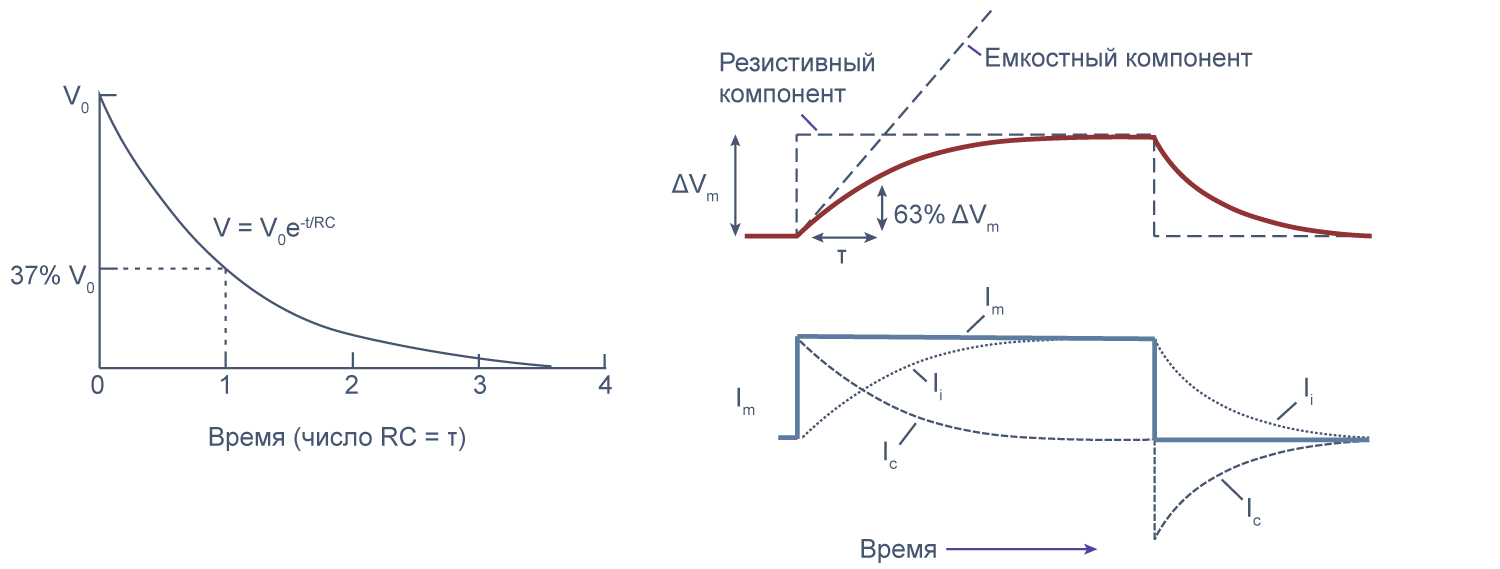
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см 2 или 0,01 пФ/мкм 2 *** и мало зависит от типа клеток [2] . Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e –t/RC , то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22] , Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом [18] . До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
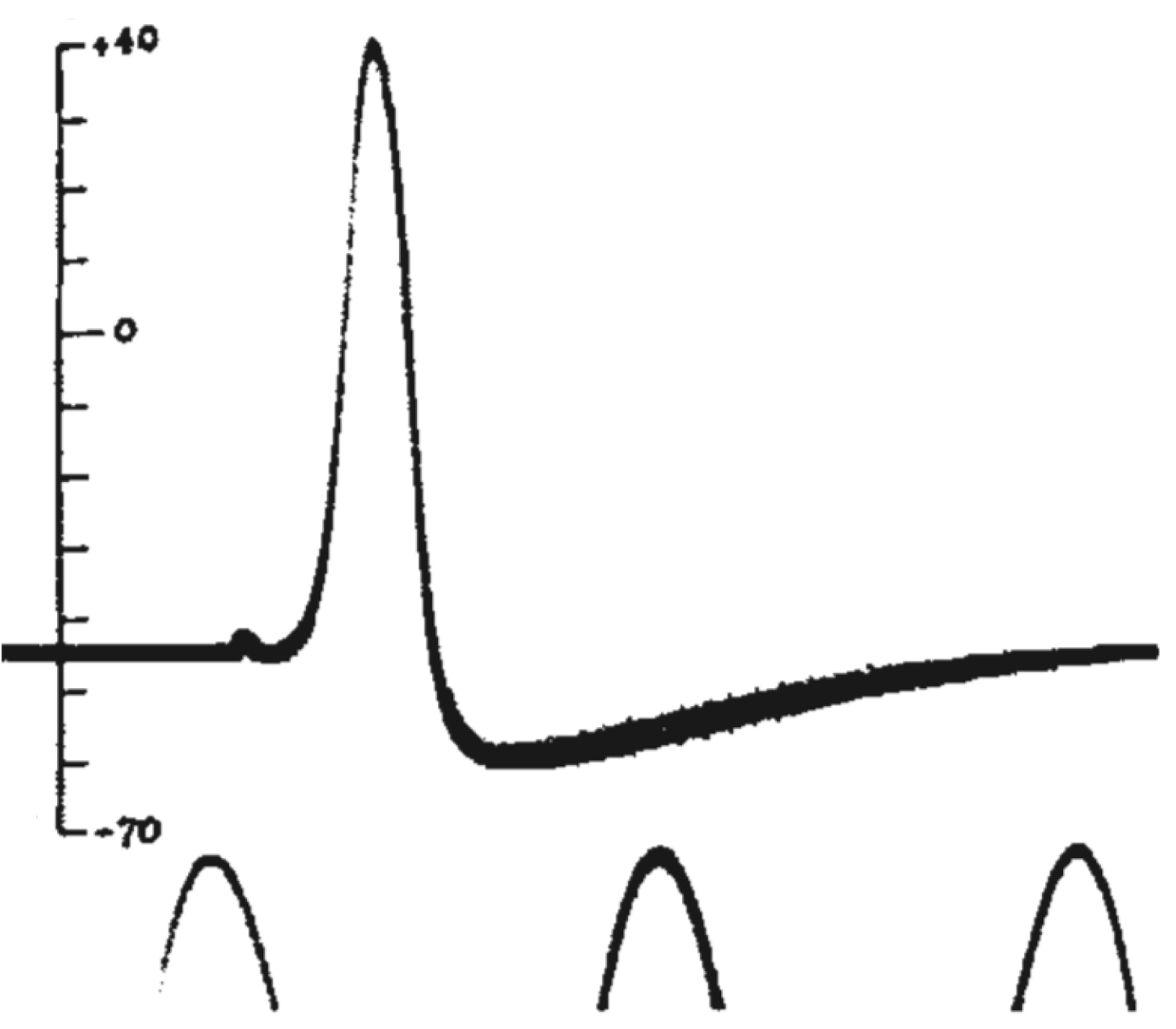
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна» [19] , в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года [19] . Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис [20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см 2 до 40 мСм/см 2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
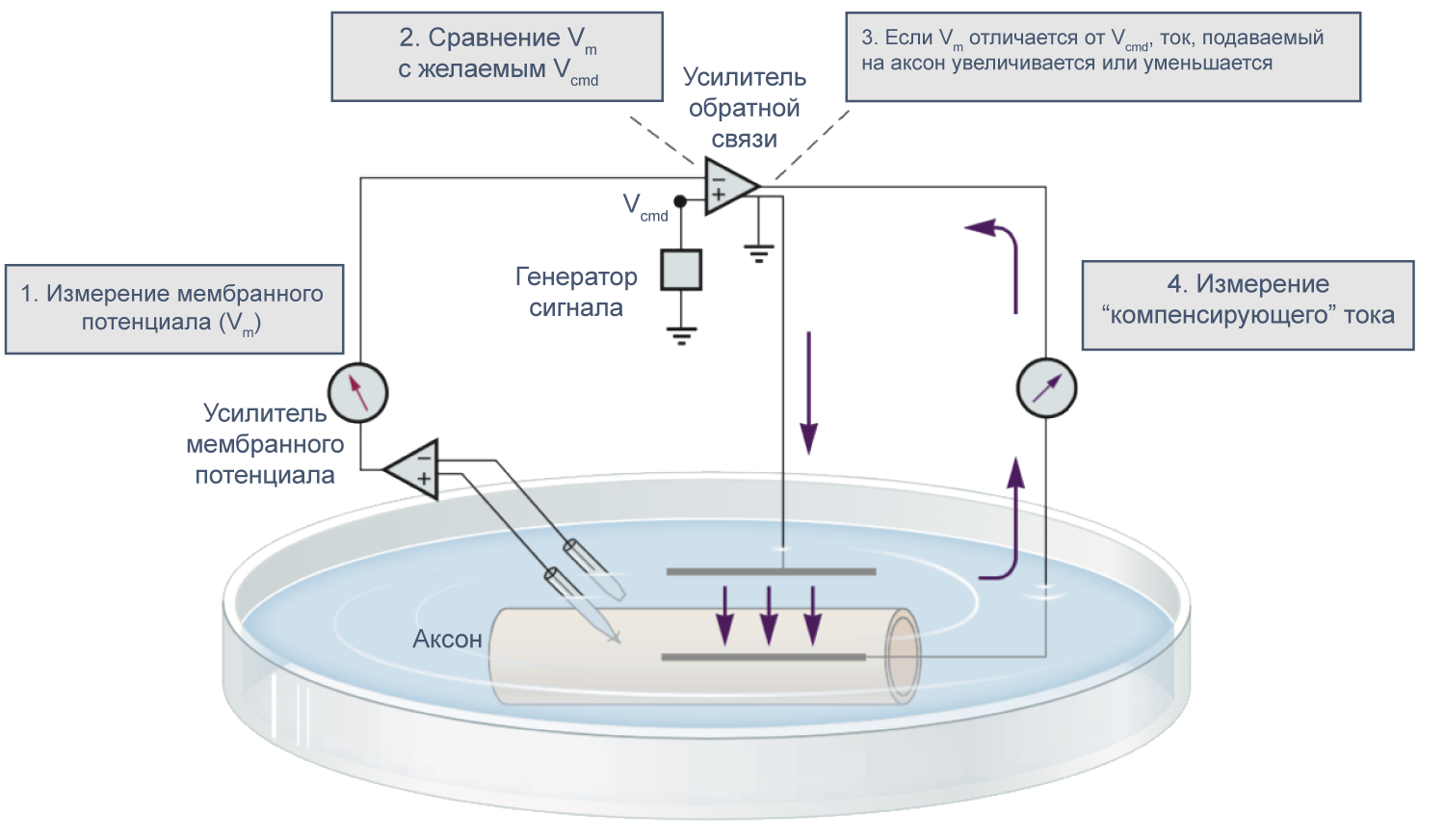
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом [21] . Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов [21] .
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
Временной ход потенциала действия
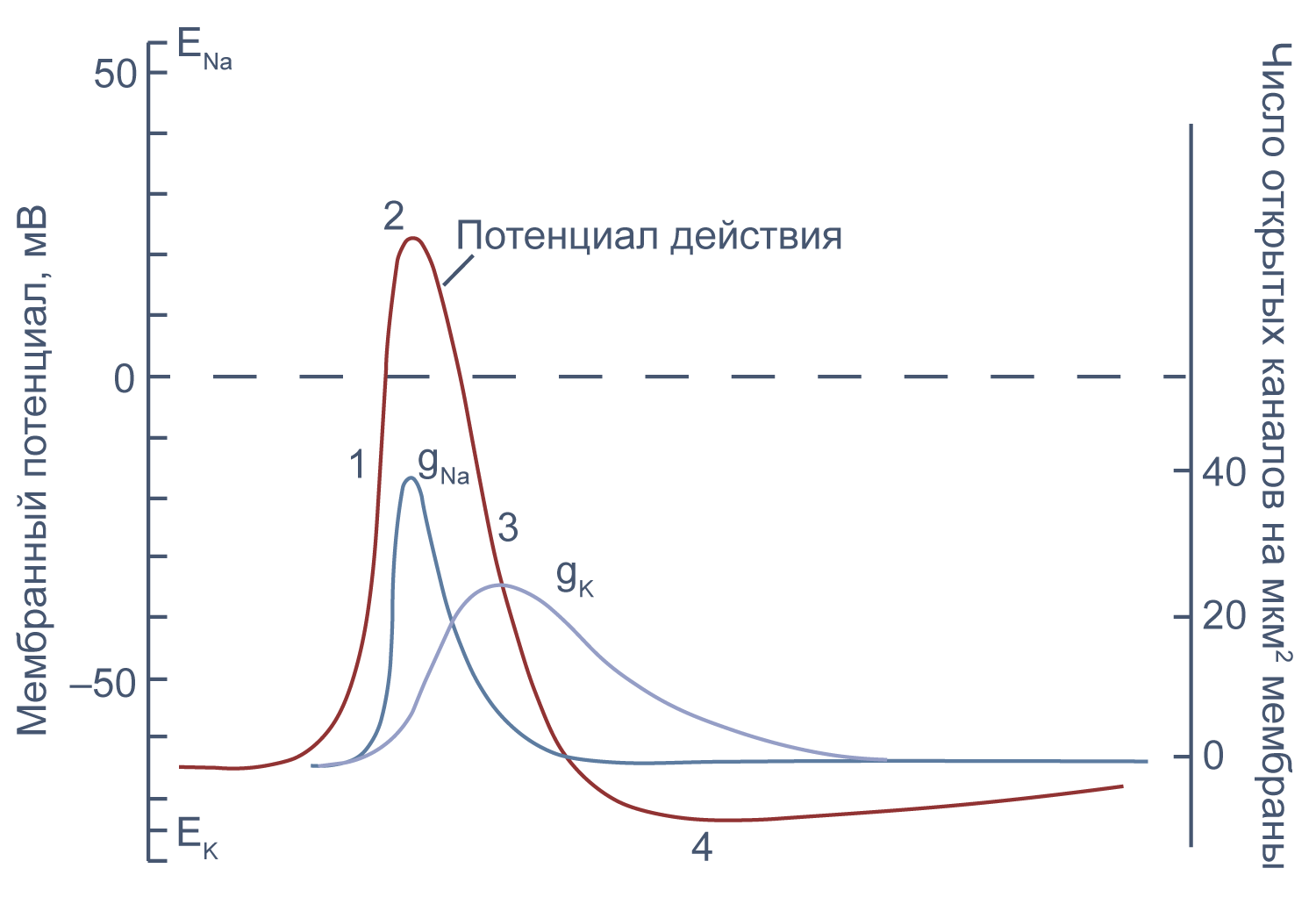
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na + и K + в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток [20] . Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли [23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
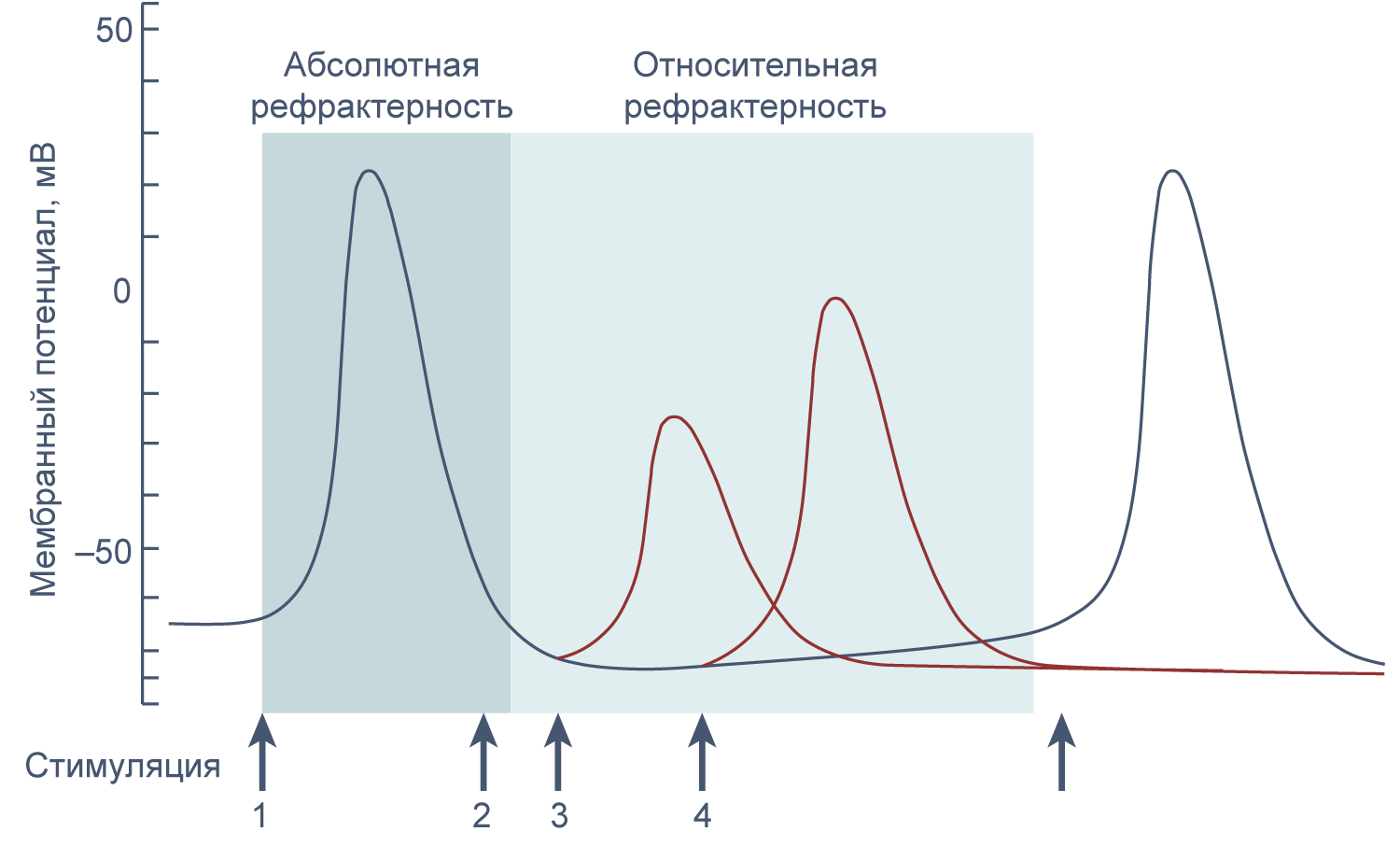
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na + и K + . Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см 2 , а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см 2 × 0,1 В = 10−7 Кл/см 2 . Величина заряда одного иона Na + или K + (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см 2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см 2 , или 6250 ионов/мкм 2 . Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr 2 = 314 мкм 2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr 3 /3 = 524 мкм 3 . При внутриклеточной концентрации Na + 10 мМ, а K + 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм 2 × 6,250 ионов/мкм 2 ≈ 2 000 000 ионов Na + входит в клетку в фазе деполяризации и примерно столько же ионов K + выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na + и K + все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром [25] .
Распространение возбуждения по аксону
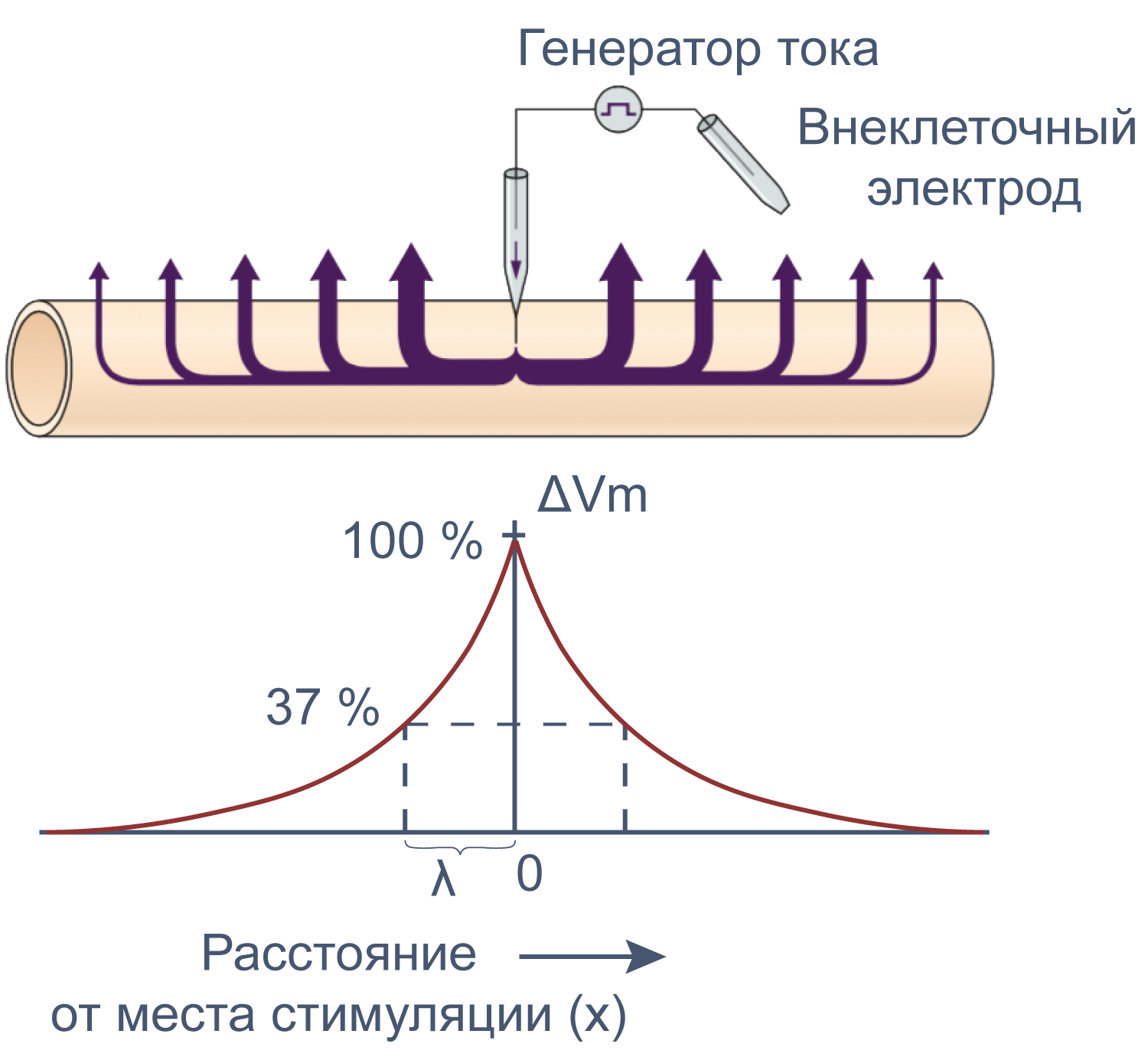
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e –x/λ , где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR 2 , а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca 2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне [26] ; эти значения на несколько порядков выше, чем 100 нМ свободного Ca 2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см -2 ∙с -1 ], D — коэффициент диффузии [см 2 ∙с -1 ], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см 2 , разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
Биологические мембраны. Биоэлектрогенез (лекция 5)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Лекция 5
Биологические мембраны; Биоэлектрогенез
Ростов-на-Дону
2012
Содержание лекции №5
Биологические мембраны и их физические свойства.
Уравнения простой диффузии и электродиффузии. Уравнение Фика. Уравнение Нернста-Планка.
Виды пассивного транспорта.
Понятие об активном транспорте ионов через биологические мембраны.
Потенциал покоя и потенциал действия
и их физические свойства
В каждой клетке есть плазматическая мембрана, которая ограничивает содержимое клетки от наружной среды, и внутренние мембраны, которые формируют различные органоиды
клетки:
митохондрии,
Что есть мозг клетки?
Клетка- мельчайшая структурная единица живого организма
лизосомы
и т.п.
Она состоит из органических молекул, которая имеет толщину 6-10 нм и видима только посредством электронного микроскопа.
Биологическая мембрана (БМ) – это клеточная граница, которой свойственна полупроницаемость.
БМ –это глико – липо — протеидный комплекс
Как понимать полупроницаемость?
Что она дает?
Схема строения клетки , реконструированная по данным электронной микроскопии.
ВОПРОС:
Через биологическую мембрану происходит обмен:
вещество
энергия
клетка
окружающая среда
in
out
БМ – это кожа клетки
in
Клеточные сообщества существуют только благодаря передаче информации от клетки к клетке. Если информационные процессы угнетены
онкозаболевания организм нажимает кнопку на самоуничтожение.
информация
Общие
Механическая
Барьерная
Матричная
Специфические
Транспортная
Рецепторная
Генерация
БП
Принимает участие в
информационных
процессах в живой
клетке
Функции биологических мембран
Структура биологических мембран
БМ = липиды + белки
40%
Из липидной части наиболее важны для структуры фосфолипиды.
Основа фосфолипида – трехатомный
глицерин. К нему присоединяются жирные кислоты.
0,8 нм
1/4
3/4
Полярная часть, где фосфатная группа. «Любит воду». Гидрофильная часть.
Гидрофобная часть. «Хвосты» не любят взаимодействовать с водой.
Физико-химическое свойство фосфолипидов – амфофильность.
Насыщенная жирная кислота
Ненасыщенная жирная кислота
В воде молекулы фосфолипидов автоматически собираются в бислой (bilayer)
Бислой – это
каркас для БМ
Самосборка
Самовосстановление
Мембранные белки (большие глобулы).
На 1 молекулу белка приходится 80-90 молекул фосфилипидов.
Электростатические
взаимодействия
Периферические
Пример: ферменты, рецепторы
Схема расположения молекулы родопсина в биологической мембране (α – спираль, пронизывающая 7 раз фосфолипидный каркас)
Интегральные белки
Периферические белки
Какие белки легче удалить? А для каких нужен детергент?
Схематическое строение БМ
Поверхностные белки
толщина мембраны
Липидный бислой
Различные формы молекулярного движения в БМ
Вращение
Латеральная
диффузия
Перемещение молекул в пределах одной стороны бислоя.
ФЛИП-ФЛОП= перемещение молекул поперек БМ.
Один раз в 2 недели.
В 109 медленнее
Физические свойства БМ
Текучесть ≈ const
Жидкокристаллическая
структура
С = 1 мкФ/см2
БМ — конденсатор
Электросопротивление
105 Ом/см2
гораздо больше, чем у
технических изоляторов
Поверхностный заряд
Отрицательный.
Препятствует слипанию
клеток крови
εлипидов = 2,2
Плотность липидного
бислоя 800 кг/м3 .
Меньше, чем у H2O
Вязкость
η = 100 мПа٠с
(оливковое масло)
Модуль упругости
Е=109 Па
1. Жидкокристаллическая структура
Кристалл
твердый
жидкий
Жидкокристаллическая структура (ЖК)
транспорт
скелет
Фазовый переход при температуре 370 С
Обусловлена необычайно высокой подвижностью мембранных компонентов.
Жидкий кристалл Твердый кристалл
Мембрана сохраняется в ЖК состоянии благодаря температуре клетки и химическому составу жирных кислот.
2. Текучесть ≈ const
3. Вязкость
БМ как ЖК структура характеризуется определенной вязкостью.
η = 100 мПа٠с
(оливковое масло)
На вязкость клеточных мембран влияет содержание в них холестерина.
При повышении содержания холестерина
вязкость . Исчезают
транспортные свойства.
Как влияет?
Бляшки холестерина
в артериях
4. Поверхностный заряд на мембране.
Продуктивность клетки, т.е. ее энергия является измеряемой величиной. Здоровая клетка обладает напряжением 70-90 мВ.
В зависимости от здоровья, напряжение снижается до 20-30 мВ В связи с этим мы чувствуем усталость и изнуренность.
Вся патология на мембранном уровне!
Уменьшение вязкости БМ – причина разжижжения БМ при злокачественных опухолях – при лейкозе.
Вязкость меняется при многих заболеваниях, под действием ионизирующего Э/М излучения , ряда фармпрепаратов.
Вязкость БМ уменьшается при тиреотоксикозе,
а также под действием наркотических веществ, например, хлороформа.
Две стороны мембраны, наружная и внутренняя, различаются и по составу и по функциям.
Эта структурная асимметрия мембран приводит к векторной направленности процессов переноса.
Академик Владимиров Ю.А.
Пассивный транспорт – это перенос веществ через биологическую мембрану без затраты энергии.
Транспорт «под горку»- down hill
Диффузия молекул
Электродиффузия ионов
Уравнение
ФИКА
Уравнение НЕРНСТА -ПЛАНКА
ВИДЫ ПАССИВНОГО ТРАНСПОРТА
Диффузия –это самопроизвольный процесс проникновения массы вещества из области большей концентрации в область с меньшей концентрацией в результате теплового хаотичного движения молекул.
Параметры диффузии
ПЛОТНОСТЬ
ПОТОКА
ВЕЩЕСТВА:
in
out
Уравнения простой диффузии и электродиффузии
Плотность потока
вещества – это количество вещества в единицу времени через единицу площади.
Математическое описание процесса диффузии дал физиолог Фик в 1855 г.
Уравнение Фика является основой конструирования ряда биотехнических систем, например, в аппаратах:
«Искусственная
почка»
Экстракорпорального кровообращения
описывает пассивный транспорт неэлектролитов
C out
C in
C out
C in
in
out
Плотность потока вещества через биологическую мембрану прямо пропорциональна градиенту концентрации
in
D – коэффициент диффузии [м2/с]
Коэффициент диффузии D зависит от природы вещества и температуры и характеризует способность вещества к диффузии.
U=Um NA
U= v/F
D=UmRT
Где — подвижность диффундирующих молекул, выраженная для моля.
Um
Так как
grad C определить трудно, то для описания диффузии веществ через мембрану используют более простое уравнение.
NA
-число Авогадро
R- универсальная газовая постоянная
Т – термодинамическая температура
Уравнение диффузии для мембраны
Где Р- коэффициент проницаемости
in
out
C in
C out
Это более простое уравнение предложено Коллендером и Берлундом.
Плотность потока вещества через биологическую мембрану прямо пропорциональна разности концентраций внутри и снаружи клетки.
Коэффициент проницаемости
C out
C in
где l – толщина БМ
D- коэффициент диффузии
К- коэффициент распределения между липидной и водной фазами.
Р – зависит от температуры, природы вещества, от свойств БМ, ее функционального состояния.
Нет проницаемости мембраны вообще, а есть разная проницаемость БМ для тех или иных веществ.
Уравнения электродиффузии
Перенос ионов
зависит
от двух градиентов
градиента концентрации
grad C
электрического градиента
grad φ.
grad μ
μ
Уравнение Нернста – Планка
Уравнение Нернста – Планка описывает пассивный транспорт ионов
Z – валентность иона
F = 96500 Кл/моль – число Фарадея
C – молярная концентрация
Um – подвижность ионов для моля
Разновидности пассивного транспорта
Простая физическая диффузия (O2, CO2, N2, яды, лекарства).
Через белок-канал (ионы).
Облегченная диффузия
(с носителем).
(АК,моносахариды, глюкоза)
Виды транспорта с носителем
Существуют системы переносчиков, которые
способны транспортировать более одного вещества
μ
out
Понятие об активном транспорте ионов через биологические мембраны
C2=С1
in
C1
Up hill- в горку
Активный транспорт – это перенос веществ (ионов) через БМ, связанный с затратой химической энергии (энергия метаболизма) из области МЕНЬШЕГО ! электрохимического потенциала в область большего электрохимического потенциала.
ВОПРОС: Что будет через некоторое время, если пассивный транспорт?
C1
C2
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 920 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 36 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 585 323 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 24.12.2020
- 132
- 0
- 03.12.2020
- 70
- 0
- 28.11.2020
- 64
- 0
- 22.11.2020
- 420
- 8
- 16.11.2020
- 142
- 0
- 19.08.2020
- 74
- 0
- 11.08.2020
- 302
- 2
- 10.07.2020
- 96
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 19.08.2020 828
- PPTX 4.7 мбайт
- 5 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Макаренко Наталья Валерьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 1 месяц
- Подписчики: 0
- Всего просмотров: 22986
- Всего материалов: 225
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
В Курганской области дистанционный режим для школьников продлили до конца февраля
Время чтения: 1 минута
Минобрнауки создаст для вузов рекомендации по поддержке молодых семей
Время чтения: 1 минута
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Получите новую специальность со скидкой 10%
Цена от 4900 740 руб. Промокод (до 23 февраля): Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
http://medach.pro/post/1458
http://infourok.ru/biologicheskie-membrany-bioelektrogenez-lekciya-5-4878627.html