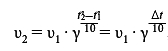По термохимическому уравнению реакции горения углерода: C(тв) + O2(г) = CO2(г) +410 кДж рассчитайте: а) количество теплоты,
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Расчеты по термохимическим уравнениям
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм II. Расчеты по термохимическим уравнениям
Какое количество теплоты выделится при сгорании метана объемом 4,48 л (н.у.) в соответствии с термохимическим уравнением
СН 4 +2О 2 = СО 2 +2Н 2 О+878 кДж
Кратко записать условие задачи
Дано: Q = +878 кДж
Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении
Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением
Найти количество вещества метана, занимающего объем 4,48 л
n ( CH 4 )= 4,48л / 22,4л/моль = 0,2 моль
Вычислить количество теплоты, выделившейся при сгорании метана количеством вещества 0,2 моль
878 кДж – 1 моль СН 4
Q 1 – 0,2 моль СН 4
При сгорании метана объемом 4,48 л (н.у.) выделится 175,6 кДж теплоты
Дано: Q = +2700 кДж
V (С 2 Н 2 ) = 224
Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении
Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением
1 моль 2700 кДж
Найти количество вещества ацетилена, занимающего объем 224 л
n ( C 2 H 2 )= 224л / 44,8/моль = 5 моль
Вычислить количество теплоты, выделившейся при сгорании ацетилена количеством вещества 5 моль
2700 кДж – 1 моль С 2 Н 2
Q 1 – 5 моль С 2 Н 2
При сгорании ацетилена объемом 224 л (н.у.) выделится 13500 кДж теплоты
Дано: Q = +1642 кДж
Найти: m ( CH 3 COOH ) — ?
Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении
Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением
Найти относительные молекулярные массы, молярные массы веществ, используемых при решении задачи
Mr ( CH 3 COOH) = 12+3*1+12+16*2+1=60
M ( CH 3 COOH) = 60 г / моль
Mr ( CO 2 ) = 12+16*2= 44
M ( CO 2) = 44 г / моль
Вычислим количество вещества уксусной кислоты, при сжигании которой выделилось 1642 кДж теплоты
821 кДж – 1 моль CH 3 COOH
1642 кДж — 2 моль CH 3 COOH
Вычислим массу уксусной кислоты, количество вещества которой 2 моль
m ( CH 3 COOH ) = n * M
m ( CH 3 COOH ) = 2 моль *60г/моль = 120 г
Вычислим количество вещества оксида углерода(IV) , образовавшегося в ходе реакции
2 моль CO 2 – 1 моль CH 3 COOH
4 моль CO 2 — 2 моль CH 3 COOH
Вычислим какой объем оксида углерода (IV) выделился в течении реакции
V( CO 2 ) = Vm* n (CO 2)
V( CO 2 ) = 22,4*4 моль = 89,6 л
120 г уксусной кислоты получится, если в результате реакции выделится 1642 кДж теплоты, объем оксида углерода (IV) при этом составит 89,6 л
Задачи для самостоятельного решения.
Задача II.4. Какое количество теплоты выделится при сгорании уксусной кислоты объемом 2,24л (н.у.) в соответствии с термохимическим уравнением
C Н 3 COOH + 2 О 2 = 2 C О 2 + 2Н 2 O + 821 кДж
Задача II.5. Какое количество теплоты выделится при сгорании этена объемом 22,24л (н.у.) в соответствии с термохимическим уравнением
C 2 Н 4 + 3 О 2 = 2 C О 2 + 2Н 2 O + 1500 кДж
Задача II.6. Какое количество теплоты выделится при сгорании 1 л метана (измерено при н.у.), если тепловой эффект этой реакции равен 801 кДж?
Задача II.7При сжигании 1 моль ацетилена выделится 1350 кДж теплоты. Сколько теплоты выделится при сжигании 10 л ацетилена (н.у)?
Задача II.8. При сжигании 5 моль этанола выделяется 1248 кДж теплоты. Какая масса этанола должна сгореть, чтобы выделилось 624 кДж теплоты?
Задача II.9. При сжигании 2 моль ацетилена выделяется 1350 кДж теплоты. Какая масса ацетилена должна сгореть , чтобы выделилось 200 кДж теплоты?
Задача II.10. При сжигании 10 моль метана выделяется 1600 кДж теплоты. Какой объем метана должен сгореть , чтобы выделилось 3000 кДж теплоты?
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 945 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 25 человек из 16 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 591 916 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 11.11.2016
- 2976
- 24
- 11.11.2016
- 2762
- 13
- 11.11.2016
- 2869
- 96
- 11.11.2016
- 866
- 1
- 11.11.2016
- 400
- 1
- 11.11.2016
- 414
- 0
- 11.11.2016
- 775
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 11.11.2016 9394
- DOCX 57 кбайт
- 76 скачиваний
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Фирсова Арина Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 3 месяца
- Подписчики: 0
- Всего просмотров: 59429
- Всего материалов: 25
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
Студенты российских вузов смогут получить 1 млн рублей на создание стартапов
Время чтения: 3 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://prosto-o-slognom.ru/chimia_primery/005-termochimicheskie_uravneniya.html
http://infourok.ru/rascheti-po-termohimicheskim-uravneniyam-1342180.html