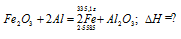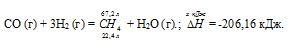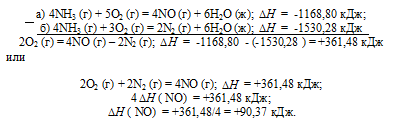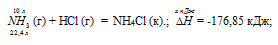По термохимическому уравнению реакции : 2Al + Fe2O3 = Al2O3 + 2Fe + 848кДж расчитайте, сколько теплоты выделится при вступлении в реакцию?
Химия | 10 — 11 классы
По термохимическому уравнению реакции : 2Al + Fe2O3 = Al2O3 + 2Fe + 848кДж расчитайте, сколько теплоты выделится при вступлении в реакцию.
А) 10, 8 г Алюминия.
M(Al) = 27 г / моль
n(Al) = m / M = 10, 8 / 27 = 0, 4 моль
По уравнению реакции при взаимодействии 2 моль алюминия с оксидом железа выделяется 848 кДж теплоты, тогда при реакции с 0, 4 моль алюминия количество теплоты составит
Q = 848 * 0, 4 / 2 = 169, 6 кДж.
При сжигании 11 г ацетальдегида выделилось 298, 11 кДж теплоты?
При сжигании 11 г ацетальдегида выделилось 298, 11 кДж теплоты.
Составьте термохимическое уравнение этой реакции.
При сгорании 8 г кальция выделилось 127 кДж теплоты?
При сгорании 8 г кальция выделилось 127 кДж теплоты.
Составить термохимическое уравнение реакции.
Термохимическое уравнения реакции алюминия с серой :2Al + 3S = Al2S3 + 509 кДж?
Термохимическое уравнения реакции алюминия с серой :
2Al + 3S = Al2S3 + 509 кДж.
Сколько теплоты выделиться при реакции 10, 8 алюминия с серой?
Буду благодарна, если решение будет со всеми формулами.
Составьте термохимическое уравнение реакции горения С2Н4, если в реакцию вступил 1 моль кислорода и при этом выделилось 467 кДж теплоты?
Составьте термохимическое уравнение реакции горения С2Н4, если в реакцию вступил 1 моль кислорода и при этом выделилось 467 кДж теплоты.
По термохимическому уравнению реакции : С + О2 равно СО2 + 402 кДЖ вычислите массу сгоревшего угля если выделилось 2412 кДж теплоты?
По термохимическому уравнению реакции : С + О2 равно СО2 + 402 кДЖ вычислите массу сгоревшего угля если выделилось 2412 кДж теплоты.
При сжигании 13 г цинка выделилось 69, 6 кДж теплоты, Составьте термохимические уравнение этой реакции,?
При сжигании 13 г цинка выделилось 69, 6 кДж теплоты, Составьте термохимические уравнение этой реакции,.
При сгорании 8г кальция выделилось 127 кДж теплоты?
При сгорании 8г кальция выделилось 127 кДж теплоты.
Составьте термохимическое уравнение реакции.
Термохимическое уравнение взаимодействия алюминия с серой имеет вид : 2Al + 3S = Al2S3 + 509 кДж Рассчитайте, какое количество теплоты выделится, если для реакции взяли 81г алюминия?
Термохимическое уравнение взаимодействия алюминия с серой имеет вид : 2Al + 3S = Al2S3 + 509 кДж Рассчитайте, какое количество теплоты выделится, если для реакции взяли 81г алюминия.
По термохимическому уравнению реакции : 2АL + Fe2O3 = 2Fe + AlO3 + 848 кДж расчитайте, сколько выделиться теплоты, если в реакцию вступило 0, 4 моль оксида ПОМОГИТЕ?
По термохимическому уравнению реакции : 2АL + Fe2O3 = 2Fe + AlO3 + 848 кДж расчитайте, сколько выделиться теплоты, если в реакцию вступило 0, 4 моль оксида ПОМОГИТЕ.
Вычислить по термохимическому уравнению реакции : N2 + 3H2 = 2NH3 = 97кДж сколько вступило в реакцию по объему водорода, если при этом выделилось 23 кДж теплоты?
Если вам необходимо получить ответ на вопрос По термохимическому уравнению реакции : 2Al + Fe2O3 = Al2O3 + 2Fe + 848кДж расчитайте, сколько теплоты выделится при вступлении в реакцию?, относящийся к уровню подготовки учащихся 10 — 11 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
По термохимическому уравнению реакции 2al
Вопрос по химии:
По термохимическому уравнению реакции : 2Al+Fe2O3=Al2O3+2Fe+848кДж расчитайте, сколько теплоты выделится при вступлении в реакцию. А) 10,8 г Алюминия
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
M(Al) = 27 г/моль
n(Al) = m/M = 10,8/27 = 0,4 моль
По уравнению реакции при взаимодействии 2 моль алюминия с оксидом железа выделяется 848 кДж теплоты, тогда при реакции с 0,4 моль алюминия количество теплоты составит
Q = 848*0,4/2 = 169,6 кДж
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Как рассчитать количество теплоты, тепловой эффект и теплоту образования
Количество теплоты
Задание 81.
Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
Решение:
Уравнение реакции:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:



Вычисление количества теплоты, которое выделяется при получении 335,1 г железа, про-изводим из пропорции:
(2 . 55,85) : -847,7 = 335,1 : х; х = (0847,7 . 335,1)/ (2 . 55,85) = 2543,1 кДж,
где 55,85 атомная масс железа.
Ответ: 2543,1 кДж.
Тепловой эффект реакции
Задание 82.
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж.
Решение:
Уравнение реакции имеет вид:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:




= -235,1 -[(52,28) + (-241,83)] = — 45,76 кДж
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Если в результате реакции выделяется теплота, то
Ответ: — 45,76 кДж.
Задание 83.
Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
Решение:
Уравнение реакции восстановления оксида железа (II) водородом имеет вид:
ЕеО (к) + Н2 (г) = Fe (к) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Теплота образования воды определяется уравнением
а теплоту образования оксида железа (II) можно вычислить, если из уравнения (б) вычесть уравнение (а).




Ответ: +27,99 кДж.
Задание 84.
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2 (г). Напишите термохимическое уравнение этой реакции, предварительно вычислите ее тепловой эффект. Ответ: +65,43 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:






Термохимическое уравнение будет иметь вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Ответ: +65,43 кДж.
Tермохимическое уравнение реакции
Задание 85.
Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — кое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
СО (г) + 3Н2 (г) = СН4 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:





Термохимическое уравнение будет иметь вид:
22,4 : -206,16 = 67,2 : х; х = 67,2 (-206,16)/22?4 = -618,48 кДж; Q = 618,48 кДж.
Ответ: 618,48 кДж.
Теплота образования
Задание 86.
Тепловой эффект какой реакции равен теплоте образования. Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
а) 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2O (ж); 
б) 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2O (ж); 
Ответ: 90,37 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование NO из простых веществ можно представить так:
Дана реакция (а), в которой образуется 4 моль NO и дана реакция (б), в которой образуется 2 моль N2. В обеих реакциях участвует кислород. Следовательно, для определения стандартной теплоты образования NO составим следующий цикл Гесса, т. е. нужно вычесть уравнение (а) из уравнения (б):
Таким образом, 1/2N2 + 1/2O2 = NO; 
Ответ: 618,48 кДж.
Задание 87.
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
NH3 (г) + НCl (г) = NH4Cl (к).; 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствиие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при реакции 10 л аммиака по этой реакции, определим из про-порции:
22,4 : -176,85 = 10 : х; х = 10 (-176,85)/22,4 = -78,97 кДж; Q = 78,97 кДж.
http://online-otvet.ru/himia/5cea7bee96f4e19a290aa9eb
http://buzani.ru/zadachi/khimiya-shimanovich/912kolichestvo-teploty-teplovoj-effekt