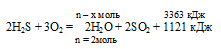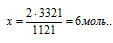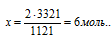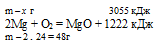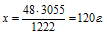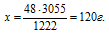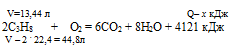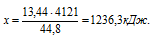Вычисление количества теплоты, количества и массы веществ реакций горения сероводорода, пропена и магния
Задача 1.8.
При полном сгорании сероводорода в избытке кислорода выделилось 3363 кДж теплоты. Согласно термохимическому уравнению:
2Н2S + 3О2 = 2Н2O + 2SO2 + 1121 кДж
количество вещества образовавшейся воды составляет:
1) 1 моль; 2) 2 моль; 3) 4 моль; 4) 6 моль.
Дано: Количество выделившейся теплоты: Q = 3363 кДж.
Найти: количество вещества образовавшейся воды: n(H2O) = ?
Р е ш е н и е:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
х моль сероводорода дают 3363 кДж (по условию)
2 моль сероводорода дают 1121 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 4.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1121 кДж выделяется при полном сгорании 2 моль H2S, следовательно, можно составить пропорцию:
1211 кДж выделяется при сгорании 2 моль H2S
3363 кДж выделяется при сгорании х моль H2S
Подходит ответ № 4.
Ответ: n(H2O) = 6 моль.
Задача 1.9
При горении магния в кислороде выделилось 3055 кДж теплоты. Согласно термохимическому уравнению:
2Мg + О2 = МgО + 1222 кДж
масса сгоревшего магния равна:
1) 24 г; 2) 60 г; 3) 120 г; 4) 240 г.
Дано: Количество выделившейся теплоты: Q = 3055 кДж.
Найти: масса сгоревшего магния: m(Mg) = ?
Решение:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
х г магния дают 3055 кДж (по условию)
48г магния дают 1222 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1222 кДж выделяется при полном сгорании 48 г Mg, следовательно, можно составить пропорцию:
1222 кДж выделяется при сгорании 48 г Mg
3055 кДж выделяется при сгорании х г Mg
Видим, что подходит ответ № 3.
Ответ: m(Mg) = 120 г.
Задача 1.10.
При сгорании 2 моль пропена выделяется 4121 кДж теплоты. При сгорании 13,44 л пропена (н.у.) выделяется:1) 2472,6 кДж; 2) 1236,ЗкДж; 3) 8242кДж; 4) 1373 кДж.
Дано: Количество выделившейся теплоты: Q = 4121 кДж.
Найти: количество теплоты Q= х кДж = ?
Решение:
I способ
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления количества вещества образовавшейся воды составляем пропорцию:
44,8 л пропена дают 4121 кДж (по условию)
13,44 л пропена дают х кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
При решении данной задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
Согласно определению теплоты образования 4121 кДж выделяется при полном сгорании 44,8 л пропена, следовательно, можно составить пропорцию:
4121 кДж выделяется при сгорании 44,8 л пропена
х кДж выделяется при сгорании 13,44 л пропена
Для реакции горения сероводорода 2H2S +3O2 -> 2SO2 +3H2O определите: а) массу паров воды, образующихся при сгорании
Ваш ответ
Похожие вопросы
- Все категории
- экономические 43,297
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,223
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Термохимическое уравнение реакции горения сероводорода 2H2S + 3O2 = 2SO2 + 2H2O + 1166 кДж?
Химия | 5 — 9 классы
Термохимическое уравнение реакции горения сероводорода 2H2S + 3O2 = 2SO2 + 2H2O + 1166 кДж.
При сгорании 11, 2 л (н.
У. ) сероводорода выделится теплота?
11, 2 л Х кДж 2H2S.
Vm = 22, 4 л / моль
Q = 11, 2 * 1166 / 44, 8 = 291, 5 кДж.
Составьте термохимическое уравнение, если при сгорании 4 г кальция выделилось 32 кДж теплоты?
Составьте термохимическое уравнение, если при сгорании 4 г кальция выделилось 32 кДж теплоты.
Теплота сгорания угля равна 393?
Теплота сгорания угля равна 393.
Напишите термохимическое уравнение реакции.
Рассчитайте кол — во теплоты, которое выделится при сгорании 1 кг.
Какой объем углекислого газа (н.
У. ) образовался, если при сгорании угля выделилось 157, 4 кДж теплоты?
СКОЛЬКО ТЕПЛОТЫ ВЫДЕЛИТСЯ ПРИ ПОЛНОМ СГОРАНИИ 10 Л СЕРОВОДОРОДА, ЕСЛИ ПРИ СГОРАНИИ 2 МОЛЕЙ СЕРОВОДОРОДА ВЫДЕЛЯЕТСЯ 1057 КДЖ ТЕПЛОТЫ?
СКОЛЬКО ТЕПЛОТЫ ВЫДЕЛИТСЯ ПРИ ПОЛНОМ СГОРАНИИ 10 Л СЕРОВОДОРОДА, ЕСЛИ ПРИ СГОРАНИИ 2 МОЛЕЙ СЕРОВОДОРОДА ВЫДЕЛЯЕТСЯ 1057 КДЖ ТЕПЛОТЫ?
Сколько теплоты выделиться при полном сгорании 10 л сероводорода если при сгорании 2 молей выделиться 1057 Кдж теплоты?
Сколько теплоты выделиться при полном сгорании 10 л сероводорода если при сгорании 2 молей выделиться 1057 Кдж теплоты.
Срочно решите задачу?
Срочно решите задачу!
Термохимическое уравнение горение сероводорода 2Н2S + 3O2 = 2SO2 + 2H2O + 1125.
Объём сгоревшегося газа (н.
У. , в литрах), содержащего 80% сероводорода, если при этом выделилось 562, 8 кДж.
По термохимическому уравнению реакции горения метана CH4(г) + 2O2(г) = CO(г) + 2H2O(г) + 890 кДж вычислите массу сгоревшего метана если известно что при его сгорании выделилось 178 кДж теплоты?
По термохимическому уравнению реакции горения метана CH4(г) + 2O2(г) = CO(г) + 2H2O(г) + 890 кДж вычислите массу сгоревшего метана если известно что при его сгорании выделилось 178 кДж теплоты.
Сжигание сероводорода термохимической уравнение 2H2S + 3O2 = 2SO2 + 2H2O + 1 166 кДж и 11, 2 литра (q?
Сжигание сероводорода термохимической уравнение 2H2S + 3O2 = 2SO2 + 2H2O + 1 166 кДж и 11, 2 литра (q.
J количество тепла от сгорания сероводорода.
Составьте термохимическое уравнение реакции горения этилена в кислороде, если известно, что при сгорании 11, 2 л этилена выделяется 661, 5 кДж теплоты?
Составьте термохимическое уравнение реакции горения этилена в кислороде, если известно, что при сгорании 11, 2 л этилена выделяется 661, 5 кДж теплоты.
Составьте термохимическое уравнение реакции горения натрия в хлоре, если известно, что при сгорании 1, 8 * 10 в 23 степени его атомов выделилось количество теплоты, равное 1233 кДж?
Составьте термохимическое уравнение реакции горения натрия в хлоре, если известно, что при сгорании 1, 8 * 10 в 23 степени его атомов выделилось количество теплоты, равное 1233 кДж.
Термохимическое уравнение реакции горения фосфора 4P + 5O2 = 2P2O5 + 2984 кДж?
Термохимическое уравнение реакции горения фосфора 4P + 5O2 = 2P2O5 + 2984 кДж.
Сколько теплоты выделится при реакции фосфора с 44, 8л кислорода.
Вы перешли к вопросу Термохимическое уравнение реакции горения сероводорода 2H2S + 3O2 = 2SO2 + 2H2O + 1166 кДж?. Он относится к категории Химия, для 5 — 9 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
1) Zn + 2HCl = ZnCl2 + H2 газ Соль, которая образовалась — это ZnCl2 n(ZnCl)2 = m / M M(ZnCl2) = 63 + 35. 5•2 = 134 г / моль n = 2. 72 / 134 = 0. 02 моль По уравнению реакции : n(Zn) = n(ZnCl2) = 0. 02 моль m(Zn) = n•M = 0. 02•63 = 1. 26 г 2) С..
3, 5моль * 81г / моль = 283, 5г.
MnO2 Cr2O3 CO Ag2O MgO P2O5.
Усиление металлических свойств смотрим по таблице Менделеева. Металлические свойства усиливаются справа налево, сверху вниз. Поэтому ответом будет б) Li, Na, K.
1) Al, Mg, Na ; 2) K, Na, Li ; 3) B, Be, Li ; 4) Sr, Ca, K.
№1 ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона Ионная связь — случай поляризации ковалентной полярной связи (металл + неметалл) Валентность — способность атомов химических элементов образовывать определённое число химических связ..
S + O2 — > SO2 S(0) — 4e — > S( + 4) 1 ок — ие в — ль O2(0) + 4e — > 2O( — 2) 1 в — ие ок — ль 2SO2 + O2 — > 2SO3 SO3 + H2O — > H2SO4 H2SO4 + 2NaOH — > Na2SO4 + 2H2O.
4 — незнаю точно наверное 1 или 2 5 — г 6 — 7 — б 1500 градусов 8 — г 9 — г.
1) Дано : m(Li) = 22 н Найти : m(LiOH) Решение : 2Li + 2H2O = 2LiOH + H2 газ n(Li) = m / M M(Li) = 7 г / моль n(Li) = 22 / 7 = 3 моль По уравнению реакции : n(Li) = n(LiOH) = 3 моль m(LiOH) = n•M M(LiOH) = 7 + 16 + 1 = 24 г / моль m(LiOH) = 24•3 = 72..
2Ca + O₂ = 2CaO Ca⁰ — 2e = Ca⁺² 4 2 кальций восстановитель, процесс окисления O₂ + 4e = 2O⁻² 2 1 кислород окислитель, процесс восстановления H₂ + Cl₂ = 2HCl H₂⁰ — 2e = 2H⁺¹ 2 1 водород восстановитель, процесс окисления Cl₂⁰ + 2e = 2Cl⁻¹ 2 1 хлор окис..
http://www.soloby.ru/1068657/%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B3%D0%BE%D1%80%D0%B5%D0%BD%D0%B8%D1%8F-%D1%81%D0%B5%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%B0-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D0%B5-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D1%83%D1%8E%D1%89%D0%B8%D1%85%D1%81%D1%8F-%D1%81%D0%B3%D0%BE%D1%80%D0%B0%D0%BD%D0%B8%D0%B8
http://himia.my-dict.ru/q/7943087_termohimiceskoe-uravnenie-reakcii-gorenia-serovodoroda-2h2s/