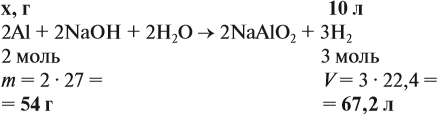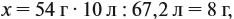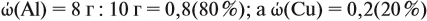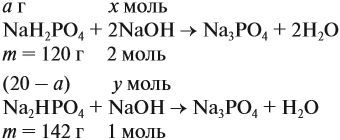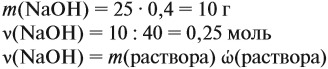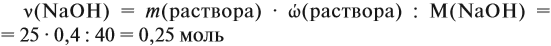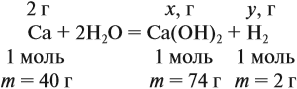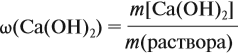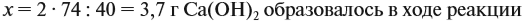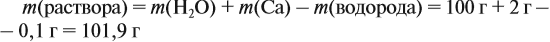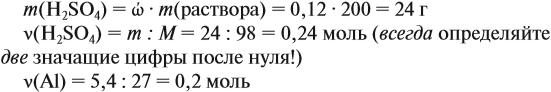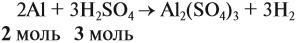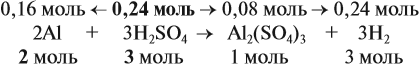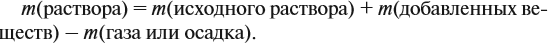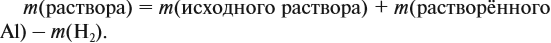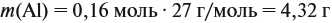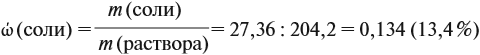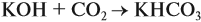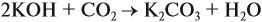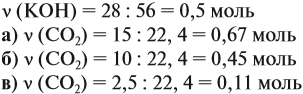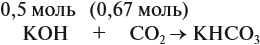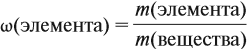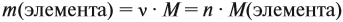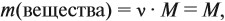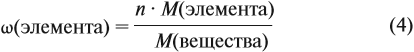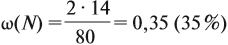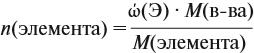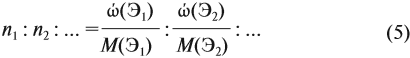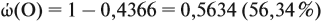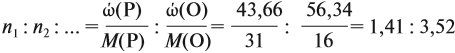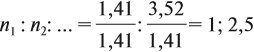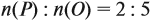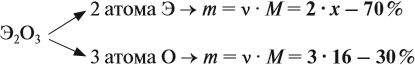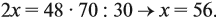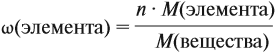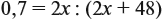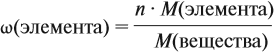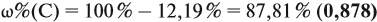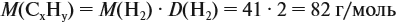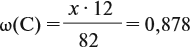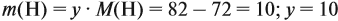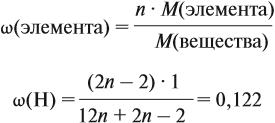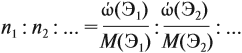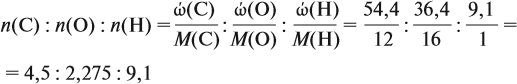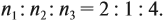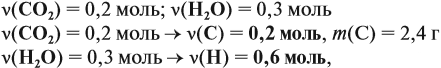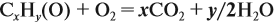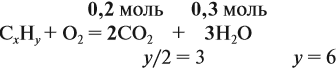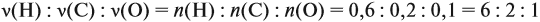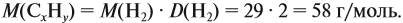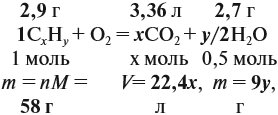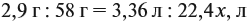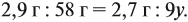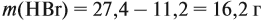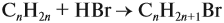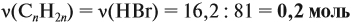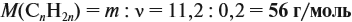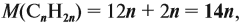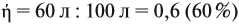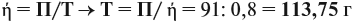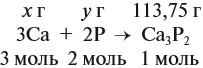По уравнению реакций из задания 5
Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ, упоминаемых в приведённом выше тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Оксид серы (IV) используют в пищевой промышленности в качестве консерванта (пищевая добавка Е220). Поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Это вещество также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Промышленный способ получения этого вещества заключается в сжигании серы или сульфидов. В лабораторных условиях его получают воздействием сильных кислот на сульфиты, например взаимодействием серной кислоты с сульфитом натрия.
При взаимодействии оксида серы (IV) с гидроксидом кальция образуется соль сульфит кальция. Это вещество применяется в промышленности как пищевая добавка Е226, консервант, для приготовления желе, мармелада, мороженого, напитков и фруктовых соков.
1. Составьте молекулярное уравнение реакции сжигания серы, о которой говорилось в тексте.
2. Укажите, с каким тепловым эффектом (с поглощением или выделением теплоты) протекает эта реакция.
1)
2) реакция протекает с выделением энергии (экзотермическая), так как большинство реакций присоединения являются экзотермическими.
1. Составьте молекулярное уравнение упомянутой в тексте реакции между оксидом серы(IV) и гидроксидом кальция.
2. Опишите признаки протекающей реакции между оксидом серы(IV) и раствором гидроксида кальция.
1)
2) в результате реакции образуется нерастворимое вещество – сульфит кальция; наблюдается помутнение исходного раствора (выпадение осадка)
1) — оксид.
2) — основание.
3) — кислота.
4) или
— соль.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
| оксид | основание | кислота | соль |
Прочитайте следующий текст и выполните задания 5—7.
Сульфит натрия — это синтетически созданный консервант, применяющийся в пищевой, фармацевтической и лёгкой промышленности. На этикетках пищевых продуктов сульфит натрия обозначается как Е221. Ещё одно распространённое название этого вещества — Sodium Sulphite. Е221 незаменим в производстве мармелада, зефира, варенья, пастилы, повидла, джема, соков и пюре из фруктов и ягод, ягодных полуфабрикатов, овощного пюре.
Получить сульфит натрия можно в результате реакции сернистого газа с раствором карбоната натрия
или гидроксида натрия
. При действии на сульфит натрия раствора хлороводорода
выделяется сернистый газ, который относят к веществах третьего класса опасности.
1) Составьте одно из молекулярных уравнений реакций получения сульфита натрия;
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1.
2. Данная реакция относится к реакциям замещения.
1) Составьте молекулярное уравнение реакции сульфита натрия с соляной кислотой, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции.
1.
2. Признаком протекания данной химической реакции является выделение бесцветного газа с характерным резким запахом.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является карбонат натрия
Ответ: оксид — основание —
кислота —
соль —
Для графы «соль» возможен также и другой вариант ответа —
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Сульфат меди(II) — важнейшая из солей меди. Кристаллогидрат сульфата меди(II) называют медным купоросом. В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. В промышленности эту соль применяют в производстве ацетатного волокна, а также используют в качестве фиксатора окраски и консерванта. Сульфат меди(II) в промышленности получают различными способами, например растворением оксида меди(II)
в серной кислоте
Эта соль часто служит исходным сырьём для получения других соединений, например гидроксида меди(II)
Для водного раствора сульфата меди(II) возможна реакция с металлами активнее меди, например с цинком. Сульфат меди(II) является соединением с умеренной токсичностью. Однако работать с порошком или пудрой сульфата меди(II) следует осторожно, не допуская их пыления.
1) Составьте молекулярное уравнение реакции цинка с раствором сульфата меди(II);
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1.
2. Данная реакция относится к реакциям замещения.
1) Составьте молекулярное уравнение реакции серной кислоты с оксидом меди(II), о которой говорилось в тексте;
2) Укажите признак(и), который(-е) наблюдается(-ются) при протекании этой реакции.
1.
2. Признаками протекания данной химической реакции являются растворение осадка оксида меди(II) и приобретение раствором голубого оттенка (за счёт образования сульфата меди(II)).
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить серная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является сульфат меди (II)
Ответ: Оксид — основание —
кислота —
соль —
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Железо это блестящий, серебристо-белый, мягкий металл, с давних пор широко применяемый человеком. Известно большое количество руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк магнитный железняк
сидерит
мелантерит
вивианит
Свойства соединений железа в значительной степени зависят от степени окисления железа. Так, в степени окисления +2 железо образует оксид
который проявляет основные свойства, ему соответствует гидроксид
Эти соединения способны реагировать с растворами сильных кислот, например с соляной кислотой (
) с образование хлорида железа (II)
Железо один из самых используемых металлов, на него приходится до 95% мирового металлургического производства. Железо является основным компонентом сталей и чугунов важнейших конструкционных материалов.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава содержится атома углерода и атома водорода. Если взять молекулу такого вещества, то его молекулярная масса будет равна: а.е.м. и там содержится а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
Если вещество имеет общую формулу , то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса атомов равна , масса атомов , масса атомов кислорода
Если записать эту формулу в общем виде, то получится следующее выражение:
| Массовая доля атома Э в веществе = | Атомная масса атома Э | • | число атомов Э в | молекуле |
| Аr(Э) • z | ||||
| —————— | ||||
| Mr(вещ.) | ||||
| Молекулярная масса вещества | ||||
Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение , т.е. простейшая формула бензола — .
Молекулярная формула может совпадать с простейшей или быть кратной ей.
Примеры.
| Вещество | Молекулярная формула | Соотношение атомов | Простейшая формула |
| Этанол | |||
| Бутен | |||
| Уксусная кислота |
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Относительная плотность газа по газу
Относительная плотность — это величина, которая показывает, во сколько раз газ тяжелее газа . Её рассчитывают как отношение молярных масс газов и :
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за г/моль (исходя из примерного усреднённого состава).
Поэтому:
Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять моль газа, то тогда:
а молярную массу газа можно найти, умножая плотность на молярный объём.
Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
| Класс органических веществ | Общая молекулярная формула | Формула с выделенной кратной связью и функциональной группой |
| Алканы | — | |
| Алкены | ||
| Алкины | ||
| Диены | — | |
| Гомологи бензола | ||
| Предельные одноатомные спирты | ||
| Многоатомные спирты | ||
| Предельные альдегиды | ||
| Кетоны | ||
| Фенолы | ||
| Предельные карбоновые кислоты | ||
| Сложные эфиры | ||
| Амины | ||
| Аминокислоты (предельные одноосновные) |
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава соотношение количеств веществ и соответствует соотношению числа их атомов в молекуле:
Решение примера 1.
- Пусть масса вещества равна г. Тогда масса будет равна г, а масса г.
- Найдём количество вещества каждого атома:
моль.
Определяем мольное соотношение атомов и :
(сократим оба числа на меньшее) (домножим на )
Таким образом, простейшая формула .
По относительной плотности рассчитаем молярную массу:
Молярная масса, соответствующая простейшей формуле г/моль, это в раза меньше истинно молярной массы.
Значит, истинная формула .
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
Ты нашел то, что искал? Поделись с друзьями!
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса литра газа при нормальных условиях.
Так как моль вещества занимает объём л, то необходимо узнать, сколько весят л такого газа:
плотность молярный объём г/л л/моль = г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
и молярную массу:
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть .
Решение примера 4.
Общая формула дихлоралкана: , там атома хлора и атомов углерода.
Тогда массовая доля углерода равна:
число атомов в молекуле атомная масса молекулярная масса дихлоралкана
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании моль алкана выделится моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
При пропускании углекислого газа через известковую воду выпадает осадок карбоната кальция:
Масса осадка карбоната кальция — г, молярная масса карбоната кальция г/моль.
Значит, его количество вещества
Количество вещества углекислого газа тоже моль.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно, . Поэтому его общую формулу можно записать как .
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
Находим количества веществ и , и определяем, сколько моль атомов и в них содержится:
На одну молекулу приходится один атом , значит, углерода столько же моль, сколько .
В одной молекуле воды содержатся два атома , значит количество водорода в два раза больше, чем воды.
моль.
Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы и .
Масса всего вещества г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула .
Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул и его молярная масса г/моль):
Истиная формула , её молярная масса .
Решение примера 7.
- Вещество содержит атомы и . Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
Находим количества веществ и , и определяем, сколько моль атомов и в них содержится:
Для этого из массы всего исходного вещества надо вычесть массы и .
Масса всего вещества г.
Истинная молярная масса
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Определение формул веществ по химическим свойствам.
Решение примера 9.
- Общая формула алкадиенов — .
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с моль диена вступят моль брома:
Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г/моль .
Находим формулу алкадиена по его общей формул, выражая молярную массу через :
Решение примера 10.
- Формула предельного одноатомного спирта — Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой .
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
Уравнение гидролиза сложного эфира:
Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
Получим два уравнения, из которых найдём и :
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что .
Можно это сделать математически, если принять, что .
Это аланин — аминопропановая кислота.
Урок 31. Задачи, решаемые по уравнениям реакций
Для того чтобы решить любую задачу из этого раздела, необходимо знать
- теоретические основы задачи;
- общие принципы оформления расчёта по уравнению химической реакции.
Поскольку теоретические основы изложены в различных разделах Самоучителя и других учебниках, нужно перед решением задачи повторить нужный раздел.
Рассмотрим общие принципы оформления расчётов по уравнениям реакций.
Оформление расчётов по уравнениям реакций
Для того чтобы выполнить расчёт по уравнению реакции, нужно:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт.
Разберём этот алгоритм на примере.
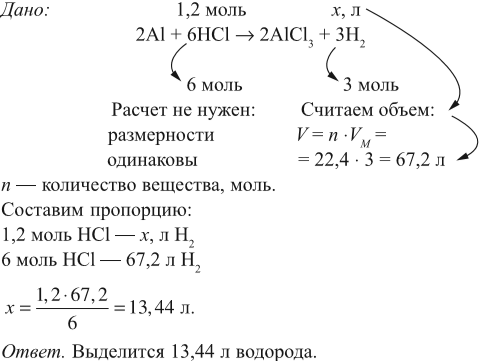
Задача 17. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.
Задача 18. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.
В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача 19. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Задачи для самостоятельного решения
25. Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора? Сколько молей оксида фосфора при этом получится?
26. Сколько молей фосфора нужно сжечь, чтобы получить 28,4 г оксида фосфора V?
27. Какой объём водорода потребуется на восстановление 10,6 г Fe3О4 до железа? (Реакция идет по схеме: МеxОy + Н2 → Ме + H2O.)
28. Какой объём кислорода потребуется для сгорания 8,8 г пропана? (Пропан: С3Н8.)
29. Какой объём кислорода требуется для полного сгорания 5 л этилена С2Н4?
30. Хватит ли 10 л кислорода для полного сгорания 17 л водорода?
32. Какой объём водорода может присоединиться к пропену массой 21 г?
34. Сколько миллилитров бензола (пл.= 0,78 г/мл) можно получить из 56 л ацетилена?
35. Какой объём водорода выделится, если в избыток спирта бросить 0,23 г натрия?
36. Сколько граммов диэтилового эфира можно получать из 23 г этанола?
37. Какой объем этилена должен вступить в реакцию, для того чтобы образовалось 500 мл спирта (пл. = 0,8 г/мл)?
38. Какой объём водорода может присоединиться к 22 г этаналя?
39. Какой объём спирта нужно окислить для получения 11 г этаналя? (плотность спирта равна 0,8 г/мл).
40. Какой объём хлора вступит в реакцию с уксусной кислотой массой 15 г, если в реакции должна получиться хлоруксусная кислота?
41. Какой объём водорода потребуется для гидрирования 0,2 моль триолеина? Где применяется полученный продукт?
42. Какой объём кислорода потребуется для полного сгорания 100 г уксусной кислоты?
Задачи по теме «Количественный состав смесей»
Состав смесей очень часто определяют в различных задачах, например в которых упоминаются растворы. Дело в том, что растворы — это однородные смеси. Задачи такого типа решаются по разному, но в любом случае следует помнить, что массу (объём) смеси нельзя подставлять в уравнение реакции и нельзя находить по уравнению реакции. По уравнению реакции можно найти только массу или объём компонента смеси.
Внимание! Если в условии упоминается смесь веществ или раствор, то составлять уравнения реакций нужно для всех компонентов смеси, указывая, идёт реакция или нет, а затем выполнять расчёт, оформляя решение задачи по каждому уравнению так, как показано выше.
Задачи такого типа можно условно разделить на две группы:
- задачи, в которых имеется хотя бы одна величина, которую можно сразу подставить в уравнение реакции и сделать необходимый расчёт;
- задачи, в которых таких данных нет.
Рассмотрим задачу первого типа.
Задача 20. Смесь меди и алюминия массой 10 г обработали раствором щёлочи. При этом выделилось 10 л газа (н. у.). Определить состав смеси в масс.% (массовые доли алюминия и меди в смеси).
Решение. Составим уравнения реакций:
Составим пропорцию и определим массу алюминия в смеси:
Ответ. ώ(Al) = 80 %, ώ(Сu) = 20 %.
В задачах второго типа в химическом превращении участвуют все компоненты смеси, в результате чего образуется смесь газов или других продуктов реакции. В этих случаях нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в задачи), принимается за известную, и обозначается А.
Задача 21. На нейтрализацию 20 г смеси гидрофосфата и дигидрофосфата натрия потребовалось 25 г 40 %-ного раствора NaOH. Определить состав смеси.
Составим уравнения реакций:
Определим количество вещества NaOH, которое содержится в растворе (можно считать, используя значение массы этого вещества, но более простые числа получаются, если используется величина «моль»):
Внимание: количество вещества щёлочи можно рассчитать сразу:
Теперь используем приём, который был отработан в задаче 16: пусть в смеси содержится а г дигидрофосфата, тогда гидрофосфата содержится (20 — а) г. Подставим эти величины в уравнения реакций и найдём значения х и у:
Поскольку х + у = 0,25 моль, получаем уравнение
Ответ. Смесь состояла из 11,34 г дигидрофосфата и 8,66 г гидрофосфата.
При получении растворов происходят не только физические процессы (дробление вещества, диффузия), но и взаимодействие вещества и растворителя. (Подробнее см. урок 6) Иногда в результате такого взаимодействия образуются совершенно новые вещества. В этом случае необходимо составить уравнение или схему происходящего процесса, а в расчётной формуле указывать, о каком веществе идёт речь.
Задача 22. В 100 мл воды растворили 2 г кальция. Определить массовую долю вещества в полученном растворе.
Решение. Поскольку кальций реагирует с водой, составим уравнение соответствующей реакции:
Таким образом, в растворе содержится не кальций, а гидроксид кальция. Отразим это в расчётной формуле:
Значит, нам нужно вычислить m[Са(ОН)2] по уравнению реакции:
а затем массу раствора:
Обратите внимание: массу полученного раствора вычисляют, исходя из массы исходных веществ или смесей, добавляя к ним массы тех веществ, которые были добавлены, и, вычитая массы веществ, которые вышли из сферы реакции в виде газа или осадка.
Ответ. Массовая доля щёлочи составит 3,6 %.
Задачи для самостоятельного решения
43. Через известковую воду пропустили 3 л воздуха. Выпало 0,1 г осадка. Определить объёмную долю (φ) углекислоты (CO2) в воздухе.
44. 20 г мела опустили в соляную кислоту. При этом выделилось 4 л газа. Определить массовую долю (ώ) карбоната кальция в образце этого мела.
45. В 200 г воды растворили 15 г оксида лития. Найти массовую долю веществ в полученном растворе.
46. 20 г смеси хлорида натрия и карбоната натрия обработали соляной кислотой. При этом выделилось 2,24 л газа. Установить состав смеси в масс.%.
47. Для превращения 2,92 г смеси гидроксида и карбоната натрия потребовалось 1,344 л хлороводорода. Вычислить состав смеси.
48. При растворении 3 г сплава меди и серебра в разбавленной азотной кислоте получено 7,34 г смеси нитратов. Определить процентный состав смеси и объём газов, полученных при прокаливании образовавшихся солей.
49. Сколько граммов 30 %-ной азотной кислоты нужно взять для нитрования 5,6 л пропана?
50. Какой, объём кислорода потребуется для сжигания смеси, состоящей из 8 г метана и 11,2 л этана?
51. Какой объём метана можно получить при нагревании 20 г смеси, содержащей 25 % ацетата натрия, остальное — щёлочь?
52. Через бромную воду пропустили смесь, которая состоит из 8 г метана и 5,6 л этена. Сколько граммов брома вступит в реакцию?
53. Какой объём природного газа, который содержит 98 % метана, потребуется для получения 52 кг ацетилена?
54. Из 10 г загрязнённого карбида кальция получили 2,24 л ацетилена. Чему равна массовая доля карбида кальция в исходном образце?
55. Какой объём кислорода нужен для сжигания смеси, которая состоит из 4 г метана, 10 л этена и 1 моль этина?
56. Сколько граммов 40 %-ной азотной кислоты нужно взять для получения 24,2 г нитробензола?
57. Сколько граммов азотной кислоты потребуется для нитрования 4,7 г фенола, если ώ(кислоты) в исходном растворе равна 30 %.
58. Сколько граммов 30 %-ной муравьиной кислоты нужно для растворения 2,7 г алюминия?
59. Сколько граммов 40 %-ного раствора КОН требуется для омыления (гидролиза) 3 моль тристеарина?
60. Рассчитать объём газа, который должен выделиться при брожении 160 г 20 %-ного раствора глюкозы (брожение прошло полностью).
61. На реакцию с 50 мл раствора анилина пошло 4,2 г брома. Рассчитать массовую долю анилина в исходном растворе (плотность раствора равна единице).
Задачи на «избыток–недостаток»
Такие задачи имеют в условии легко узнаваемый признак: указаны данные для обоих (или всех) реагирующих веществ. В этом случае нужно вначале определить количество (в моль) реагирующих веществ.
Затем по уравнению реакции определить молярные соотношения этих веществ и сделать вывод — какое из них находится в недостатке. Именно по этой величине (в моль!) ведутся последующие расчёты.
Задача 23. Какой объём водорода выделится при взаимодействии 5,4 г алюминия с 200 г 12 %-ного раствора серной кислоты? Чему равны массовые доли веществ в полученном растворе?
Решение. Определим массы и количество вещества для алюминия и серной кислоты:
Составим уравнение реакции:
Из уравнения реакции видно, что молярные соотношения исходных веществ 2 : 3, это означает, что 0,2 моль алюминия реагируют полностью с 0,3 моль серной кислоты, но этой кислоты имеется только 0,24 моль, т. е. недостаток. Укажем количество вещества серной кислоты (0,24 моль) в уравнении реакции и выполним расчёт по коэффициентам:
Теперь можно ответить на все вопросы задачи. Объём водорода рассчитать несложно, поскольку мы уже определили количество (моль) этого вещества.
Задание. Рассчитайте объём водорода.
Для того чтобы определить массовые доли растворённых веществ, нужно установить, какие вещества растворимы. В данном случае — это серная кислота и соль. Но серная кислота вступила в реакцию полностью. Массу соли рассчитайте по количеству вещества её.
Массу раствора всегда следует рассчитывать по формуле:
В данном случае:
Обратите внимание: следует добавить не ту массу алюминия, которую, добавили в раствор, а только ту, которая вступила в реакцию:
Задание. Рассчитайте массу раствора, предварительно рассчитав массу водорода.
Теперь рассчитаем массовую долю соли в полученном растворе:
Ответ. Массовая доля сульфата алюминия равна 13,4 %, а объём водорода 5,4 литра.
Анализ на «избыток — недостаток» позволяет установить и качественный и количественный состав реакционной смеси. Особенно важен этот анализ в случае, когда могут получаться кислые или основные соли.
Задача 24. Установить состав и массу солей, если в раствор, содержащий 28 г КОН пропустить: а) 15 л СО2; б) 10 л СО2; в) 2,5 л СО2.
При решении подобных задач следует учитывать, что при взаимодействии щелочей с многоосновными кислотами или их ангидридами могут получаться как средние, так и кислые соли. В данном случае, если молярное соотношение компонентов 1 : 1, то образуется кислая соль:
А если щёлочь в избытке (2 : 1 и более), то получается средняя соль:
Поэтому в начале нужно рассчитать количество вещества обоих компонентов:
В первом случае (а) ν (СО2) > ν (КОН), поэтому образуется только кислая соль:
В этом случае углекислый газ находится в избытке, а его избыток не может реагировать дальше. Значит, образуется только кислая соль в количестве 0,5 моль (считаем по «недостатку»).
В третьем случае (в) ν (СО2) Задачи для самостоятельного решения
62. Через 200 мл 13 %-ного раствора гидроксида бария (пл. = 1,1 г/мл) пропустили 2 л хлороводорода. Определить цвет индикатора в полученном растворе и массу полученной соли.
63. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59 %-ной ортофосфорной кислоты. Определить состав и массовую долю соли в полученном растворе.
64. 8,4 г карбоната магния растворили в 250 мл 15 %-ного раствора серной кислоты (пл. = 1,08 г/мл). Определить массовую долю соли в полученном растворе.
65. 8,4 г цинка растворили в 70 г 120 %-ной соляной кислоты. Определить массовую долю соли в полученном растворе.
66. 25 л СО2 пропустили через 500 г 7,5 %-ного раствора едкого натра. Рассчитать массовые доли солей в полученном растворе.
67. Рассчитать массовую долю кислоты в растворе, полученном смешением 200 мл 15 %-ного раствора серной кислоты (пл. = 1,2 г/мл) с 150 мл 10 %-ного раствора нитрата бария (пл. = 1,04 г/мл).
68. Какой объём газа выделится, если 3,2 г меди растворить в 50 г 30 %-ной азотной кислоты? Чему равны массовые доли растворённых веществ в полученном растворе?
69. Твёрдое вещество, полученное при прокаливании карбоната кальция, растворили в воде. Через полученный раствор пропустили сернистый газ, в результате чего образовалась кислая соль массой 101 г. Определить массу карбоната и объёмы газов.
70. Смешали 200 г 12 %-ного раствора дигидрофосфата натрия и 150 г 5 %-ного раствора гидроксида натрия. Какие вещества содержатся в полученном растворе? Определить их массовые доли и реакцию среды раствора.
71. Через 100 мл 1,48 %-ного раствора сульфата меди (пл. = 1,08 г/мл) пропустили 300 мл сероводорода. Рассчитать массу осадка и массовую долю кислоты в полученном растворе.
72. Смешали 12 л бутена и 12 л кислорода. Смесь подожгли. Какой из этих газов и в каком объёме останется в смеси после реакции? Какой объём газа и жидкой воды образуется при этом?
73. Вычислить массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия.
74. Сколько граммов карбида кальция, который содержит 16 % примесей, нужно для получения 30 г уксусной кислоты?
Задачи на установление формулы вещества
Молекулярная формула вещества отражает его количественный состав. Количественный состав вещества, как и количественный состав раствора, выражают при помощи массовых долей элементов в нём:
Поскольку масса вещества в условии задачи, как правило, не указывается, применяем уже опробованный способ:
Пусть количество вещества равно 1 моль, тогда:
где n — число атомов этого элемента в веществе;
так как количество вещества равно 1 моль.
Задача 26. Определить массовую долю азота в нитрате аммония.
Решение. Поскольку в молекуле NH4NO3 два атома азота, а Мr(NH4NO3) = 80,
Зная массовые доли химических элементов в веществе (элементный состав), можно определять молекулярную формулу неизвестного вещества.
Задача 27. Массовая доля фосфора в оксиде равна 43,66 %. Установить формулу этого оксида.
Решение. Из формулы (4) следует, что:
Поэтому отношение числа атомов n элементов данном в веществе равно:
Согласно этой формуле, нам нужно найти ώ(О) в этом оксиде:
Подставим все данные в формулу (5):
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число:
Поскольку число атомов не может быть дробным, обе величины умножим на 2:
Ответ. Искомая формула — Р2О5.
Если в задаче не указано, какой элемент входит в состав оксида, но указана его валентность, задача упрощается.
Задача 28. Массовая доля трёхвалентного элемента в оксиде равна 70 %. Установить формулу этого оксида.
Решение. Формула оксида Э2О3:
Из выделенной жирным шрифтом пропорции получаем:
Ответ. Формула оксида Fe2O3.
Эту задачу можно решить и по формуле:
Подставив данные задачи, получаем:
если М(элемента) = х, то М(вещества) равна 2х + 48.
Решите теперь полученное уравнение:
Ответ. х = 56, значит, формула оксида Fe2O3.
Задача 29. Установить формулу углеводорода, если он содержит 12,19 % водорода. Плотность по водороду равна 41.
Решение. Сначала составим общую формулу углеводорода СхHу и рассчитаем массовую долю Н в нём:
где n — число атомов.
По данным задачи рассчитаем массовую долю углерода:
и молярную массу вещества:
Подставив эти данные в формулу, получаем:
Решив полученное уравнение, получаем n = 6 (атомов углерода).
Найдём массу атомов водорода:
Поэтому формула углеводорода С6H10. Если известен гомологический ряд вещества (общая формула этого ряда), то задача упрощается.
Задача 30. Установить формулу алкина, если он содержит 12,19 % водорода.
Решение. Сначала составим общую формулу алкина СnH2n–2 и рассчитаем массовую долю Н в нём:
Решив полученное уравнение, получаем n = 6 (атомов углерода). Поэтому формула алкина С6H10.
Аналогично задаче 27 решаются все задачи, в которых дан элементный состав вещества, независимо от числа элементов.
Задача 31. Установить молекулярную формулу вещества, если оно содержит 54,4 % С, 36,4 % О и 9,1 % Н; D(H2) = 44.
Соотношение числа атомов n элементов в любом веществе равно:
Подставим данные задачи в эту формулу:
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число (2,275):
Получаем состав: С2Н4О. М(С2Н4О) = 44 г/моль, а реальная — 88 г/моль, значит, все индексы следует удвоить. Молекулярная формула вещества С4Н8О2. Это может быть или одноосновная предельная кислота, или её эфир.
Задача 32. При полном сгорании 4,6 г органического вещества получили 8,8 г углекислого газа и 5,4 г воды. Найти молекулярную формулу вещества.
Решение. Определим количества и массы веществ, полученных при сгорании:
поскольку 1 молекула воды (1 моль) содержит два атома (2 моль) этого элемента, поэтому m(Н) = 0,6 г. Суммарная масса этих элементов — 3,0 г. Но сгорело 4,6 г вещества, значит, оно содержит кислород (1,6 г). ν(О) = 0,1 моль.
Составим уравнение реакции горения и подставим полученные данные в уравнение реакции:
получаем молярные соотношения продуктов реакции:
Теперь определим соотношение атомов элементов в исходном веществе, которое равно молярному соотношению элементов в этом веществе:
Молекулярная формула вещества С2Н6О.
Этот способ определения молекулярной формулы оптимален, когда неизвестна молекулярная масса вещества, поскольку, если молярная масса дана и задана в задаче через плотность или иначе, то задача решается «в лоб» — по уравнению химической реакции.
Задача 33. При полном сгорании 2,9 г органического вещества получили 3,36 л углекислого газа и 2,7 г воды. Плотность по водороду равна 29.
Решение. Сначала рассчитаем молярную массу газа:
Теперь составим схему реакции, обозначив формулу исходного вещества СхНу
Из выделенных параметров составим пропорции, сначала для СО2:
а затем для воды:
Решив обе, получаем: х = 3, у = 6, т. е. искомая формула С3Н6.
Теперь нужно проверить соответствие полученной формулы заданной молярной массе: М(С3Н6) = 42 г/моль, что явно меньше 58 г/моль. Значит, в состав исходного вещества входит кислород. Его молярная масса: М(О) = 58 – 42 = 16, т. е. в состав вещества входит 1 атом кислорода.
Искомая формула С3Н6О.
Задача 34. Установить формулу алкена, если 11,2 г его при взаимодействии с бромоводородом образует 27,4 г бромида с положением брома у третичного атома углерода.
Решение. Вначале рассчитаем массу бромоводорода, согласно закону сохранения массы:
и составим уравнение реакции, используя общую формулу алкенов:
откуда найдём количество вещества алкена:
Теперь легко определить молярную массу неизвестного вещества:
Определим молярную массу неизвестного вещества через n:
отсюда: 14n = 56; n = 4.
Ответ. Состав искомого алкена С4Н8; это 2-метилпропен.
Задачи для самостоятельного решения
75. Оксид неметалла (V), содержащего 56,3 % кислорода, растворили в воде. Определить массовую долю вещества в этом растворе, если исходный оксид был получен из 3,1 г неметалла.
76. Какой щелочной металл образует сульфат с массовой долей кислорода 23,9 %?
77. Плотность паров алкана равна 3,214 г/л. Определите его молекулярную массу. Какую формулу имеет этот углеводород?
78. Один литр алкена имеет массу 1,25 г. Определите молярную массу этого вещества. Составьте его графическую формулу.
79. Углеводород с плотностью по гелию 28,5 содержит 15,8 % водорода. Установить его формулу.
80. При сгорании 2,24 л углеводорода получили 8,96 л СО2 и 7,2 мл воды. Определить формулу углеводорода.
81. Органическое вещество содержит 37,7 % С, 6,3 % Н и 56 % Сl; 6,35 г его паров занимает объём 11,2 л. При гидролизе этого соединения образуется вещество, которое при восстановлении даёт вторичный спирт. Определить состав и строение исходного вещества.
82. При сгорании 1 л газообразного углеводорода, обесцвечивающего раствор перманганата калия, расходуется 4,5 л кислорода и образуется 3 л СО2. Определить формулу углеводорода.
83. Установить формулу вещества, при сгорании 4,6 г которого образуется 4,48 л СО2 и 5,4 мл воды. Плотность паров этого вещества по водороду равна 23.
84. При взаимодействии 16 г одноатомного спирта с натрием выделилось 5,6 л водорода. Какой спирт был взят для реакции?
85. Одноосновная кислота имеет состав: ώ(С) = 40 %; ώ(Н) = 6,67 %; ώ (О) = 53,33 %. Плотность паров её по аргону 1,5. Какая это кислота?
86. Определить строение сложного эфира предельной α-аминоуксусной кислоты, если известно, что он содержит 15,73 % азота.
87. Имеется смесь четырёх изомеров, каждый из которых реагирует с НСl и содержит в молекуле 23,7 % азота. Определить строение этих соединений и массу исходной смеси, если известно, что вещества предельные, а при сгорании смеси образуется 4,48 л азота.
Задачи, в которых учитывается «выход» полученного вещества
Реальные химические процессы никогда не происходят со 100 %-ным выходом, который рассчитывается по уравнению реакции. Например, вы рассчитали, что должно выделиться 100 л газа, а реально его получено 60 л. Значит, выход (ή) в этой реакции равен:
Выход продукта выражается в долях единицы или в процентах. В нашем примере:
Задача 35. Рассчитать массы исходных веществ, необходимых для получения 91 г нитрида кальция, что составляет 80 % от теоретически возможного.
Следует помнить, что в уравнение химической реакции можно подставлять данные только теоретического выхода. Поэтому рассчитаем его (Т):
Подставим полученную величину в уравнение реакции и найдём искомые величины:
Задание. Остальной расчёт сделайте самостоятельно.
Задачи для самостоятельного решения
88. Какой объем этилена можно получить из 92 граммов спирта? Выход составляет 80 % от теоретически возможного количества.
89. Сколько граммов хлорвинила можно получить из 56 л ацетилена, если выход составляет 80 %?
90. 46 г глицерина обработали азотной кислотой. Рассчитайте массу полученного вещества, если выход составляет 40 %. Где применяется это вещество?
91. Из 56 л ацетилена получили 88 г этаналя. Рассчитайте выход в % от теоретически возможного.
92. Сколько граммов спирта нужно взять, чтобы получить 7,4 г этилформиата, что составляет 80 % от теоретического выхода?
93. При нагревании 2,84 г иодметана с 0,69 г натрия получено 179,2 мл углеводорода. Определить выход в % от теоретически возможного.
94. 184 г толуола прореагировали с 1,5 моль хлора в присутствии хлорида алюминия. Реакция протекала с выходом 90 % от теоретически возможного. Вычислить объём полученного газа, водный раствор которого не окрашивает раствор фенолфталеина.
95. При нагревании 28,75 мл алканола (ρ = 0,8 г/мл) с концентрированной серной кислотой, получили газ, который может присоединить 8,96 л водорода. Определить строение спирта, если выход газа составляет 80 %.
96. Какой объём 40 %-ного формалина с плотностью 1,1 г/мл можно получить из 48 мл метанола? Плотность спирта 0,8 г/мл. Выход 80 %.
97. Сколько граммов эфира можно получить при взаимодействии 30 г уксусной кислоты и 30 г этанола с выходом 30 %?
http://ege-study.ru/ru/ege/materialy/himiya/zadanie-s5/
http://himi4ka.ru/samouchitel-po-himii/zadachi-reshaemye-po-uravnenijam-reakcij.html