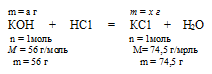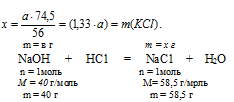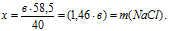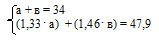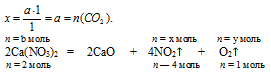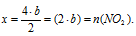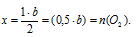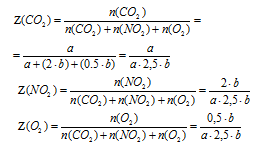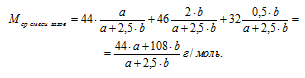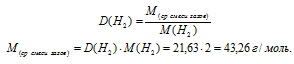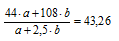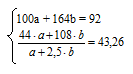По уравнению реакции определите, в каких мольных отношениях следует смешать гидроксид кальция с фосфорной кислотой, чтобы произошла реакция нейтрализации
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df2940a8e7c5971 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Задачи на смеси исходных веществ с параллельно протекающими реакциями 1
Задача 1.
Раствор, содержащий 34 г смеси гидроксида калия и гидроксида натрия нейтрализовали избытком соляной кислоты. В результате образовалось 47,9 г солей. Определите массу каждого из гидроксидов в исходной смеси.
Дано:
масса смеси гидроксидов в исходном р-ре: m(КОН+NаОН) = 34 г;
масса солей после нейтрализации раствора: mсмеси солей = 47,9 г.
Найти:
массу гидроксида калия в исходной смеси: m(КОН) = ?
массу гидроксида натрия в исходной смеси: m(NаОН) = ?
Решение:
Оба компонента смеси (КОН и NаОН) одновременно взаимодействуют с соляной кислотой. Записываем для каждого из веществ смеси свою химическую реакцию:
КОН + НС1 = КС1 + Н2О
NаОН + НС1 = NаС1 + Н2О
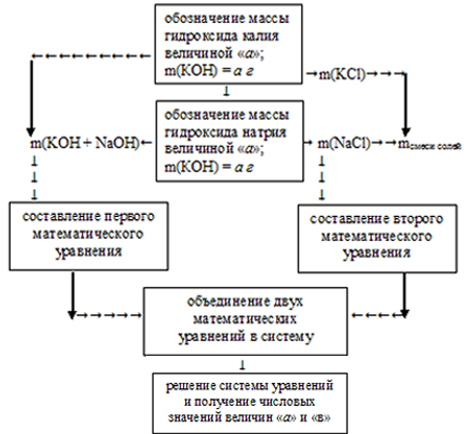
Решить данную задачу можно, применив встречный алгоритм. Его можно представить следующим образом:
В условии требуется определить массу каждого из гидроксидов, поэтому обозначим массу КОН величиной «а» и массу NаОН величиной «в».
1. Используя введенные значения, составим первое математическое уравнение. Для этого приравняем сумму масс гидроксидов к общей их массе в исходном растворе:
а + b= m(КОН + NаОН) = 34 г,
а +b = 34.
Получилось одно математическое уравнение с двумя неизвестными.
2. Теперь, используя величины «а» и «в» как известные, по уравнениям реакций нейтрализации определяем массы полученных солей:
а г КОН дают x г КСl (по условию)
56 г КОН дают 74,5 г КС1 (по уравнению)
в г NаОН дают х г NаС1 (по условию)
40 г NаОН дают 58,5 г NаС1 (по уравнению)
3. Из условия известно, что суммарная масса полученных солей составляет 47,9 г. Используя полученные в предыдущем действии значения, составляем второе математическое уравнение с двумя неизвестными:
m(КС1) + m(NаС1) = (1,33 . а) + (1,46 . b) = 47,9 г
(1,33 . а) + (1,46 . b) = 47,9
4. Объединяем два математических уравнения в систему:
Решение этой системы уравнений дает значения:
а = 13,4 г; в = 20,6 г.
Величиной «а» мы обозначали массу КОН, следовательно:
величиной «в» мы обозначали массу NаОН, следовательно:
Ответ: m(КОН) = 13,4 г; m(NаОН) =20,6 г.
Задача 2.
92 г смеси карбоната кальция и безводного нитрата кальция прокалили до окончания выделения газов. В результате выделилась смесь газов с относительной плотностью по водороду 21,63. Определите массу каждой соли в исходной смеси.
Дано:
масса смеси солей: mисход. cмеси[СаСО3) + Са(NО3)2] = 92 г;
относительная плотность смеси газов по водороду: D(Н2) = 21,63.
Найти:
массу карбоната кальция в исходной смеси: m(СаСО3) = ?
массу нитрата кальция в исходной смеси: m[Са(NО3)2] = ?
Решение:
Запишем реакции разложения каждой из солей:
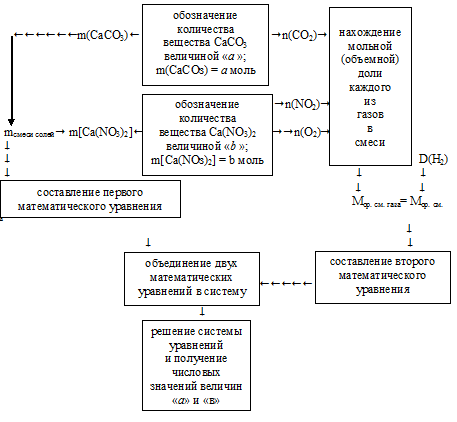
Для решения придется использовать встречный алгоритм:
Применим представленный алгоритм.
1. Искомыми величинами являются массы солей в исходной смеси. Для большего удобства дальнейших расчетов разумнее величиной «а» обозначать количество вещества (n, моль) карбоната кальция: n(СаСО3) = а моль.
Величиной «b» обозначим количество вещества (n, моль) нитрата кальция: n[Са(NO3)2] = b моль.
Соответственно, через молярные массы этих солей можно перейти к массам самих солей:
2. Общая масса исходных солей указана в условии. Это позволяет составить первое математическое уравнение с двумя неизвестными:
(100 . а) + (164 . b) = 92
3. Далее, используя введенные величины «а» и «в», по уравнениям реакций разложения определяем количество вещества каждого из газов:
n = a моль n = x моль
CaCO3 = CaO + CO2 ↑
n = 1 моль n = 1моль
а моль СаСО3 дают х моль СО2 (по данным условия)
1 моль СаСО3 дают 1 моль СО2 (по уравнению)
b моль Са(NO3)2 дают х моль NО2 (по данным условия)
2 моль Са(NO3)2 дают 4 моль NО2 (по уравнению)
b моль Са(NO3)2 дают у моль О2 (по данным условия)
2 моль Са(NO3)2 дают 1 моль О2 (по уравнению)
4. Определим мольную долю каждого из газов в смеси (в долях от единицы).
5. Определим среднюю молярную массу смеси газов по значениям их мольных долей в смеси.
Мcр.смеси газов = М(СО2) . (СО2) + М(NО2) . (NO2) + М(O2) . (О2)
По закону Авагадро мольная доля газа в смеси численно равна объемной доле (только для газов), поэтому в формулу для определения Мcредн. вместо объемной доли (Z) подставляем
значение мольной доли ( ) соответствующего газа.
6. Определим среднюю молярную массу смеси газов по данным об относительной плотности.
7. Приравнивая друг другу выражения Мср. смеси газов полученные в двух предыдущих действиях, составляем второе математическое уравнение:
8. Объединяем уравнения, полученные во втором и седьмом действиях в систему
При ее решении получаются значения: а = 0,1; b = 0,5.
Величинами «а» и «b» мы обозначали количество вещества СаСО3 и Са(NO3)2 в исходной смеси солей, следовательно:
9. Определяем массы солей в исходной смеси:
m(СаСО3) = n(СаСО3) . М(СаСО3) = 0,1 . 100 = 10 г;
m[Са(NO3)2] = n[Са(NO3)2] . M[Са(NO3)2]) = 0,5 . 164 = 82 г.
Ответ: m(СаСО3) = 10 г; m[Са(NO3)2] = 82 г.
Комментарии:
1 С химической точки зрения в задачах этой группы происходит взаимодействие какого-либо одного реактива со смесью веществ. Причем все вещества смеси участвуют в реакции, но для каждого из них записывается свое химическое уравнение.
Это, так называемые, параллельные реакции. Селективные же реактивы, для выявления количества какого-либо одного участника смеси не используются. В условии задачи чаще всего присутствует информация об общем количестве исходной смеси и об общем количестве расходовавшегося реактива либо образовавшегося продукта. По этим данным обычно требуется выявить количественный состав исходной смеси.
Основная особенность этих задач заключается в том, что при их решении применяют встречный алгоритм с составлением системы математических уравнений. Рассмотрим несколько примеров решения подобных задач.
http://gomolog.ru/reshebniki/8-klass/rudzitis-i-feldman-2019/47/zadanie-4.html
http://buzani.ru/zadachi/ege-khimiya/1071-smesi-iskhodnykh-veshchestv-s-parallelno-protekayushchimi-reaktsiyami-zadachi-1-2