Плавиковая кислота. Свойства и применение плавиковой кислоты
Плавиковая кислота и флюорит. Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли. В 1779 году они доказали, что флюорит, называемый в народе плавиковым шпатом, является кальциевой солью неизвестной кислоты.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15 веке. Он- то и нарек его флюоритом, от латинского fluor – «течь».
Имя объясняется применением породы в качестве флюса. Его добавка к шихте снижает температуру ее плавления. Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота, и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор, соединяясь с водородом. Получается фтороводород. То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810 году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору. Название нового элемента «фтор» закрепилось лишь в России, переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом. Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой. Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке. Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло. Это инертный материал, не подвластный другим кислотам. Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17 столетии. Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты. Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови.
Выявлен слабый наркотический эффект. Все вкупе дает 2 класс опасности. Он присвоен кислоте официально. Попадая на кожу, фтор водород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог. Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках. Разъедая стекло, прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин. Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец. Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику. Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение, естественно, находит в стекольной промышленности. Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь, убирая с его поверхности все шероховатости. В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли. Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики. Цель – обеспечить максимально надежное крепление коронки к остаткам зуба. Лучше стандартного цемента с этой задачей справляются полимеры – новое слово в стоматологии.
Полимеры заполняют пустоты, оставшиеся от лейцита. Таким образом, живые ткани и протез скрепляются, как говориться, намертво. При этом, полимеры оставляют возможность минимальных подвижек, без растрескивания, а значит, и разгерметизации коронок.
Однако, основным потребителем фтороводорода остается нефтехимическая промышленность. В ней плавиковая кислота, так же, нужна для обработки, очистки поверхностей. В частности, соединение пригождается в призабойных зонах добывающих скважин.
В нагнетательных реагент тоже используют. В сочетании с другими кислотами, к примеру, соляной, плавиковая кислота удаляет со стенок аппаратуры отложения асфальтов и парафинов. Это повышает эффективность нефтедобычи.
Кислота фтористоводородная плавиковая применяется и в алюминиевой промышленности. Реагент непосредственно участвует в электролитическом способе получения 13 металла.
Кислота присутствует в фильтровочных системах. Теперь выясним, где найти реагент в природе. Является ли флюорит единственным источником фтороводорода?
Добыча плавиковой кислоты
Плавиковый шпат – источник для получения фтороводорода, но не он сам. В чистом виде кислоту в природе не встретишь, если, конечно, не подойдешь к активному вулкану. В его газах фтороводород встречается. Благо, флюорит – распространенный минерал. Промышленники не испытывают дефицита в сырье.
Получение плавиковой кислоты из шпата основано на его обработке серной кислотой. Требуется концентрированный реагент, 90 или 92-процентный. В общем, производят кислоту, как и 300 лет назад, по методу Шванкварда. Взаимодействие выглядит так: — CaF2 + H2SO4 -à2HF + CaSO4.
Для взаимодействия нужен измельченный флюорит. Минерал обрабатывают в щековых и конических дробилках.
С серной кислотой крошку соединяют в специальных смесителях. Реакция запускается почти моментально. Образующийся оксид кальция ведет к затвердению массы. Поэтому, продолжительность ее пребывания в смесителе должна быть минимальной.
Реакция протекает при температуре от 220 до 280 градусов Цельсия. Если снизить жар, образуется фторсульфоновая кислота.
Избавление от нее осложняет производство. Мешает ему и образование сульфата кальция. Он обволакивает частицы измельченного шпата, не давая реакции проходить эффективно.
Цена плавиковой кислоты
Цена реагента зависит от его чистоты и концентрации. Обычно выпускаются 40, 60 и 70-процентные растворы фтороводорода. С точки зрения чистоты кислота делится на техническую и обычную. 70 процентный раствор последний, к примеру, стоит в районе 210-250 рублей за килограмм.
Техническая версия реагента, обычно, 40-процентная. За килограмм дают 35-60 рублей. Поставки от одного кило осуществляют не все. Большинство производителей работают только с оптовиками.
В этом случае, ценник уменьшается. Купить плавиковую кислоту 70% можно и за 170 рублей за кило. Кроме стандартных, встречаются предложения, к примеру, 85-процентной кислоты. Такую поставляют, в основном, из Китая.
Некоторые предприятия России тоже готовы отработать нестандартные заказы при больших объемах закупок.
Плавиковая кислота
| Плавиковая кислота | |
|---|---|
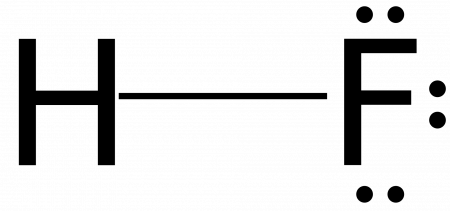  | |
 | |
| Систематическое наименование | фтороводород |
| Традиционные названия | плавиковая кислота |
| Хим. формула | HF |
| Состояние | бесцветная жидкость |
| Молярная масса | 20.0063 г/моль |
| Плотность | 1,258 (70 %) |
| Температура | |
| • плавления | −75 (70 %) |
| • кипения | 85,8 (70 %) °C |
| • вспышки | негорючая °C |
| Константа диссоциации кислоты pKa | 3,17 |
| Растворимость | |
| • в воде | смешивается |
| ГОСТ | ГОСТ 10484-78 |
| Рег. номер CAS | 7664-39-3 |
| Рег. номер EINECS | 231-634-8 |
| RTECS | MW7875000 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Плавиковая кислота (фтороводородная кислота, фтористоводородная кислота, гидрофторидная кислота) — водный раствор фтороводорода (HF). Промышленностью выпускается в виде 40 % (чаще), а также 50 % и 72 % растворов. Название «плавиковая кислота» происходит от плавикового шпата, из которого получают фтороводород. Соли плавиковой кислоты называют фторидами, все растворимые в воде фториды токсичны.
Содержание
- 1 Свойства
- 1.1 Физические
- 1.2 Химические
- 2 Техническая плавиковая кислота
- 3 Применение
- 4 Токсичные свойства
Свойства
Физические
Бесцветная легкоподвижная жидкость с резким запахом и обжигающим «уксусным» вкусом. Растворение фтористого водорода в воде сопровождается довольно значительным выделением тепла (59,1 кДж/моль). Для него характерно образование содержащей 38,6 % HF и кипящей при 114 °C азеотропной смеси (по другим данным 37,5 % и tкип 109 °C). Такая азеотропная смесь получается в конечном счёте при перегонке как концентрированной, так и разбавленной кислоты.
При низких температурах фтористый водород образует нестойкие соединения с водой состава H2O·HF, H2O·2HF и H2O·4HF. Наиболее устойчиво из них первое (tпл −35 °C), которое следует рассматривать как фторид гидроксония — [H3O]F. Второе является гидрофторидом гидроксония [H3O][HF2].
Химические
Плавиковая кислота — кислота довольно слабая (средней силы) (константа диссоциации составляет 6,8⋅10 −4 , степень диссоциации 0,1 н. раствора 9 %), однако она разъедает стекло и другие силикатные материалы, поэтому плавиковую кислоту хранят и транспортируют в полиэтиленовой таре.
Реакция идёт с выделением газообразного фторида кремния (SiF4):
Реагирует со многими металлами с образованием фторидов (свинец не растворяется в плавиковой кислоте, так как на его поверхности образуется нерастворимый фторид PbF2; платина, палладий и золото также не растворяются), не действует на парафин, который используют при хранении этой кислоты.
Техническая плавиковая кислота
Техническая плавиковая кислота обычно содержит ряд примесей — Fe, Rb, As, кремнефтористоводородную кислоту H2SiF6, SO2 и др.
Для грубой очистки её перегоняют в аппаратах из платины или свинца, отбрасывая первые порции дистиллята.
Для получения более чистой кислоты техническую кислоту переводят в гидрофторид калия, затем разлагают его нагреванием, растворяя фтористый водород в дистиллированной воде.
Крепкая плавиковая кислота (более 60 % HF) может сохраняться и транспортироваться в стальных ёмкостях, но разъедает стекло. Для хранения плавиковой кислоты и работы с ней в лабораторных условиях требуются сосуды из тефлона, полиэтилена и других пластмасс.
Применение
Крупный потребитель фтороводородной кислоты — алюминиевая промышленность.
- Раствор фтороводорода применяется для прозрачного травления силикатного стекла (например — нанесение надписей — для этого стекло покрывают парафином, прорезая отверстия для травления). Матовое травление получают в парах фтороводорода.
- Для травления кремния в полупроводниковой промышленности.
- В составе травильных, травильно-полировальных смесей, растворов для электрохимической обработки нержавеющей стали и специальных сплавов.
- Получение фторидов, кремнефторидов и борфторидов, фторорганических соединений, а также соответствующих кислот (кремнефтороводородная кислота и борфтороводородная кислота), синтетических смазочных масел и пластических масс.
- Для растворения силикатов при различного рода анализах.
- В процессе алкилирования, в качестве катализатора в реакции изобутана и олефина.
Токсичные свойства

Обладает выраженным эффектом при вдыхании, раздражающим действием на кожу и слизистые оболочки глаз (вызывает болезненные ожоги и изъязвления); кожно-резорбтивным, эмбриотропным, мутагенным и кумулятивным действием. Ей присвоен второй класс опасности для окружающей среды; чистый фтороводород также принадлежит ко второму классу опасности.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При попадании в кровь через кожу связывает кальций крови и может вызвать нарушение сердечной деятельности. Ожоги площадью более чем 160 см 2 опасны возможными системными токсическими проявлениями.
Токсичность плавиковой кислоты и её растворимых солей предположительно объясняется способностью свободных ионов фтора связывать биологически важные ионы кальция и магния в нерастворимые соли ( отравление фторидами ). Поэтому для лечения последствий воздействия плавиковой кислоты часто используют глюконат кальция, как источник ионов Ca 2+ . Пострадавшие участки при ожогах плавиковой кислотой промываются водой и обрабатываются 2,5 % гелем глюконата кальция. Тем не менее, поскольку кислота проникает сквозь кожу, простого промывания недостаточно и необходимо обращение к врачу для проведения лечения. Высокую эффективность показали внутриартериальные инфузии хлорида кальция.
Предельно допустимая концентрация (ПДК) плавиковой кислоты:
Соединения фтора
Фтороводород, плавиковая кислота (HF)
Способы получения фтороводорода
- Из простых веществ:
- Действие концентрированной H2SO4 на фториды металлов:
Физические свойства и строение фтороводорода
Фтороводород HF — бесцветная легкоподвижная и легкоиспаряющаяся жидкость с резким, удушающим запахом.
По сравнению с другими галогенводородами HF имеет аномально высокие Тпл. (
83°С) и Ткип. (19,5°С), т.к. молекулы HF объединяются водородными связями в прочные ассоциаты (HF)n :
Плавиковая кислота
Фтороводород неограничено растворяется в воде с образованием раствора слабой кислоты (Кдисс = 6,8-10 -4 ). Плавиковая кислота растворяет кварц, стекло и все силикаты, по причине чего и получила такое название.
Химические свойства фтороводорода
Общие свойства кислот
Проявляет все свойства кислот.
- Взаимодействие с металлами:
Металлы легко окисляются плавиковой кислотой, однако некоторые металлы образуют на поверхности малорастворимую защитную пленку фторидов, поэтому в кислоте не растворяются (например, Pb).
На платину и золото плавиковая кислота не действует.
Эффективным растворителем металлов является смесь HF и HNО3:
- Взаимодействие с неметаллами:
HF и смесь HF + HNО3 взаимодействуют с кремнием:
- медленно растворяет оксид кремния SiО2 :
Фторноватистая кислота (фтороксигенат(0) водорода) HOF
HOF — бесцветные жидкость и газ (выше 0ºС). Соединение весьма летучее и термически неустойчивое. Кислотных свойств не проявляет, солей не образует. Однако ковалентные производные формального замещения водорода называют гипофторитами.
Получение фторноватистой кислоты
- Получают при фторировании льда при температуре −40 C:
Химические свойства фторноватистой кислоты
- Разлагается при температуре 19 °С:
Разложение часто сопровождается взрывом
HOF + 2NaOH = NaF + NaHO2 + H2O
http://chem.ru/plavikovaja-kislota.html
http://zadachi-po-khimii.ru/neorganicheskaya-ximiya/soedineniya-ftora.html






