Атомы и электроны
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s 2 )
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s 2 2s 2 2p 2
- Серы — 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
- Углерод — 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s 2 2s 2 2p 6 3s 2
- Скандий — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Движение электронов в атомах
Содержание:
Движение электронов в атоме — это когда электрон в атоме находится в постоянном движении вокруг ядра. Но у такого движения отсутствует определенная траектория. Это выглядит примерно так, как показано на рисунке снизу. В каждый момент времени электрон находится в определенной точке околоядерного пространства.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Движение электронов в атомах
Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон. . Размер зависит от энергии электрона. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Распределение электронов в атомах
Вспомните! Атом, молекула. Строение атома
Из курса 7 класса мы узнали, что атом является сложной системой, состоящей из ядра и электронов (рис. 1). Выясним теперь закономерности расположения электронов вокруг ядра. Число электронов равно заряду ядра атома (атомному номеру элемента). Однако
электроны притягиваются к ядру не с одинаковой силой, так как обладают различным запасом энергии и поэтому находятся на разном расстоянии от ядра.
Электроны с близкими значениями энергии располагаются на одинаковом расстоянии от ядра. Эти расстояния называются энергетическими уровнями. Их обозначают буквой n и нумеруют по мере удаления от ядра: 1, 2, 3, 4, 5, 6, 7. Значение n определяется номером периода, в котором расположен элемент. Максимальное число электро-
нов на каждом энергетическом уровне (емкость энергетического уровня)
определяется формулой 
энергетического уровня. Если n = 1, N = 2; n = 4, 
Электроны, расположенные ближе к ядру, сильнее притягиваются к
нему. По мере отдаления от ядра энергия связи уменьшается. Радиус r показывает удаленность каждого энергетического уровня от ядра.
Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни (рис. 2). Почему так важно знать, как располагаются электроны в атоме? Потому что от строения электронных оболочек элемента зависят его физические и химические свойства (табл. 1). Потому что при непосредственном участии электронов атомов происходят образование и разрыв химических связей, т. е. протекают химические реакции. Скорость движения электрона очень велика, и определить его положение в пространстве в определенный момент времени невозможно. В одном месте пространства его можно обнаружить часто, в другом – редко. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью (s, p, d, f).
Форма электронных облаков различная: сферическая обозначается буквой s (s-облако); гантелеобразная – р-облако, причем р-облака ориентированы взаимно перпендикулярно вдоль трех осей x, y, z (рис. 3).
s-oблако может располагаться в пространстве симметрично точке пере-
сечения осей координат, поэтому его обозначают одной ячейкой 
может располагаться вдоль трех осей x, y, z, поэтому их обозначают 
или тремя ячейками 
Электроны вращаются не только вокруг ядра, но и вокруг своей оси, как
Земля вокруг Солнца и своей оси.
Вращение электрона вокруг своей оси называют спином (от англ. spin – волчок). Электроны могут вращаться по часовой стрелке или против нее. На каждой орбитали могут располагаться только два разнонаправленных электрона. Поэтому при составлении электронно-графических формул атомов электроны изображают в ячейке двумя разнонаправленными стрелками
Электронное облако, энергетический уровень, электронная формула, ячейка, спин.
Электронные формулы атомов
Теперь перейдем к рассмотрению электронных формул атомов. Начнем с первого элемента в таблице Менделеева – атома водорода. У атома водорода имеется один электрон, который расположен на s-подуровне первого энергетического уровня, поэтому электронная формула атома водорода 

В Периодической системе атомы водорода и гелия расположены в 1-м периоде, т. е. у этих элементов запас энергии электронов одинаковый, поэтому они находятся на одном энергетическом уровне. Согласно формуле 
Следующий: литий – элемент 2-го периода. У лития имеются два энергетических уровня вокруг ядра, внутренний повторяет электронное строение атома гелия. Два его электрона находятся на первом энергетическом уровне, третий электрон – на втором. Во 2-м периоде п = 2,

У атома неона второй энергетический уровень заполнен электронами, т. е.
второй слой завершен.
Такая закономерность повторяется на третьем энергетическом уровне – от натрия до аргона. У элементов этого периода строение внутренних двух уровней повторяет структуру неона (табл. 2).
У атома аргона завершается третий энергетический уровень. Элементы, у которых внешний энергетический уровень завершен, обладают инертностью.
После аргона в таблице расположен калий. У атома калия следующий электрон образует новый, четвертый энергетический уровень, а внутренние три уровня повторяют электронное строение аргона (табл. 1).
При сравнении электронной структуры элементов 2-го и 3-го периодов заметно, что число электронов на внешнем энергетическом уровне у атомов лития, натрия и калия одинаковое 
Такие сходства в структурах внешних уровней наблюдаются у элементов, расположенных в одной группе, например, у фтора и хлора 7 электронов. У неона и аргона на внешних энергетических уровнях по 8 электронов.
Каждый период (кроме 1-го) начинается с щелочного металла и заканчивается инертным газом. По периодам слева направо число электронов увеличивается от 1 до 8, электроны внешнего энергетического уровня слабее притягиваются к ядру. У элементов главных (А) подгрупп электроны внешнего энергетического уровня являются валентными, т. е. определяют валентность элемента (табл. 3).
Рассмотренные 20 элементов являются элементами главных подгрупп, их очередные электроны помещаются на внешних s— и р-подуровнях, поэтому их называют s— и р-элементами.
К s-элементам относятся элементы главных подгрупп I и II группы; к р-элементам – элементы главных подгрупп III–VIII группы. Объединение элементов в одну группу объясняется одинаковым числом у них валентных электронов.
Ознакомившись с электронным строением атома, мы можем дать следующее определение периодов и групп в Периодической системе:
Периодами называются горизонтальные ряды элементов с одинаковым числом энергетических уровней, начинающиеся со щелочного металла и заканчивающиеся инертным газом (кроме 1-го периода).
Группами называются вертикальные ряды элементов с одинаковым числом валентных электронов.
Электронная формула, электронно-графическая формула, s-, р-элементы.
Лабораторный опыт №1
изготовление моделей атомов
Цель работы: изготовить модели атомов.
Оборудование: разноцветный пластилин, шаростержневые модели атомов.
Ход работы
Атомы элементов можно смоделировать с помощью разноцветного пластилина (рис. 4, 5).
Смоделируйте атомы: водорода, углерода, серы, йода, кислорода, железа. Подберите цвета пластилина или готовых шариков таким образом, чтобы цвета соответствовали простым веществам: водород –бесцветный (можно белый); углерод – черный; сера –желтая; йод – темно-красный; кислород – бесцветный (можно голубой или синий, т.к. сжиженный кислород голубого цвета); железо – серый.
Образование ионов
Вспомните! Cтроение атома, завершенный слой, электронная конфигурация элемента
После ознакомления с электронным строением атомов можно приступить к изучению способности элементов образовывать химические соединения.
Каждый период в системе заканчивается инертным газом. Как вы думаете, почему они так инертны? Для выяснения этого вопроса рассмотрим электронные структуры этих элементов. Нам известно строение атомов 


У других элементов химическая активность определяется именно этой недостроенностью внешнего электронного слоя. Они могут завершить внешние электронные слои путем отдачи или присоединения электронов при образовании соединений (рис. 7).
Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу, которые называются ионами, т. е. имеют завершенный энергетический уровень.
А это зависит от двух факторов:
1) от электронного строения атомов;
2) от радиуса атомов.
Заряды ионов пишутся арабскими цифрами сверху
над символом элемента, знак заряда указывается после
числового значения: например:
У элементов, расположенных в начале периодов, на внешней орбитали электронов мало (1–3). Поэтому они легко отдают эти электроны, принимая при этом электронное строение инертного газа, которым заканчивается предыдущий период. А у элементов, расположенных в конце периодов, число электронов на внешнем уровне больше, поэтому они легко принимают электроны. При этом они принимают конфигурацию инертного газа, которым заканчивается данный период. По периодам число электронов на внешнем электронном уровне (валентные электроны) постепенно увеличивается. Слева направо увеличиваются заряды ядер атомов. То есть в этом направлении усиливается способность принимать электрон.
Напишем формулы валентных электронов элементов III периода. Определим число неспаренных электронов и число электронов, недостающих до завершения энергетического уровня (табл.4).
Рассмотрим, как заряжаются атомы элементов при образовании соединения с изменением их электронных структур.
Для завершения внешнего слоя атому хлора недостает лишь одного электрона, поэтому он принимает один электрон от атома магния, превращаясь при этом в отрицательно заряженный ион.
А у атома магния на внешнем слое имеются два электрона, он отдает каждому атому хлора по одному электрону, т. е. требуется два атома хлора.
Как изменяются эти свойства по группам? Число валентных электронов одинаковое у элементов, расположенных в одной группе. А число электронных слоев, т. е. атомных радиусов в этом направлении, увеличивается. По этой причине усиливается способность отдать электрон 
Способность элемента отдать электрон характеризует металлические а принимать — неметаллические свойства.
Для выяснения этого вопроса рассмотрим электронное строение и значения атомных радиусов элементов IA и VIIA групп (табл. 5).
По периодам слева направо металлические свойства ослабевают, неметаллические свойства постепенно усиливаются;
По группам сверху вниз усиливаются металлические свойства.
Ионы, условия образования положительно и отрицательно заряженных ионов.
Составление формул соединений
По пройденным материалам вы знаете, что атомы являются электронейтральными частицами. Потому что количество электронов, которые вращаются вокруг ядра, численно равно заряду ядра, точно так же, абсолютные значения положительно и отрицательно заряженных частиц, составляющих молекулу, будут равны. Поэтому и молекула электронейтральна.
Теперь попытаемся составить формулу обыкновенной поваренной соли. В состав этого вещества входят элементы натрий и хлор в виде ионов. А образование этих ионов вам знакомо из предыдущего параграфа. Теперь обратим внимание на числовые значения зарядов данных ионов:
При образовании иона натрия заряд ядра превышает на единицу общее количество электронов, которые вращаются вокруг ядра.
А при образовании ионов хлора, наоборот, общее количество электронов становится больше на единицу, чем заряд ядра.
При написании формул бинарных (состоящих из двух элементов) соединений мы должны придерживаться такого правила:
В молекулах бинарных соединений положительно заряженная частица
пишется (в основном) на первом месте, отрицательная – на втором.
В соединениях, состоящих из элементов металла и неметалла, частицы атомов металла всегда положительно заряжены, а неметаллы – отрицательно.
Тогда формула поваренной соли выглядит так: NaCl (хлорид натрия).
В название бинарных соединений к международному или сокращенному названию элемента добавляется окончание ид, 


Далее рассмотрим составление формулы хлорида магния:
Используя правило «нулевой суммы», составим такое уравнение:
+2 + (–1)х = 0 ⇒ х = 2, следовательно, формула вещества:
І. Рассмотрим примеры составления формул и определения зарядов элементов соединений по этому способу.
Пример 1. Составьте формулу оксида трехвалентного элемента.
1. Напишем схему формулы оксида трехвалентного элемента –
2. Укажем заряды элементов в этом соединении: 
3. Находим значение наименьшего кратного абсолютных значений зарядов атомов элементов (3 · 2 = 6).
4. Разделив значение наименьшего кратного на абсолютное значение зарядов элементов, запишем их как индексы при них:
6 : 3 = 2, 6 : 2 = 3; х = 2, у = 3;
тогда формула оксида
Алгебраическая сумма зарядов элементов в соединении равна нулю.
+3 · 2 = +6; –2 · 3 = –6; +6 + (–6) = 0
II. Если дана формула вещества, можно определить заряды элементов в
соединении.
Пример 2. Определите заряд фосфора (V) в его оксиде.
1. 
2. В соответствии с вышеуказанным правилом, составляем уравнение с
одним неизвестным:
2х + 5 · (–2) = 0; 2х = +10; х = +5

Метод «нулевой суммы»
- 1. Электроны заселяют пространство вокруг ядра поэтапно, образуя энергетические уровни.
- 2. Область пространства, в которой вероятность нахождения электронов максимальна, называется электронным облаком, или орбиталью. Формы s-облаков — сферическая, а р-облаков — гантелеобразная.
- 3. Изображение электронов в атоме с помощью электронных облаков и распределение по уровням и подуровням называется электроннографической формулой.
- 4. Если элемент отдает электрон, он превращается в положительно заряженную частицу, а если принимает электрон — в отрицательно заряженную частицу. Эти заряженные частицы называются ионами.
- 5. Алгебраическая сумма зарядов элементов в соединении равна нулю.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Переходы внутренних электронов в атомах
Вы будете перенаправлены на Автор24
Переходы внутренних электронов в атомах
Если рассматривать электромагнитные переходы валентных (внешних) электронов, то они связаны с излучением волн, длины которых находятся в оптическом диапазоне (это инфракрасная, видимая и ультрафиолетовая области спектра излучения). При переходах, которые связаны с изменением состояния внутренних электронов, возникает линейчатое рентгеновское излучение. Энергия квантов рентгеновского излучения может достигать значений порядка $<10>^5эВ$.
Самым существенным отличием рентгеновских от оптических спектров является то, что рентгеновские спектры разных элементов схожи друг с другом, тогда как оптические спектры являются индивидуальными. Данный факт объясняют тем, что изменение числа электронов на внешней оболочке ведет к радикальным изменениям в спектре энергии. Внутренние электроны атомов находятся в потенциальном поле ядра, которое частично экранируется оболочкой электронов. Как следствие, энергия внутренних электронов изменяется плавно при изменении заряда ядра, при этом качественного структурного изменения спектра не происходит.
Электроны внутренних оболочек атомов, прежде всего, взаимодействуют с ядром атома, и только в следующую очередь между собой. Потенциал ядра можно считать кулоновским, а взаимодействие электронов при необходимости учитывают, применяя теорию возмущений. Это означает то, что внутренние электроны атома могут быть описаны в одночастичном приближении. При этом их волновые функции и положения энергоуровней можно считать водородоподобными. Довольно часто при описании спектра энергий внутренних электронов в атоме используют приближение так называемого эффективного заряда:
где $n$ — главное квантовое число, $l$ —орбитальное квантовое число, $<\sigma >_
Готовые работы на аналогичную тему
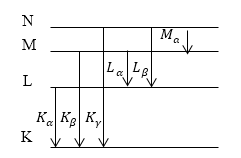
Если удалить один из электронов атома, локализованный на K- оболочке атома со многими электронами. В таком случае становятся возможны переходы электронов на $K$ — оболочку с оболочек более высоких ($L,M$. ). При этом появляется $K$- серия рентгеновского излучения (рис.1). Номера линий в серии обозначаются при помощи букв греческого алфавита. Так, переход с оболочки $L$ на $K$- оболочку образует линию $K_<\alpha >$ рентгеновского излучения, при переходе с $M$ — оболочки на $K$- оболочку возникает $K_<\beta >$ линия и т.д. При создании вакантного места на атомной $L$ — оболочке переходы с атомных оболочек, которые расположены выше, создают $L$ — серию рентгеновского излучения. Следом возникает $M$ — серия линейчатого рентгеновского излучения.
Если использовать выражение (1) для энергии внутреннего электрона, находящегося в атоме, можно получить формулу для расчёта частот квантов характеристического излучения для элемента, который имеет заряд ядра равный $Z$:
где $<\sigma >_1\ $- постоянная экранирования для нижнего состояния, $<\sigma >_2\ $- постоянная экранирования для верхнего состояния между которыми происходит переход с испусканием рентгеновского кванта. Разница между $<\sigma >_1\ $и $<\sigma >_2$ очень мала, поэтому чаще всего используют эффективную постоянную $\sigma $ для того и другого состояния. В таком случае выражение (2) преобразуется к виду:
Выражение в виде (3) для возможных величин частот линейчатого рентгеновского излучения практически совпадает с обобщенной формулой Бальмера, которая определяет закономерности спектра в атоме водородоподобных ионов.
Рассмотрим выражение (3). Если $n_1=1,$ $n_2\ge 2$, то мы имеем дело с $K$ — серией рентгеновского излучения. При $n_1=2,$ $n_2\ge 3$ получим $L$ — серии, при $n_1=3,$ $n_2\ge 4$ — $M$ — серии. Кроме того из выражения (3) получим, что энергия рентгеновского кванта $K_<\alpha >$ — линии равна:
где $R$ — постоянная Ридберга. Из формулы (4) видно, что выражение для энергии рентгеновского кванта $K_<\alpha >$ — линии совпадает с энергией кванта головной линии серии Лаймана в ионе водорода (водородоподобном ионе) с точностью до постоянной экранирования. Для $L_<\alpha >$ — линии характеристического излучения выполняется равенство:
где постоянная экранирования $<\sigma >_L\ $определяется из эксперимента или расчетов электронной структуры атома. При этом получают, что $2
Примеры задач
Каким будет порядковый номер элемента в периодической системе, если частота границы $K$ — серии линейчатого рентгеновского излучения равна $<\nu >_<\infty >Гц$? Считайте элемент легким.
В качестве основы для решения задачи используем формулу для возможных величин частот линейчатого рентгеновского излучения вида:
где для $K$- серии $n_1=1$. $n_2$ положим равным бесконечности, так как нам задана граничная частота $K$ — серии. Так как по условию задачи рассматриваемый элемент считается легким, то постоянную экранирования можно считать равной единице ($\sigma =1$). Используя выше сказанное, запишем выражение (1.1) как:
Из формулы (1.2) выразим искомый порядковый номер элемента:
Какой будет постоянная экранирования для $L$ — серии характеристического рентгеновского излучения в том случае, если при переходе электрона в атоме с оболочки $M$ на оболочку $L$ длина волны фотона, который испускается, равна $\lambda $, номер атома в периодической системе $Z$?
При переходе электрона с $M$ —оболочки на $L$ — оболочку возникает $L_<\alpha >$ линия спектра. При этом в выражении:
Из формулы (2.1) выразим искомую величину — постоянную экранирования, получим:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 03 08 2021
http://natalibrilenova.ru/dvizhenie-elektronov-v-atomah/
http://spravochnick.ru/fizika/predmet_i_zadachi_atomnoy_fiziki/perehody_vnutrennih_elektronov_v_atomah/