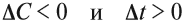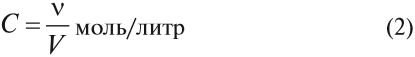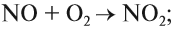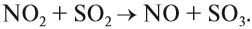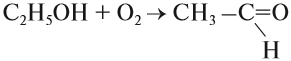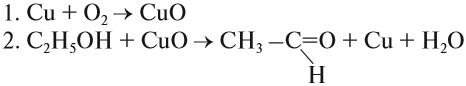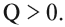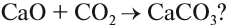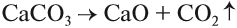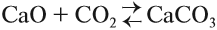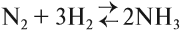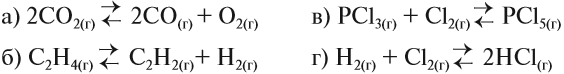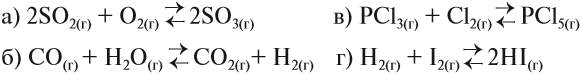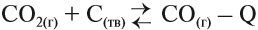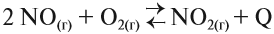Степень окисления элемента
О чем эта статья:
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
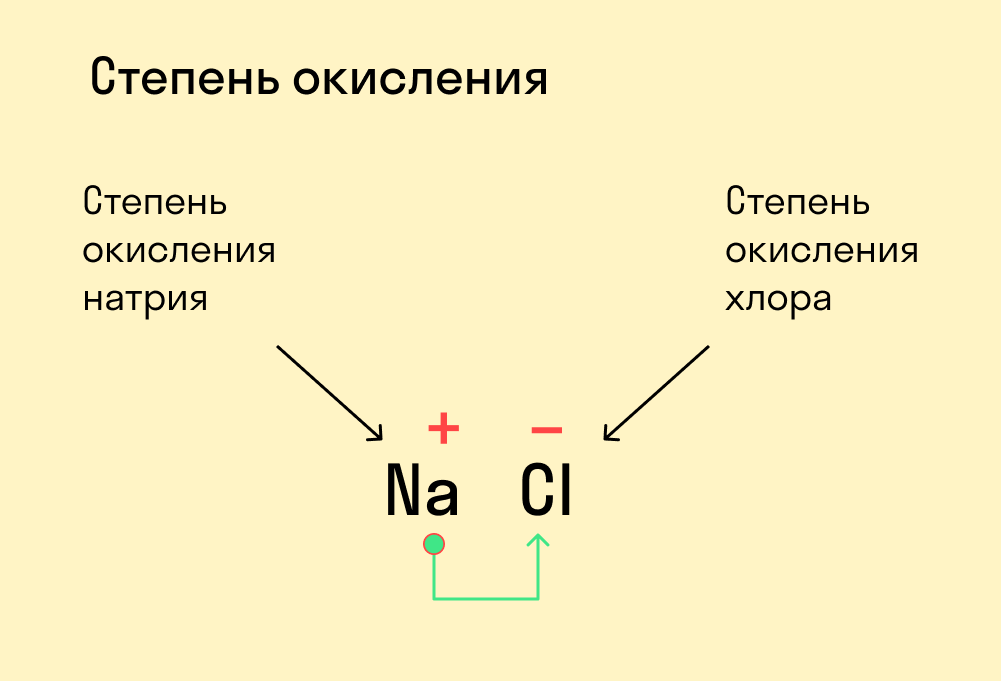
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
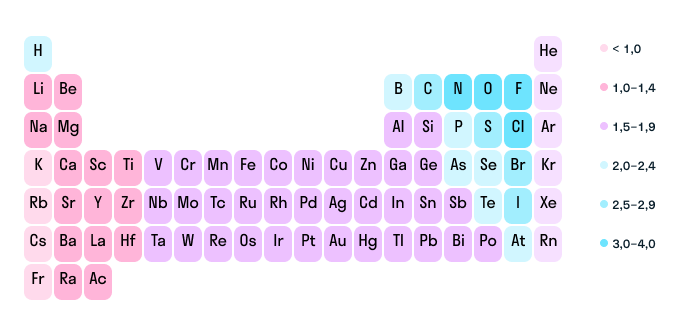
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
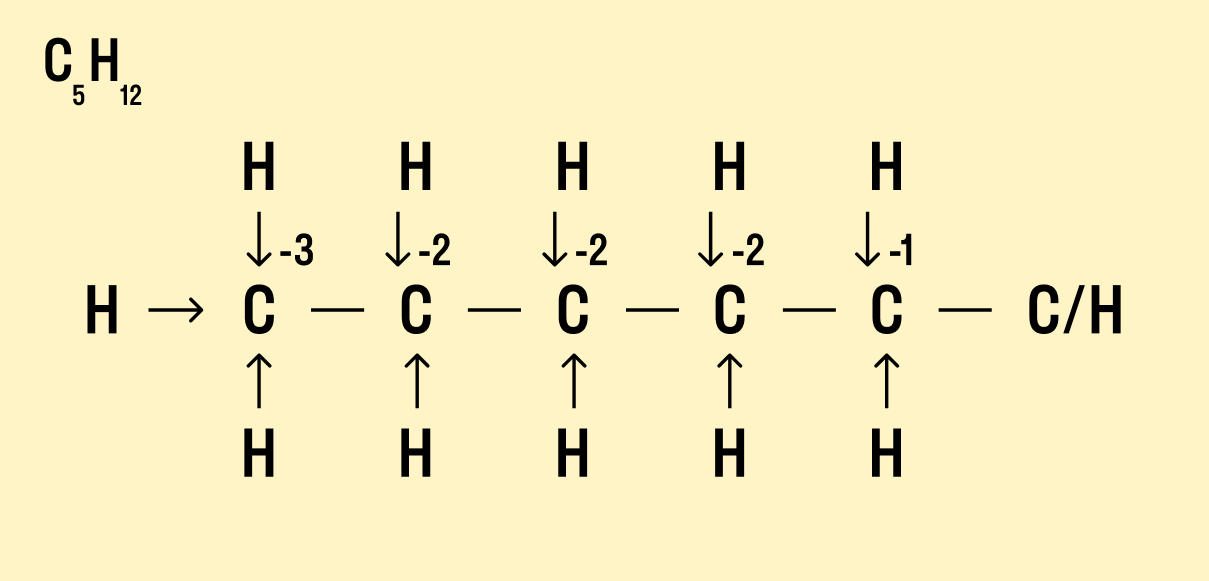
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
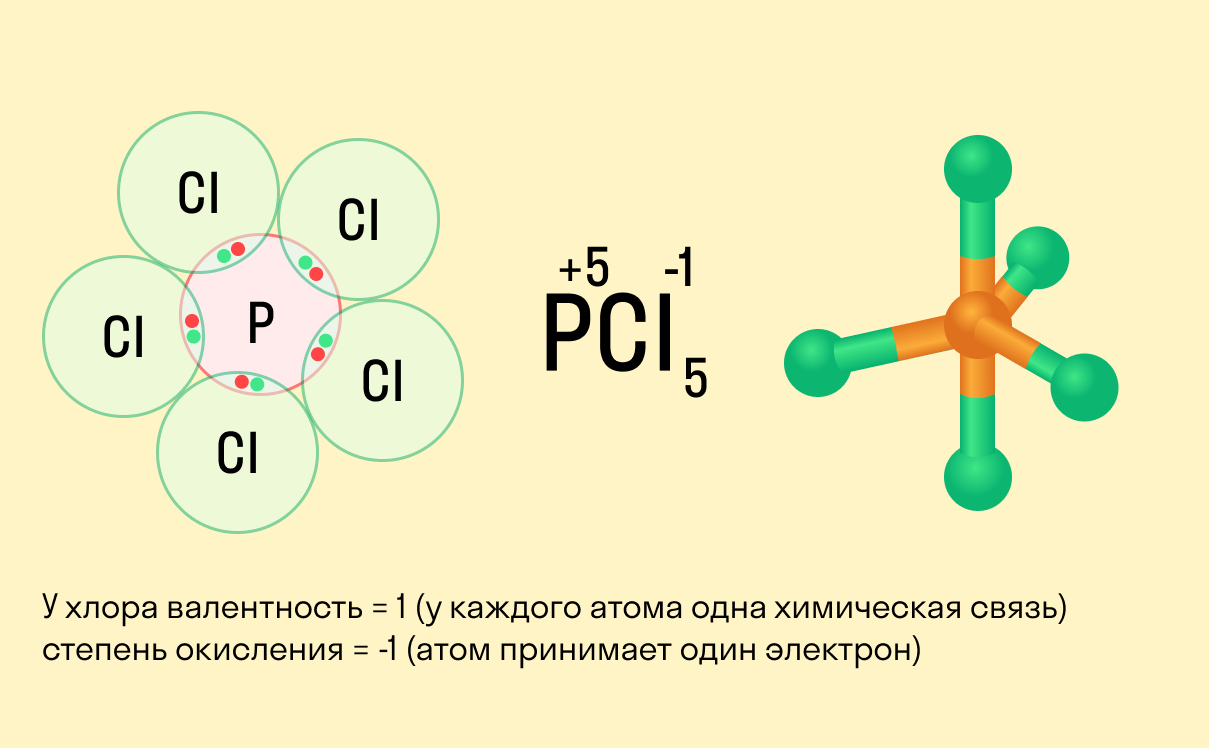
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Как определять степень окисления
Степень окисления — это число электронов, перешедших от одного атома — к другому. Знак «минус», стоящий перед степенью окисления, говорит о том, что атом электроны потерял; знак «плюс» — получил.
Степень окисления равна нулю:
- у свободных атомов;
- у атомов, входящих в состав неполярных молекул (например, H2, O2, N2, Cl2. );
- в сумме значений степеней окисления всех элементов, входящих в соединение.
Последний пункт дает возможность определять неизвестную степень окисления элемента, если известны степени окисления других элементов в этом соединении:
Для определения степени окисления азота составляем и решаем уравнение:
Во многих случаях степень окисления численно равна валентности.
Как составлять уравнения окислительно-восстановительных реакций
Напомним, что окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степеней окисления элементов (всех или некоторых).
Главный момент любой окислительно-восстановительной реакции, о котором всегда следует помнить — кол-во электронов, которые отдал элемент-восстановитель, всегда равно кол-ву электронов, принятых элементом-окислителем.
Уравнения окислительно-восстановительных реакций составляются при помощи метода электронного баланса, либо метода полуреакций.
Метод электронного баланса
Алгоритм составления уравнения окислительно-восстановительной реакции:
- Дана следующая схема реакции:
- В левой и правой частях уравнения рядом с элементами в формулах веществ проставляем степени их окисления:
- Внимательно смотрим, и определяем элементы с разной степенью окисления в левой и правой частях, в нашем случае — это марганец и хлор:
- Рядом запишем получившиеся атомы с «новой» степенью окисления:
- Записыаем кол-во перешедших электронов:
- Справа проводится вертикальная черта за которой записываются коэффициенты, стоящие перед электронами, при этом, верхний коэффициент записывается вниз, а нижний — вверх:
- проверяем, чтобы общая сумма электронов атома (иона элемента-окислителя) была равна общему числу электронов атома (иона элемента-восстановителя);
- Переносим коэффициенты электронных уравнений в уравнение реакции в молекулярной форме, которые следует проставить в уравнении перед соответствующими формулами, и проверяем равенстов кол-ва атомов элементов в левой и правой части уравнения:
Приведем еще один пример составления уравнения окислительно-восстановительной реакции методом электронного баланса.
- Дана следующая схема реакции:
- Записываем степени окисления всех элементов в обеих частях схемы, после чего определяем элементы, изменяющие свои степени окисления в ходе реакции:
- Пишем уравнения окисления и восстановления, поскольку продуктом окисления является двухатомная молекула брома, то и в левой части берем также два атома брома:
- Записываем множители для уравнения:
- Основное правило метода электронного баланса выполняется: 2 атома марганца принимают 10 электронов (2·5), а 10 атомов брома отдают 10 электронов (каждый атом — по одному электрону);
- Найденные множители записываются в качестве коэффициентов перед формулами веществ, содержащих элементы, участвующие в процессе окисления-восстановления:
- Осталось уравнять кол-во атомов элементов, не изменяющих степени окисления (калий, сера, водород, кислород):
- В последнюю очередь уравниваются кол-ва атомов кислорода и водорода.
Рассмотрим пример окислительно-восстановительной реакции, в которой меняют свои степени окисления сразу три элемента.
- Схема реакции:
- Определяем элементы, меняющие свои степени окисления:
- В процессе реакции окисляются фосфор и сера, а восстанавливается азот, при этом кол-во электронов, участвующих в процессах окисления, равно 22, а в процессе восстановления участвует только 1 электрон:
- Записываем найденные множители в схему реакции, как коэффициенты перед формулами соответствующих веществ:
- На последней стадии проводим уравнение кол-ва атомов кислорода и водорода:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Урок 5. Скорость химической реакции
Зависимость скорости химической реакции от различных факторов
Понятие «скорость» довольно часто встречается в литературе. Из физики известно, что чем большее расстояние преодолеет материальное тело (человек, поезд, космический корабль) за определённый отрезок времени, тем выше скорость этого тела.
А как измерить скорость химической реакции, которая никуда «не идёт» и никакое расстояние не преодолевает? Для того чтобы ответить на этот вопрос, следует выяснить, а что всегда меняется в любой химической реакции? Поскольку любая химическая реакция — это процесс изменения вещества, то исходное вещество в ней исчезает, превращаясь в продукты реакции. Таким образом, в ходе химической реакции всегда изменяется количество вещества, уменьшается число частиц исходных веществ, а значит, и его концентрация (С).
Задание ЕГЭ. Скорость химической реакции пропорциональна изменению:
- концентрации вещества в единицу времени;
- количеству вещества в единице объёма;
- массы вещества в единице объёма;
- объёму вещества в ходе реакции.
А теперь сравните свой ответ с правильным:
скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени
где С1 и С0 — концентрации реагирующих веществ, конечная и начальная, соответственно; t1 и t2 — время эксперимента, конечный и начальный отрезок времени, соответственно.
Поскольку реагирующие вещества всегда расходуются в данной реакции, то
Таким образом, отношение этих величин всегда отрицательно, а скорость не может быть величиной отрицательной. Поэтому в формуле появляется знак «минус», который одновременно говорит о том, что скорость любой реакции с течением времени (при неизменных условиях) всегда уменьшается.
Итак, скорость химической реакции равна:
Возникает вопрос, в каких единицах следует измерять концентрацию реагирующих веществ (С) и почему? Для того чтобы ответить на него, нужно понять, какое условие является главным для протекания любой химической реакции.
Для того чтобы частицы прореагировали, необходимо, чтобы они, как минимум, столкнулись. Поэтому чем выше число частиц* (число молей) в единице объёма, тем чаще они сталкиваются, тем выше вероятность химической реакции.
* О том, что такое «моль», читай в уроке 29.1.
Поэтому при измерении скоростей химических процессов используют молярную концентрацию веществ в реагирующих смесях.
Молярная концентрация вещества показывает, сколько молей его содержится в 1 литре раствора
Итак, чем больше молярная концентрация реагирующих веществ, тем больше частиц в единице объёма, тем чаще они сталкиваются, тем выше (при прочих равных условиях) скорость химической реакции. Поэтому основным законом химической кинетики (это наука о скорости химических реакций) является закон действующих масс.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для реакции типа А + В →… математически этот закон можно выразить так:
Если реакция более сложная, например, 2A + B → или, что тоже самое А + А + В → …, то
Таким образом, в уравнении скорости появился показатель степени «два», который соответствует коэффициенту 2 в уравнении реакции. Для более сложных уравнений большие показатели степеней, как правило, не используют. Это связано с тем, что вероятность одновременного столкновения, скажем, трёх молекул А и двух молекул В крайне мала. Поэтому многие реакции протекают в несколько стадий, в ходе которых сталкивается не более трёх частиц, и каждая стадия процесса протекает с определённой скоростью. Эту скорость и кинетическое уравнение скорости для неё определяют экспериментально.
Вышеприведённые уравнения скорости химической реакции (3) или (4) справедливы только для гомогенных реакций, т. е. для таких реакций, когда реагирующие вещества не разделяет поверхность. Например, реакция происходит в водном растворе, и оба реагирующих вещества хорошо растворимы в воде или для любой смеси газов.
Другое дело, когда происходит гетерогенная реакция. В этом случае между реагирующими веществами имеется поверхность раздела, например, углекислый газ реагирует с водным раствором щёлочи. В этом случае любая молекула газа с равной вероятностью может вступить в реакцию, поскольку эти молекулы быстро и хаотично двигаются. А частицы жидкого раствора? Эти частицы двигаются чрезвычайно медленно, и те частицы щёлочи, которые находятся «на дне», практически не имеют шансов вступить в реакцию с углекислым газом, если раствор не перемешивать постоянно. Реагировать будут только те частицы, которые «лежат на поверхности». Значит, для гетерогенных реакций —
скорость реакции зависит от величины площади поверхности раздела, которая увеличивается при измельчении.
Поэтому очень часто реагирующие вещества измельчают (например, растворяют в воде), пищу тщательно пережёвывают, а в процессе приготовления — растирают, пропускают через мясорубку и т. д. Не измельчённый пищевой продукт практически не усваивается!
Таким образом, с максимальной скоростью (при прочих равных условиях) протекают гомогенные реакции в растворах и между газами, (если эти газы реагируют при н. у.), причём в растворах, где молекулы располагаются «рядом», а измельчение такое же, как в газах (и даже больше!), — скорость реакции выше.
Задание ЕГЭ. Какая из реакций протекает с наибольшей скоростью при комнатной температуре:
- углерода с кислородом;
- железа с соляной кислотой;
- железа с раствором уксусной кислоты
- растворов щёлочи и серной кислоты.
В данном случае нужно найти, какой процесс является гомогенным.
Следует отметить, что скорость химической реакции между газами или гетерогенной реакции, в которой участвует газ, зависит и от давления, поскольку при увеличении давления газы сжимаются, и концентрация частиц увеличивается (см. формулу 2). На скорость реакций, в которых газы не участвуют, изменение давления влияния не оказывает.
Задание ЕГЭ. На скорость химической реакции между раствором кислоты и железом не оказывает влияния
- концентрация кислоты;
- измельчение железа;
- температура реакции;
- увеличение давления.
И наконец, скорость реакции зависит и от реакционной способности веществ. Например, если с веществом реагирует кислород, то при прочих равных условиях, скорость реакции будет выше, чем при взаимодействии этого же вещества с азотом. Дело в том, что реакционная способность кислорода заметно выше, чем у азота. Причину этого явления мы рассмотрим в следующей части Самоучителя (урок 14).
Задание ЕГЭ. С большей скоростью идёт химическая реакция между соляной кислотой и
Следует отметить, что далеко не каждое столкновение молекул приводит к их химическому взаимодействию (химической реакции). В газовой смеси водорода и кислорода при обычных условиях происходит несколько миллиардов столкновений в секунду. Но первые признаки реакции (капельки воды) появятся в колбе только через несколько лет. В таких случаях говорят, что реакция практически не идёт. Но она возможна, иначе чем объяснить тот факт, что при нагревании этой смеси до 300 °C колба быстро запотевает, а при температуре 700 °C прогремит страшный взрыв! Недаром смесь водорода и кислорода называют «гремучим газом».
Вопрос. Как вы полагаете, почему скорость реакции так резко возрастает при нагревании?
Скорость реакции возрастает потому, что, во-первых, увеличивается число столкновений частиц, а во-вторых, увеличивается число активных столкновений. Именно активные соударения частиц приводят к их взаимодействию. Для того чтобы произошло такое соударение, частицы должны обладать определённым запасом энергии.
Энергия, которой должны обладать частицы, для того чтобы произошла химическая реакция, называется энергией активации.
Эта энергия расходуется на преодоление сил отталкивания между внешними электронами атомов и молекул и на разрушение «старых» химических связей.
Возникает вопрос: как повысить энергию реагирующих частиц? Ответ простой — повысить температуру, поскольку при повышении температуры возрастает скорость движения частиц, а, следовательно, их кинетическая энергия.
при повышении температуры на каждые 10 градусов скорость реакции возрастает в 2–4 раза.
ВАНТ-ГОФФ Якоб Хендрик (30.08.1852–1.03.1911) — голландский химик. Один из основателей физической химии и стереохимии. Нобелевская премия по химии № 1 (1901).
Следует заметить, что это правило (не закон!) было установлено экспериментально для реакций, «удобных» для измерения, то есть для таких реакций, которые протекали не слишком быстро и не слишком медленно и при температурах, доступных экспериментатору (не слишком высоких и не слишком низких).
Вопрос. Как вы полагаете, как можно быстрее приготовить картофель: отварить его или обжарить в слое масла?
Если мы хотим сохранить пищевые продукты, — мы их охлаждаем или замораживаем.
Для того чтобы как следует уяснить себе смысл описываемых явлений, можно сравнить реагирующие молекулы с группой учеников, которым предстоит прыгать в высоту. Если им поставлен барьер высотой 1 м, то ученикам придётся как следует разбежаться (повысить свою «температуру»), чтобы преодолеть барьер. Тем не менее всегда найдутся ученики («неактивные молекулы»), которые взять этот барьер не смогут.
Что делать? Если придерживаться принципа: «Умный в гору не пойдёт, умный гору обойдёт», то следует просто опустить барьер, скажем, до 40 см. Тогда любой ученик сможет преодолеть барьер. На молекулярном уровне это означает: для того чтобы увеличить скорость реакции, нужно уменьшить энергию активации в данной системе.
В реальных химических процессах эту функцию выполняет катализатор.
Катализатор — это вещество, которое изменяет скорость химической реакции, оставаясь при этом неизменным к концу химической реакции.
Катализатор участвует в химической реакции, взаимодействуя с одним или несколькими исходными веществами. При этом образуются промежуточные соединения, и изменяется энергия активации. Если промежуточное соединение более активно (активный комплекс), то энергия активации понижается, а скорость реакции увеличивается.
Например, реакция между SO2 и О2 происходит очень медленно, при нормальных условиях практически не идёт. Но в присутствии NO скорость реакции резко возрастает. Сначала NO очень быстро реагирует с O2:
полученный диоксид азота быстро реагирует с оксидом серы (IV):
Задание 5.1. Покажите на этом примере, какое вещество является катализатором, а какое — активным комплексом.
И наоборот, если образуются более пассивные соединения, то энергия активации может возрасти настолько, что реакция при данных условиях практически происходить не будет. Такие катализаторы называются ингибиторами.
На практике применяются оба типа катализаторов. Так особые органические катализаторы — ферменты — участвуют абсолютно во всех биохимических процессах: переваривании пищи, сокращении мышц, дыхании. Без ферментов невозможно существование жизни!
Ингибиторы необходимы для того, чтобы защитить металлические изделия от коррозии, жиросодержащие пищевые продукты от окисления (прогоркания). Некоторые лекарства также содержат ингибиторы, которые угнетают жизненные функции микроорганизмов и тем самым уничтожают их.
Катализ может быть гомогенным и гетерогенным. Примером гомогенного катализа служит действие NO (это катализатор) на процесс окисления диоксида серы. Примером гетерогенного катализа может служить действие нагретой меди на спирт:
Эта реакция идёт в две стадии:
Задание 5.2. Определите, какое вещество в этом случае является катализатором? Почему этот вид катализа называется гетерогенным?
На практике чаще всего используется гетерогенный катализ, где катализаторами служат твёрдые вещества: металлы, их оксиды и др. На поверхности этих веществ имеются особые точки (узлы кристаллической решётки), где, собственно и происходит каталитическая реакция. Если эти точки закрыть посторонними веществом, то катализ прекращается. Это вещество, губительное для катализатора, называется каталитическим ядом. Другие вещества — промоторы — наоборот, усиливают каталитическую активность.
Катализатор может изменить направление химической реакции, то есть, меняя катализатор, можно получать разные продукты реакции. Так, из спирта C2H5OH в присутствии оксидов цинка и алюминия можно получить бутадиен, а в присутствии концентрированной серной кислоты — этилен.
Таким образом, в ходе химической реакции изменяется энергия системы. Если в ходе реакции энергия выделяется в виде теплоты Q, такой процесс называется экзотермическим:
Для эндотермических процессов теплота поглощается, т. е. тепловой эффект Q Обратимость химических процессов. Принцип Ле-Шателье
* ЛЕ ШАТЕЛЬЕ Анри Луи (8.10.1850–17.09.1936) — французский физико-химик и металловед. Сформулировал общий закон смещения равновесия (1884).
Реакции бывают обратимыми и необратимыми.
Необратимыми называют такие реакции, для которых не существует условий, при которых возможен обратный процесс.
Примером таких реакций могут служить реакции, которые происходят при скисании молока, или когда сгорела вкусная котлета. Как невозможно пропустить мясной фарш назад через мясорубку (и получить снова кусок мяса), также невозможно «реанимировать» котлету или сделать свежим молоко.
Но зададим себе простой вопрос: является ли необратимым процесс:
Для того чтобы ответить на этот вопрос, попробуем вспомнить, можно ли осуществить обратный процесс? Да! Разложение известняка (мела) с целью получить негашёную известь СаО используется в промышленном масштабе:
Таким образом реакция является обратимой, так как существуют условия, при которых с ощутимой скоростью протекают оба процесса:
Более того, существуют условия, при которых скорость прямой реакции равна скорости обратной реакции.
В этих условиях устанавливается химическое равновесие. В это время реакция не прекращается, но число полученных частиц равно числу разложившихся частиц. Поэтому в состоянии химического равновесия концентрации реагирующих частиц не изменяются. Например, для нашего процесса в момент химического равновесия
знак [ ] означает равновесная концентрация.
Возникает вопрос, что произойдёт с равновесием, если повысить или понизить температуру, изменить другие условия? Ответить на подобный вопрос можно, зная принцип Ле-Шателье:
если изменить условия (t, p, c), при которых система находится в состоянии равновесия, то равновесие сместится в сторону того процесса, который противодействует изменению.
Другими словами, равновесная система всегда противится любому воздействию извне, как противится воле родителей капризный ребёнок, который делает «всё наоборот».
Рассмотрим пример. Пусть установилось равновесие в реакции получения аммиака:
Вопросы. Одинаково ли число молей реагирующих газов до и после реакции? Если реакция идёт в замкнутом объёме, когда давление больше: до или после реакции?
Очевидно, что данный процесс происходит с уменьшением числа молекул газов, значит, давление в ходе прямой реакции уменьшается. В обратной реакции — наоборот, давление в смеси увеличивается.
Зададим себе вопрос, что произойдёт, если в этой системе повысить давление? По принципу Ле-Шателье пойдёт та реакция, которая «делает наоборот», т. е. понижает давление. Это — прямая реакция: меньше молекул газа — меньше давление.
Итак, при повышении давления равновесие смещается в сторону прямого процесса, где давление понижается, так как уменьшается число молекул газов.
Задание ЕГЭ. При повышении давления равновесие смещается вправо в системе:
Если в результате реакции число молекул газов не меняется, то изменение давления на положение равновесия не оказывает влияние.
Задание ЕГЭ. Изменение давления оказывает влияние на смещение равновесия в системе:
Положение равновесия этой и любой другой реакции зависит от концентрации реагирующих веществ: увеличивая концентрацию исходных веществ и уменьшая концентрацию полученных веществ, мы всегда смещаем равновесие в сторону прямой реакции (вправо).
Задание ЕГЭ. Химическое равновесие в системе
сместится влево при:
- повышении давления;
- понижении температуры;
- повышении концентрации СО;
- понижении концентрации СО.
Процесс синтеза аммиака экзотермичен, то есть сопровождается выделением теплоты, то есть повышением температуры в смеси.
Вопрос. Как сместится равновесие в этой системе при понижении температуры?
Рассуждая аналогично, делаем вывод: при понижении температуры равновесие сместится в сторону образования аммиака, так как в этой реакции теплота выделяется, а температура повышается.
Вопрос. Как изменится скорость химической реакции при понижении температуры?
Очевидно, что при понижении температуры резко понизится скорость обеих реакций, т. е. придётся очень долго ждать, когда же установится желаемое равновесие. Что делать? В этом случае необходим катализатор. Он хотя и не влияет на положение равновесия, но ускоряет наступление этого состояния.
Задание ЕГЭ. Химическое равновесие в системе
смещается в сторону образования продукта реакции при:
- повышении давления;
- повышении температуры;
- понижении давления;
- применении катализатора.
Выводы
Скорость химической реакции зависит от:
- природы реагирующих частиц;
- концентрации или площади поверхности раздела реагирующих веществ;
- температуры;
- наличия катализатора.
Равновесие устанавливается, когда скорость прямой реакции равна скорости обратного процесса. В этом случае равновесная концентрация реагирующих веществ не меняется. Состояние химического равновесия зависит от условий и подчиняется принципу Ле-Шателье.
http://prosto-o-slognom.ru/chimia/22_2_uravneniya_ovr.html
http://himi4ka.ru/samouchitel-po-himii/urok-5-skorost-himicheskoj-reakcii.html