Катализаторы Циглера-Натта
КООРДИНАЦИОННО-ИОННАЯ ПОЛИМЕРИЗАЦИЯ
В настоящее время в промышленности для получения стереорегулярных полимеров широко применяется координационно-ионная полимеризация. Наиболее существенным отличием стереорегулярных полимеров от атактических полимеров является способность первых образовывать трехмерные кристаллы. Необходимость получения кристаллизующихся полимеров обусловлена наличием у них высоких температур плавления и плохой растворимости.
Координационно-ионной полимеризацией называется каталитический процесс образования макромолекул, в котором стадии разрыва связи в мономере предшествует возникновение координационного комплекса между ним и активным центром.
Комплексообразование мономер-катализатор обуславливает возможность синтеза стереорегулярных полимеров из широкого круга мономеров: a-олефинов, диенов, ряда полярных мономеров.
Катализаторы, позволяющие получать стереорегулярные полимеры, называются стереоспецифическими. К таким катализаторам относятся каталитические системы трех типов:
1. комплексы соединений переходных металлов с алкилпроизводными алюминия и других металлов II-III групп Периодической системы (катализаторы Циглера-Натта);
2. p-аллильные комплексы переходных металлов;
3. оксиды переходных металлов.
Общей их особенностью является способность образовывать в углеводородных средах сравнительно стабильные комплексы с мономером. После этого происходит гетеролитический разрыв π-связи мономерных молекул, подобно тому, как при координации мономеров у алкил-литиевых катализаторов.
Они обеспечивают регулярное построение каждой макромолекулы полимера: у полимеров α‑замещенных этиленовых углеводородов образуются изо- и синдиотактические структуры, у полимеров диенов – цис- и транс-изомеры.
Катализаторы Циглера-Натта
Директор Химического института в г. Мюльхейме (ФРГ) Карл Циглер (1898–1973) всю свою жизнь посвятил исследованиям синтеза металлорганических соединений и анионной полимеризации. Заинтересовавшись алюминийорганическими соединениями, он в 1949 г. разработал метод их синтеза взаимодействием α-олефинов с гидридом алюминия. Уже тогда он обратил внимание на олигомеризацию олефинов при этих условиях и начал искать способ получения высокомолекулярного полиэтилена. Тогда был известен лишь ПЭВД, который получали при 3000 атм и 250 °С. В 1954 г. Циглер делает сенсационное открытие: на системе (C2H5)3Al + TiCl4 он получает полиэтилен при обычном давлении и комнатной температуре – т.н. ПЭНД. Именно тогда поработать с Циглером приезжает профессор Миланского политехнического института Джулио Натта (1903–1979) и, используя его новый инициатор, впервые получает высокомолекулярный полипропилен. Уже через несколько лет и ПЭНД, и ПП начинают выпускать в промышленных масштабах, а комплекс (C2H5)3Al·TiCl4 становится известным как «катализатор Циглера Натта». Особенностью этого катализатора является еще и то, что в его присутствии образуются стереорегулярные полимеры, которые Натта назвал изотактическими и синдиотактическими. В 1963 г. оба ученых получают Нобелевскую премию «За вклад в открытие и развитие фундаментальных методов синтеза органических макромолекул из простых ненасыщенных углеводородов с помощью каталитической полимеризации». Современное название процесса – ионно-координационная полимеризация.
Значение катализаторов Циглера-Натта состоит в следующем. Они являются наиболее универсальными инициаторами стереорегулярной полимеризации многих мономеров и только с их помощью могут быть вовлечены в полимеризацию α-олефины; на этих катализаторах при умеренном давлении получается полиэтилен, по свойствам принципиально отличный от продукта радикальной полимеризации. На этих катализаторах удалось осуществить промышленный синтез полипропилена, тогда как другие каталитические системы оказались неэффективными. Такие катализаторы широко используются для получения других полимеров строго стереорегулярной структуры, особенно цис-1,4-полибутадиена и цис-1,4-полиизопрена – синтетических каучуков высокого качества, полноценно заменяющих натуральный каучук.
В настоящее время под катализаторами Циглера–Натта понимают комбинацию двух соединений – переходного металла и металла I – III групп. В более узком смысле слова под этими катализаторами понимают систему TiCl3+AlRnCl1-n. Первоначально Циглер использовал систему (C2H5)3Al + TiCl4, позже было осуществлено два важных улучшения катализатора. В качестве соединения переходного металла стали использовать кристаллические формы TiCl3. Это привело к существенному возрастанию доли изотактической структуры в полипропилене (до 90 %). Далее, для увеличения удельной поверхности катализатора он стал наноситься на частицы высокодисперсных порошков, лучшим из которых оказался порошок MgCl2. Достигнутое увеличение активности нанесенного катализатора связывают не только с увеличением на 1–2 порядка его удельной поверхности, но и с вхождением ионов магния в кристаллическую решетку TiCl4. Эффективность стереоконтроля реакции роста удалось повысить добавками к катализаторам Циглера-Натта небольших количеств органических оснований Льюиса, например, алкилбензоатов. Усовершенствованные подобным образом современные катализаторы Циглера-Натта позволяют на 1 г титанового компонента катализатора получать до 1 т полипропилена с почти 100 %-м содержанием изотактической структуры.
Широкое применение в качестве катализаторов полимеризации получили при промышленном производстве полимеров каталитические комплексы хлоридов титана с алкилпроизводными алюминия, на примере которых мы рассмотрим механизм реакций синтеза полимеров из виниловых мономеров. При взаимодействии тетрахлорида титана TiCl4 с триэтилалюминием Al(C2H5)3 происходит алкилирование титана и его восстановление до TiCl3. В среде инертных углеводородов в качестве растворителей мономера и в отсутствие кислорода указанные соединения образуют четырехчленный комплекс следующего строения:
Процессу полимеризации предшествует координация молекулы мономера у атома титана и внедрение его в состав комплекса за счет разрыва связи Ti–Cl. При этом мономер выступает с роли донора p-электронов, а переходный металл благодаря наличию вакантных d-орбиталей является акцептором. За счет координации с донором образуется p-комплекс, возникновение которого приводит к ослаблению связи Ti–Cl в комплексе, и облегчается внедрение мономера с образованием нового шестичленного комплекса с последующей его перестройкой в четырехчленный комплекс. При этом полимеризация производных этилена может быть представлена следующей схемой:
После разделения зарядов одна из связей в комплексе разрушается и в структуру каталитического комплекса входит молекула мономера с образованием нового, шестичленного, цикла в комплексе катализатора с последующей его перестройкой снова в четырехчленный цикл:
В регенерированном четырехчленном цикле содержится один из атомов углерода молекулы мономера, соединенный с атомами титана и алюминия, а исходная этильная группа удаляется из цикла вместе с другим атомом углерода винилового мономера.
Следующая молекула мономера вступает в реакцию аналогичным образом, и происходит постепенное вытеснение образующейся полимерной молекулы из структуры комплексного катализатора. При этом заместитель при атоме углерода в молекуле мономера сохраняет строго определенное пространственное расположение относительно плоскости цепи, т.е. стереорегулярность:
При координационно-ионной полимеризации на катализаторе Al(C2H5)3·TiCl4 образуются полимеры, содержащие до 96% стереорегулярной структуры. Стереорегулярность уменьшается при наличии в реакционной среде примесей, а также с повышением температуры.
Изотактическая структура образуется, когда все заместители расположены по одну сторону от плоскости основной цепи макромолекулы. Cиндиотактическая структура образуется при правильном чередовании положения заместителей Х относительно плоскости основной цепи.
Наиболее склонны к такой полимеризации мономеры с повышенной электронной плотностью на двойной связи. Но здесь важную роль играют стерические факторы. Так, несмотря на то, что электронная плотность на двойной связи у этилена меньше, чем у пропилена, скорость полимеризации первого значительно больше, так как отсутствуют стерические препятствия при внедрении мономера.
Необходимо, однако, иметь в виду, что активность и стереоспецифичность действия каталитических систем в координационно-ионной полимеризации не универсальны. Для каждого мономера обычно существует катализатор, обеспечивающий наибольшие активность и стереоспецифичность. Выбор наиболее подходящей системы для ионно-координационной полимеризации данного мономера во многих случаях осуществляется эмпирически.
Основные преимущества ионно-координационной полимеризации:
1. мономер присоединяется только по типу «голова–хвост» (характерно для всех видов ионной полимеризации);
2. отсутствуют разветвления молекулярных цепей;
3. обеспечивается ориентация мономера в пространстве в процессе инициирования и роста цепи.
При полимеризации диеновых мономеров присутствие катализаторов Циглера–Натта обеспечивает формирование пространственно регулярных полимеров. Наиболее важной в практическом отношении является структура цис-1,4, обеспечивающая проявление высокоэластических свойств полибутадиена и полиизопрена в широком температурном интервале (от –110 и –72 °С соответственно до температур текучести свыше 100 °С).
Было обнаружено, что катализаторы Циглера-Натта позволяют получать целый ряд стереорегулярных полимеров. Один и тот же мономер в присутствии разных катализаторов полимеризуется с образованием различных продуктов. Например, при использовании разных катализаторов при полимеризации бутадиена можно наблюдать следующую картину:
Т.е. варьируя структуру катализатора, можно получать полибутадиен различного строения.
Т.о., ионно-координационная полимеризация позволяет получать полимеры винилового и диенового рядов не только с регулярным химическим чередованием звеньев мономеров в цепи («голова к хвосту»), но и с регулярным расположением в пространстве заместителей при атоме углерода. Это ведет к резкому улучшению физико-механических свойств стереорегулярных полимеров.
Координационная полимеризация алкенов
Вы будете перенаправлены на Автор24
Кроме вышеупомянутых разновидностей процесса полимеризации существует также стереоспецифическая полимеризация в присутствии металлорганических катализаторов Циглера — Натта и соединений $d$-металов вроде $TiCl_4$. Такую полимеризацию еще называют ионно-координационной (анионно-координационной). Стереоспецнфичнисть этой полимеризации заключается в образовании стереорегулярных полимеров (изотактического полипропилена, цис-1,4-полиизопрена) с высокими показателями механических свойств.
Катализаторы Циглера-Натта
Директор Химического института в г. Мюльхейм Карл Циглер (1898-1973) всю свою жизнь посвятил синтезу металлоорганических соединений и анионной полимеризации. Заинтересовавшись алюминийорганическими соединениями, он в 1949 году разработал метод их синтеза взаимодействием α-олефинов с гидридом алюминия. Уже тогда он обратил внимание на олигомеризацию олефинов в этих условиях и начал искать способ получения высокомолекулярного полиэтилена. В то время был известен лишь полиэтилен высокого давления (ПВД), который получали при 3000 атм и 250 °С. В 1954 г. Циглер делает сенсационное открытие: на системе $(CH_3CH_2)3Al$ + $TiCl_4$ он получает полиэтилен при обычном давлении и комнатной температуре — так называемый «полиэтилен низкого давления» (ПНД). Именно тогда поработать с Циглером приезжает профессор Миланского политехнического института Джулио Натта (1903 -1979), и использовав его новый инициатор, впервые получает високомопекулярний полипропилен. Уже через несколько лет и ПНД, и полипропилен начинают выпускаться в промышленном масштабе, а комплекс $(CH_3CH_2)3Al$ + $TiСl_4$ становится известным, как «катализатор Циглера-Натта» . Особенностью этого катализатора является еще и то, что в его присутствии образуются стереорегулярные полимеры. Процесс получил название «кординационно-йоная полимеризация». В 1963 г. оба ученых получают Нобелевскую премию «За вклад в открытие и развитие фундаментальных методов синтеза органических макромолекул из простых ненасыщенных углеводородов с помощью каталитической полимеризации». Дальнейшие исследования показали, что вызвать координационно-ионную полимеризацию, то есть быть катализаторами Циглера-Натта, могут органические производные практически всех металлов І-ІІІ групп периодической таблицы в сочетании с галогенидами переходных металлов IV-VII групп.
Механизм координационной полимеризации алкенов
Механизм ионной-координационного полимеризации достаточно сложный и до конца еще не установлен. В упрощенном варианте его можно представить следующим образом.
В координационном механизме активными центрами являются поляризованные связи $C—Me$ металлоорганических комплексов куда входят переходные металлы IV—VIII групп периодической системы элементов и органические соединения металлов Ι-ІІІ групп. Эти катализаторы обеспечивают:
- высокую скорость полимеризации при обычной температуре;
- образование полимеров упорядоченного строения — стереоспецифических полимеров
Высокоэффективными катализаторами оказались металлоорганические комплексы, получающиеся при восстановлении хлорида титана (IV) триэтилалюминием $(CH_3CH_2)_3Al$. При этом образуется хлорид титана (III), на поверхности которого адсорбируется триэтилалюминий. При смешивании компонентов каталитической системы происходит ряд сложных преобразований с выпадением осадка. При этом проходит одновременно алкилирование и восстановление d-металла (титана):
Готовые работы на аналогичную тему
Согласно подходу М. Коссе (1962 г.) Активным центром полимеризации выступает алкилированный ион $TiCl_3^+$, расположенный на поверхности кристаллической решетки $TiCl_3$ (основы осадка). Процесс полимеризации заключается в диффузии мономера к поверхности катализатора, его адсорбции с образованием π-комплекса с катализатором. В результате этого происходит поляризация двойной связи и его укоренения (присоединения) по связи $Ti-C$:
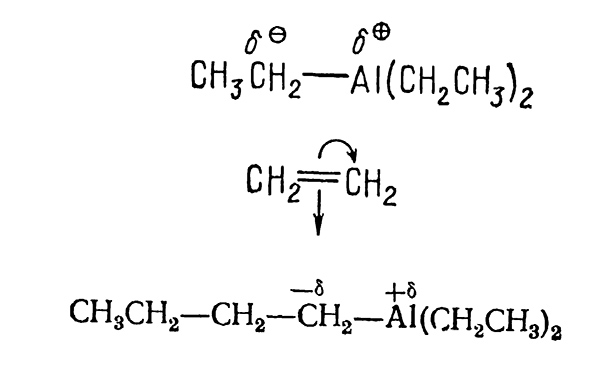
В результате адсорбции сильно поляризуется связь алюминий-углерод $(C-Al)$ триэтилалюминия. Которая инициирует полимеризацию этилена. Мономерные звенья присоединяются к растущей цепи в результате координации со связью $C—Al$ и последующего их внедрения в связи между металлом и растущей алкильной группой. Это приводит к новой растущей цепи с новым активным центром. Рост цепи может про-должаться до полного использования мономера:
Влияние строения олефинов на способность к полимеризации
Перед рассмотрением координационной полимеризации необходимо особо остановиться на влиянии строения непредельных углеродов на их способность к полимеризации.
При проведении полимеризации под действием электрофильных и нуклеофильных реагентов (гетеролитическая полимеризация) главную роль играют поляризация и поляризуемость двойных связей непредельных углеводородов.
Углеводороды, двойные связи которых поляризованы, например изобутилен полимеризуются легко. С другой стороны, углеводороды типа бутадиена, несмотря на отсутствие дипольного момента, также полимеризуются очень легко. В этих случаях причина легкого протекания поли-меризации заключается в легкой поляризуемости сопряженных связей под влиянием атакующего реагента.
Иногда, как например, в случае стирола, легкость полимеризации обусловливается обоими факторами: поляризацией и поляризуемостью.
В тех случаях, когда двойные связи непредельных соединений неполяризованы и трудно поляризуемы, полимеризация протекает только в жестких условиях.
Это ясно видно при сравнении условий полимеризации изобутилена и этилена.
При действии разбавленной серной кислоты (65—70%) изобутилен полимеризуется при 25—30 °С.
Хлористый алюминий, трехфтористый бор и некоторые другие подобные катализаторы вызывают полимеризацию изобутилена (при-водящую к образованию каучукоподобного полимера) при температурах около -70°.
В присутствии флоридина (гидросиликата алюминия) изобутилен легко полимеризуется даже при -80°.
Этилен под действием серной кислоты не полимеризуется (образуются устойчивые кислый и средний этил-сульфаты). Попытки добиться полимеризации путем повышения температуры оказываются безуспешными (происходит лишь окисление этилена).
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 03 06 2021
Ключевые слова:
комплекс, лиганд
Полимеризация с катализаторами Циглера-Натта является одним из методов виниловой полимеризации. Этот метод очень важен, поскольку он позволяет получать полимеры с определенной тактичностью. Он был открыт двумя учеными, и я думаю, что все уже догадались, как их звали. Полимеризация с катализаторами Циглера-Натта особенно важна потому, что этим методом мы можем получать полимеры, которые никаким другим методом не могут быть получены, такие как линейный неразветвленный полиэтилен и изотактический полипропилен. Метод радикальной виниловой полимеризации может дать нам только разветвленный полиэтилен, а полипропилен и вовсе не может быть получен методом радикальной виниловой полимеризации. Поэтому реакция полимеризации с катализаторами Циглера-Натта — поистине очень важная реакция.
Ну и как же она происходит? Происходит она примерно так: вы берете свой катализатор Циглера-Натта, обычно это TiCl 3 или TiCl 4 , вместе с алюминийсодержащим сокатализатором и помещаете в сосуд с мономером в полночь при полной луне. Затем вы ставите сосуд на землю в центре круга, образованного зажженными свечами. Потом вы должны написать на стенке мензурки руническими письменами слово «изотактический» или «синдиотактический» (в зависимости от тактичности полимера, который вы хотите получить), причем в качестве чернил вы должны использовать кровь только что принесенного в жертву козла. Козел должен быть не старше одного года и без изъяна. Затем надо произнести вслух семь раз заклинание Циглера-Натта, после чего исполнить ритуальный танец тактичности. Если полимеризация прошла успешно, то должен налететь холодный и буйный вихрь и погасить все свечи, после чего он стихнет так же внезапно, как и появился. Важно также, чтобы тот, кто совершает этот обряд постился три дня до него и три дня после. Если вы точно будете следовать этим правилам, то ,как правило, фокус сработает.
Ну ладно, на самом деле все происходит немного иначе, но наши познания о том, как происходит полимеризация Циглера-Натта, и почему один набор инициаторов подходит лучше другого довольно-таки ограничены. Выбор необходимых параметров и условий для проведения успешной реакции Циглера-Натта чаще похож на колдовство, чем на науку. Но тем не менее что-то мы знаем. Мы знаем, что в этой реакции участвует катализатор, содержащий переходной металл, как например TiCl 3 . Мы также знаем, что необходимы также сокатализаторы, и они как правило являются соединениями металлов третьей группы таблицы Менделеева, как например, соединения алюминия. В большинстве случаев нашей парой катализатор/сокатализатор является TiCl 3 и Al(C 2 H 5 ) 2 Cl, или TiCl 4 и Al(C 2 H 5 ) 3 . 




Вот тут-то и оказывается кстати оказавшийся неподалеку виниловый мономер, например пропилен. В p -подсистеме двойной углерод-углеродной связи у него есть пара электронов. Эти электроны могут быть использованы для заполнения пустой орбитали атома титана. Мы говорим, что атомы пропилена и титана образуют комплекс, и мы изображаем его вот так: 
Узнать об образовании комплекса алкена с металлом
Перейти непосредственно к полимеризации
Комплексы алкенов с металлами
А теперь давайте еще разок посмотрим на атом титана. На этом рисунке показаны две самые верхние орбитали атома титана. (Да, на самом деле их больше двух, но сейчас мы хотим вам показать для ясности только две из них.) 


Полимеризация
Точно описать природу комплекса между атомами титана и молекулой пропилена довольно сложно. Чтобы упростить картину, отныне мы будем рисовать этот комплекс так, как мы уже делали раньше, вот так: 

То, что происходит дальше, мы называем миграцией. Мы не знаем, почему это происходит, мы только знаем, что это происходит. Атомы перестраиваются так, что образуют структуру, немного отличающуюся от той, что мы видели раньше, а именно вот такую: 
Поэтому когда вблизи оказывается еще одна молекула пропилена, то весь процесс начинается сначала, и в конце концов мы получаем нечто вроде этого:
И конечно же, по мере того, как в реакцию вступают все новые и новые молекулы пропилена, наша молекула пропилена продолжает расти. Посмотрите на рисунок, и вы увидите, что все метильные группы в растущей молекуле полимера расположены с одной и той же стороны от основной цепи. Таким методом мы получаем изотактический полипропилен. По некоторой причине приближающаяся молекула пропилена может вступить в реакцию только в том случае, если она направлена необходимым образом, причем именно таким, который дает нам изотактический полипропилен. Мы не знаем точно, почему это происходит, мы просто знаем, что это происходит именно так.
Если вы хотите посмотреть фильм о синтезе изотактического полипроплена при использовании катализаторов Циглера-Натта, нажмите сюда!
Часть Вторая: Синдиотактическая полимеризация
Набор катализаторов, который мы только что рассмотрели, дает нам изотактические полимеры. Но другие наборы позволяют нам получать и синдиотактические полимеры. Тот набор катализаторов, который мы сейчас рассмотрим, содержит ванадий, а не титан. Этот набор включает VCl4/Al(C2H5)2Cl. Он выглядит так, как показано на рисунке слева, что не слишком отличается от титансодержащего набора катализаторов. Чтобы упростить объяснение, во время нашего небольшого обсуждения мы будем рисовать его так, как показано на рисунке справа.



Если вы хотите посмотреть фильм о синтезе изотактического полипроплена при использовании катализаторов Циглера-Натта, нажмите сюда!
http://spravochnick.ru/himiya/nomenklatura_alkenov/koordinacionnaya_polimerizaciya_alkenov/
http://www.pslc.ws/russian/ziegler.htm