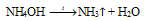Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Практическая работа 5. Получение аммиака и изучение его свойств.
Получение аммиака и растворение его в воде
1) В фарфоровой ступке хорошо перемешайте приблизительно равные объёмы кристаллического хлорида аммония NH4Cl и порошка гидроксида кальция Ca(OH)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1 /3 её объёма. Закройте пробирку пробкой с газоотводной трубкой; конец которой опущен в другую сухую пробирку, закреплённую в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке.
2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку.
3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты.
О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диссоциации?
Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции
Горение аммиака в кислороде
Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23).
Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Взаимодействие аммиака с кислотами
В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5-6 мм от поверхности кислоты.
Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций.
Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней.
Получение аммиака и изучение его физических и химических свойств
Получение аммиака.
Проведем все действия, описанные в учебнике. Из газоотводной трубки будет выделяться аммиак. Он растворяется в воде, пропитавшей фенолфталеиновую бумажку. Уравнение реакции имеет вид:
В результате образуется гидроксид аммония, который имеет щелочную реакцию окрашивает индикатор в малиновый цвет.
Изучение свойств аммиака
Если поднести к отверстию пробки стеклянную палочку, смоченную концентрированной соляной кислотой, то над отверстием образуется белая дымка. Происходит реакция:
NH4Cl обладает летучестью, его частички поднимаются вместе с аммиаком. Их мы и видим в виде белой дымки. Проведем растворение аммиака так как это описало в учебнике. Из-за очень хорошей растворимости аммиака вода в пробирке поднимается. Образуется NH4OH.
1. Запишем уравнение реакции между Са(ОН)2 и NH4Cl:
Как можно видеть из уравнения, в реакции образуются пары воды. Они конденсируются на более холодных стенках пробирки. Если капельки воды попадут на раскалённое дно, то пробирка может треснуть. Поэтому ее наклоняют таким образом, чтобы капельки скатывались к отверстию пробирки.
2. Аммиак легче воздуха (т.к. М(NH3) = 17 г/моль.
М(воздуха) = 29 г/моль). Он поднимается вверх, поэтому его надо собирать в перевернутую пробирку. Аналогично можно собирать Н2 (М = 2 г/моль), СН4 — метан (М= 16 г/моль); Не (М= 4г/моль) и другие.
З. Если вместо НСl поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой, то мы ничего не увидим:
NH4NO3 — не обладает летучестью.
4. Обычно для определения оснований используют реакции с образованием нерастворимых гидроксидов, например, Mg(OH)2. Уравнение реакции имеет вид:
Выпадает белый осадок.
Изучение свойств водного раствора аммиака.
1. Водный раствор аммиака имеет щелочную среду, т.е. дает малиновую окраску с фенолфталеином. При кипячении раствора гидроксид аммония разлагается, в результате чего аммиак улетучивается, а раствор становится нейтральным.
Фенолфталеин в нейтральной среде — бесцветный.
2. Фенолфталеин дает малиновую окраску в растворе гидроксида аммония, так как тот является основанием. При добавлении соляной кислоты происходит нейтрализация раствора и цвет исчезает.
3. Происходит взаимодействие между раствором АlCl3 и NH4OH.
http://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/prakt/5.html
http://buzani.ru/khimiya/o-s-gabrielyan-9kl/593-prakticheskaya-rabota-7-poluchenie-ammiaka-i-izuchenie-ego-svojstv