Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Технология улавливания и переработки химических продуктов коксования
донецкий национальный технический университет
технология улавливания и переработки химических продуктов коксования
улавливание аммиака из коксового газа.
получение сульфата аммония сатураторным методом
улавливание аммиака из коксового газа.. 3
Выход аммиака при коксовании углей. 3
Свойства и применение аммиака. 4
Методы извлечения аммиака из коксового газа. 4
ПРОИЗВОДСТВО СУЛЬФАТА АММОНИЯ.. 5
Сульфат аммония, его свойства и применение. 5
Способы получения сульфата аммония. 6
Сатураторный способ получения сульфата аммония.. 8
Технология получения сульфата аммония сатураторным методом. 8
Физико-химические основы сатураторного процесса. 11
улавливание аммиака из коксового газа
Выход аммиака при коксовании углей
Аммиак образуется в процессе коксования из азота и водорода каменного угля. Большая часть азота угля (до 60%) остается в коксе в виде термически устойчивых азотистых соединений, а остальная часть удаляется из угля вместе с летучими продуктами коксования — газом, смолой и надсмольной водой.
В газе азот находится, главным образом, в виде элементарного азота (20-30%), аммиака (10-17%), цианистого водорода (до 3%) и легких пиридиновых оснований (0,07-0,1%), в каменноугольной смоле азот находится в виде пиридиновых и хинолиновых оснований и других органических соединений, а в надсмольной воде в виде цианидов, роданидов и других солей аммония.
Выход этих продуктов при коксовании зависит от содержания азота в углях, степени метаморфизма и влажности последних, от температуры и скорости коксования, а также от температуры подсводового пространства коксовых камер и времени пребывания в нем летучих продуктов коксования. Образование аммиака при коксовании углей начинается при температуре около 600°С, а максимальный выход его достигается при тем пературах 800-900°С, хотя при этом равновесие реакции диссоциации сильно сдвинуто вправо. Объясняется это тем, что в коксовых камерах аммиак сильно разбавлен паро — и газообразными продуктами и время пребывания его в зоне высоких температур ограничено. При контакте с раскаленным коксом аммиак превращается в цианистый водород по реакции
С + NH3 ® НСN + Н2
При температуре 1000°С доля аммиака, превращающегося в синильную кислоту, достигает 25%.
При коксовании донецких углей выход аммиака составляет 0,25- 0,30% от массы сухой шихты. Около 30% его растворяется в надсмольной воде при охлаждении коксового газа, а остальное количество извлекается из коксового газа различными методами.
Максимальный выход пиридиновых оснований наблюдается при температуре около 650°С. При 800-900°С примерно 6-8% их превращается в цианистый водород, а выше 900°С они полностью разлагаются.
Выход пиридиновых оснований составляет около 100г на 1 тонну сухой шихты. Часть их выделяется из газа со смолой и конденсатом первичных холодильников, а другая часть вследствие большой летучести пиридиновых оснований поступает с газом в аппаратуру сульфатного и бензольного отделений.
В зависимости от состава шихты, условий коксования и охлаждения коксового газа в нем остается после первичных холодильников 5-8 г/нм3 аммиака и 0,2-0,4 г/нм3 пиридиновых оснований.
Свойства и применение аммиака
Аммиак-бесцветный газ с резким запахом, обнаруживаемым при концентрациях в воздухе около 0,04 г/м3. При содержании в воздухе 1,5- 2,7 г/м3 аммиак в течение от получаса до 1 часа действует смертельно или вызывает опасное для жизни отравление. В присутствии кислорода и водяного пара, особенно при наличии сероводорода и синильной кислоты, аммиак оказывает сильное корродирующее действие.
При улавливании бензольных углеводородов присутствие в газе аммиака вызывает ухудшение качества поглотительного масла, нарушение технологического режима. Влияние аммиака особенно усиливается при повышенном содержании воды в поглотительном масле. Объясняется это тем, что аммиак и его соединения с сероводородом и цианистым водородом хорошо поглощаются водой и, попадая таким образом в масло, способствуют полимеризации непредельных соединений и снижению поглотительной способности масла.
При сжигании аммиаксодержащего газа образуются окислы азота, вредно действующие на органы дыхания человека.
Поэтому выделение аммиака из коксового газа является непременным условием нормальной работы коксохимического предприятия и обеспечения безопасных условий труда в цехах улавливания химических продуктов. При использовании коксового газа для бытовых целей концентрация аммиака в нем не должна превышать 0,3г на 100м3.
Аммиак находит широкое применение для получения минеральных удобрений, используемых в сельском хозяйстве в виде концентрированной аммиачной воды, жидкого аммиака, азотнокислых, сернокислых, фосфорнокислых солей аммония и др. Кроме того, он служит для производства взрывчатых веществ, красителей, нитролаков, в качестве хладагента.
С развитием производства синтетического аммиака аммиак коксохимического происхождения утратил свое значение из-за высокой стоимости и наличия большого количества вредных примесей. Поэтому в некоторых странах считают экономически оправданным сжигание извлекаемого из коксового газа аммиака в специальных печах до элементарного азота.
Методы извлечения аммиака из коксового газа
Для извлечения аммиака из коксового газа с получением в качестве товарного продукта концентрированной аммиачной воды или безводного аммиака применяются методы, основанные на абсорбции его водой или водными растворами кислых солей слабых кислот в скрубберах с последующей десорбцией аммиака из насыщенных растворов в дистилляционных колоннах. В настоящее время в связи с высокой стоимостью и низким качеством получаемых продуктов в сравнении с продуктами на основе синтетического аммиака эти методы имеют ограниченное применение. Более широкое распространение получили методы извлечения аммиака из коксового газа растворами сильных кислот (серной, фосфорной) с получением в качестве продукта соответствующих аммонийных солей.
ПРОИЗВОДСТВО СУЛЬФАТА АММОНИЯ
Сульфат аммония, его свойства и применение
Сульфат аммония (NН4)2SO4 получают на коксохимических заводах в сульфатном отделении цеха улавливания. Исходным сырьем для получения сульфата аммония служит аммиак, содержащийся в коксовом газе.
Получение сульфата аммония основано на реакции нейтрализации аммиака серной кислотой в сатураторах или абсорберах:
2NH3 + Н2SO4 ® (NН4)2SO4 + q
Сульфат аммония представляет собой белые, прозрачные кристаллы формы удлиненного ромба величиной от сотых и десятых долей миллиметра до 6—8 мм и больше Плотность кристаллического сульфата аммония при 20°С составляет 1,768 г/см3. Насыпная масса в зависимости от крупности кристаллов и содержания влаги колеблется в пределах 780—830 кг/м3. Сульфат аммония хорошо растворяется в воде. С повышением температуры растворимость его в воде увеличивается. Химически чистый сульфат аммония содержит 21,237% N2 или 25,76% NН3.
Важным показателем качества сульфата аммония является размер кристаллов. Мелкокристаллическая структура соли с сильно развитой поверхностью является причиной повышенного содержания в ней влаги и серной кислоты, что приводит к слеживанию при хранении и срастанию ее в агломераты. Крупнокристаллическая соль менее подвержена слеживанию и равномерно распределяется в почве при использовании ее в качестве удобрения.
Сульфат аммония содержит около 24% серы, которая в виде сульфат-иона поступает в почву вместе с удобрением. Сульфат аммония является ценным удобрением для сельскохозяйственных полей и поэтому занимает одно из ведущих мест среди продуктов коксохимического производства. Среди азотных удобрений, применяемых в сельском хозяйстве, большое место занимает сульфат аммония. В мировом производстве азотных удобрений на долю сульфата аммония приходится более 20% от всего производства связанного азота. Ценность этого удобрения обусловлена высоким содержанием азота, по сравнению с другими азотными удобрениями (чилийской селитрой, содержащей 15—16%, норвежской селитрой, содержащей 13—14% и естественным удобрением, содержащим 6-7% азота); азот хорошо усваивается из почвы корнями растений. Содержащаяся в сульфате аммония сера является необходимым элементом питания для многих сельскохозяйственных культур (свеклы, хлопчатника, табака и др.), поэтому сульфат аммония можно считать удобрением, содержащим питательных веществ более 45% и обладающим высокими агротехническими свойствами.
Сульфат аммония производится на коксохимических заводах в больших количествах. На 1т сухой шихты производство сульфата аммония (сухого) составляет 11,0—11,5кг.
Способы получения сульфата аммония
Существует три классических способа получения сульфата аммония: непрямой, прямой и полупрямой.
Сущность непрямого, или косвенного способа заключается в том, что аммиак из коксового газа улавливается в аммиачных скрубберах с получением слабой скрубберной аммиачной воды. Отгонку (десорбцию) аммиака из слабой аммиачной воды проводят в дистилляционных колоннах с получением газообразного аммиака. Пары аммиака из колонн поступают в сатуратор, где он связывается серной кислотой в сульфат аммония, т. е. сульфат аммоний получается не непосредственно из газа, а путем некоторых промежуточных операций.
Косвенный способ получения сульфата аммония имеет большую гибкость процесса, позволяющую вырабатывать в зависимости от меняющихся условий рынка сульфат аммония или концентрированную аммиачную воду, или одновременно оба продукта в одном цехе. Важным преимуществом этого способа является также производственная надежность, так как различные отделения цеха слабо связаны между собой и поэтому производственные нарушения в аммиачном или сульфатном отделениях могут быть устранены без остановки остальных отделений, при подаче получаемой в скрубберах аммиачной воды на склад.
Этот метод характеризуется значительным расходом холодной воды для улавливания аммиака в скрубберах большими потерями аммиака с обратным газом. Он не нашел промышленного применения в отечественной коксохимической промышленности. За рубежом этот метод применяется при комбинированном улавливании из газа аммиака и сероводорода.
Прямой метод заключается в том, что весь аммиак, образующийся при коксовании, извлекается из коксового газа серной кислотой до oxлаждения в первичных холодильниках. Из газосборника горячий коксовый газ поступает в электрофильтр для очистки от туманообразной смолы, а затем в сатуратор, где аммиак связывается серной кислотой с образованием насыщенного раствора и кристаллов сульфата аммония.
Отличительной особенностью этого метода является то, что при охлаждении коксового газа после сатуратора в первичных холодильниках образующийся конденсат (надсмольная вода) не содержит аммиака и аммонийных солей и поэтому отпадает необходимость eгo переработки в аммиачной колонне. Выделившийся из газа водяной конденсат (надсмольная вода) полностью используется для пополнения воды цикла газосборника и, таким образом, избытка надсмольной воды не получается. Отсутствие аммиачного отделения позволяет снизить расход пара, стоимость оборудования и занимаемую производственную площадь, а также сократить до минимума объем сточных вод (около 50м3 на 1000 т коксуемого угля).
Однако широкого распространения этот метод не получил из-за существенных недостатков:
— наличия большого числа аппаратов, работающих под разрежением, что повышает вероятность подсоса воздуха и образования взрывоопасной смеси, увеличивает расход электроэнергии на транспортирование газа;
— интенсивное протекание коррозионных процессов в сатураторе, что обусловливается присутствием хлористого аммония и образованием летучей соляной кислоты;
— трудности очистки газа от смолы при высокой температуре, что приводит к образованию большого количества кислой смолки в сатураторе и загрязнению сульфата аммония;
— получение мелкокристаллической соли, что вызвано высокой температурой процесса;
— громоздкость аппаратурного оформления из-за высокой температуры газа и большого его влагосодержания;
— невозможности улавливания в сатураторе легких пиридиновых оснований из-за высокой температуры раствора и отсутствия аммиачных паров для eгo нейтрализации в пиридиновой установке.
Полупрямой метод получил широкое распространение как на отечественных коксохимических заводах, так и за рубежом. Этот метод является как бы комбинацией непрямого и прямого методов. Особенностью полупрямого метода получения сульфата аммония является то, что не весь аммиак, образующийся при коксовании, поступает с газом в сатуратор, а только 70—75% от его ресурсов в газе. Часть аммиака, до 25—30 % от его ресурсов в газе, растворяется в надсмольной воде, образующейся при охлаждении газа в первичных холодильниках. Эта вода перерабатывается в аммиачном отделении с получением пароаммиачной смеси, которая направляется в сатуратор, где вместе с аммиаком из газа связывается серной кислотой. Аммиачные пары из колонны аммиачного отделения могут быть направлены в пиридиновую установку, где наряду с пиридиновыми основаниями образуется сульфат аммония — целевой продукт сульфатного отделения. Необходимость дополнительной переработки больших количеств надсмольной воды является недостатком метода, так как требует установки соответствующей аппаратуры и оборудования, больших энергетических затрат.
Несмотря на указанный выше недостаток, полупрямой метод наиболее распространен, так как надежен, удобен в управлении, сравнительно прост по технологической схеме и экономичен, часть аммиачных паров может применяться для получения пиридиновых оснований.
В зависимости от аппаратурного оформления процессов поглощения аммиака серной кислотой и кристаллизации сульфата аммония различают две разновидности полупрямого способа, получившего наибольшее распространение в промышленности, сатураторный и бессатураторный. Сатураторным называется процесс, при котором поглощение аммиака из коксовоro газа серной кислотой и образование кристаллов сульфата аммония осуществляются в одном аппарате барботажного типа, называемом сатуратором. При бессатураторном способе поглощение аммиака серной кислотой производится в форсуночном (или насадочном) скруббере, который может орошаться как пересыщенным, coдержащим кристаллы сульфата аммония, раствором, так и ненасыщенным раствором. В первом случае кристаллизация сульфата аммония происходит одновременно с поглощением аммиака в скруббере, а во втором образование пересыщенногo раствора и кристаллов сульфата аммония осуществляется при выпаривании раствора в специальном аппарате – кристаллизаторе.
Преимуществами бессатураторных процессов является меньшее гидравлическое сопротивление форсуночных абсорберов и возможность проведения отдельных стадий процесса (абсорбции аммиака, кристаллизации сульфата аммония и др.) при наиболее благоприятных условиях.
Сатураторный способ получения сульфата аммония
Технология получения сульфата аммония сатураторным методом
Этот метод получил наибольшее распространение на коксохимических заводах, что объясняется высокой надежностью процесса очистки коксового газа от аммиака и простотой аппаратурного оформления. Типовая схема сульфатного отделения, оборудованного барботажными сатураторами, представлена на Рис.1.
Охлажденный в первичных холодильниках до 25-30°С и очищенный от смолы коксовый газ подается нагнетателем через паровой подогреватель 1 в сатуратор 2 по центральной трубе с барботажным зонтом, погруженным в маточный раствор на 250-280 мм. Вместе с коксовым газом в сатуратор поступают также аммиачные пары из дефлегматора аммиачной колонны. Общий вид сатуратора приведен на Рис. 2.
Барботажный зонт представляет собой конический колпак, к которому снизу прикреплены лопатки, изогнутые под некоторым углом к радиальному направлению (Рис. 3.) Поток газа делится лопатками на отдельные струи и барботирует через раствор по окружности у основания зонта. Направляющие лопатки закручивают газовые струи и создают интенсивное круговoe движение раствора, что способствует перемешиванию и обновлению раствора в зоне реакции между аммиаком и серной кислотой. Последняя непрерывно поступает в сатуратор из напорного бака 3, равномерно распределяясь в зоне реакции с помощью кольцевой трубы с отверстиями, закрепленной вокруг газоподводящей трубы над барботажным зонтом.
Благодаря тесному контакту газа с кислым маточным раствором в сатураторе обеспечивается практически полное улавливание аммиака. При нормальном режиме работы содержание аммиака в газе после сатуратора не превышает 0,03г/м3.
При прохождении (барботировании) газа через маточный раствор аммиак вступает в реакцию взаимодействия с серной кислотой и образует с ней конечный продукт — сульфат аммония. Процесс нейтрализации аммиака серной кислотой протекает в две ступени: сначала образуется кислая соль – бисульфат аммония по уравнению
NН3 + Н2SO4 ® NН4НSO4.
По мере насыщения раствора аммиаком кислая соль переходит в среднюю, т. е. сульфат аммония:
NН3 + NH4HSO4 ® (NН4)2SO4.
Эти реакции протекают с выделением тепла, количество которого зависит от условий ведения процесса.
Соотношение между сульфатом и бисульфатом, находящимися в растворе обусловливается его кислотностью. При очень низкой кислотности (1—2%) в растворе преобладает сульфат, который выпадает из пересыщенного раствора в виде кристаллов. При повышении кислотности раствора (выше 12—15 %) средняя соль (сульфат) переходит в кислую (бисульфат), которая обладает лучшей растворимостью в воде и слабом растворе серной кислоты, чем сульфат и остается в растворенном виде, т. е. при высокой кислотности в растворе находится главным образом бисульфат аммония. По достижении пределов растворимости из раствора в первую очередь выпадают кристаллы сульфата аммония.
Так как процесс нейтрализации при производстве сульфата аммония осуществляется при непрерывном поступлении реагентов с непрерывным отбором готовой соли, то в растворе, заполняющем сатуратор, одновременно находятся бисульфат и сульфат аммония, вода и серная кислота. Этот раствор принято называть маточным раствором. Кислотность маточного раствора в сатураторе поддерживается автоматически.
Одновременно с основным процессом — улавливанием аммиака, в сатураторе протекают реакции связывания серной кислотой пиридиновых оснований, содержащихся в коксовом газе, с образованием средней соли сульфата пиридина и кислой — бисульфата пиридина.
Таким образом, в сатураторе одновременно протекает абсорбция (хемосорбция) аммиака и пиридиновых оснований и кристаллизация соли сульфата аммония. Каждый из этих процессов требует создания определенных условий, обеспечивающих высокую степень улавливания аммиака и пиридиновых оснований получение крупнокристаллической соли сульфата аммония.
Эффективность всех этих процессов обусловливается поддержанием в сатураторе оптимальных температуры и кислотности маточного раствора, наличием центров кристаллизации соли сульфата аммония и интенсивным перемешиванием раствора в ванне сатуратора.
Очищенный газ выводится из сатуратора при температуре 55.65°С через штуцер в крышке аппарата в кислотную ловушку 4, гдe происходит отделение унесенных газовым потоком капель раствора, и направляется далее в конечные газовые холодильники для охлаждения до 25-30°С перед улавливанием бензольных углеводородов.
Образующийся в зоне реакции пересыщенный раствор сульфата аммония служит питательной средой для образования и роста кристаллов. С целью создания блaгoприятных условий для роста кристаллов мaточный раствор в ванне сатуратора интенсивно перемешивается с помощью насоса 5, забирающего раствор из средней зоны сатуратора и подающего eгo в нижнюю коническую часть через специальное сопло ажитатор 6. Благодаря этому в ванне сатуратора создается восходящий поток маточного раствора, поддерживающий мелкие кристаллы во взвешенном состоянии.
По мере роста кристаллы оседают на дно сатуратора, откуда cycпензия подается насосом 7 в кристаллоприемник 8, где происходит разделение фаз по плотности. Отстоявшийся раствор непрерывно стекает через штуцер в верхней части кристаллоприемника в кастрюлю обратных токов 9 и далее в ванну сатуратора, а осевшая пульпа из нижней части кристаллоприемника поступает самотеком в центрифугу 10 непрерывного действия. Под действием центробежных сил происходит отделение маточного раствора от кристаллов и промывка последних горячей водой (паровым конденсатом) для удаления остатков серной кислоты. Раствор из центрифуги возвращается в сатуратор через сборник 11, а влажный сульфат аммония подается ленточным конвейером в сушилку и далее на склад.
В процессе работы сатуратора на поверхности маточного раствора накапливается кислая смолка – продукт взаимодействия тyманообразной смолы и непредельных соединений с серной кислотой, которая при наличии в растворе нерастворимых соединений железа и других металлов, так называемых шламов, может оседать вместе с кристаллами сульфата аммония, придавая продукту серую окраску и снижая его качество.
Для удаления кислой смолки часть маточного раствора непрерывно выводится из сатуратора через переливное окно и гидравлический затвор в циркуляционную кастрюлю 13, из которой насосом 14 вновь возвращается в сатуратор.
В циркуляционной кастрюле кислая смолка всплывает на поверхность раствора и выводится через сливной карман в специальную емкость. Время пребывания раствора в кастрюле должно быть достаточным для возможно полного выделения кислой смолки. Поэтому количество циркулирующеro через кастрюлю раствора не должно превышать 10-12 м3/час. На некоторых заводах перелив из циркуляционной кастрюли поступает в специальный сборник для более полного отстаивания раствора.
Переливное окно в сатураторе служит также для поддержания постоянного уровня раствора в нем. При образовании избытка маточного раствора в системе часть eгo переливается из циркуляционной кacтрюли в сборник 15, из которого по мере надобности он возвращается в сатуратор насосом 14.
Одновременно с улавливанием аммиака в сатураторе происходит также поглощение легких пиридиновых оснований. Для их выделения часть маточного раствора выводится из сульфатного отделения в пиридиновую установку. Обеспиридиненный маточный раствор возвращается из пиридиновой установки в сборник 15 или в циркуляционную кастрюлю, откуда подается насосом 4 в сатуратор.
Физико-химические основы сатураторного процесса
Особенностью сатураторного процесса является одновременное улавливание из газа аммиака и пиридиновых оснований и кристаллизация соли сульфата аммония.
Максимальный эффект каждого из этих процессов может быть достигнут при различных физико-химических условиях, которые создать одновременно в одном аппарате трудно.
Важнейшими факторами, влияющими на ход сатураторного процесса являются: температура и кислотность маточного раствора, интенсификация массообмена в ванне сатуратора и чистота маточного раствора.
Химизм процесса, лежащий в основе получения сульфата аммония в сатураторе, сводится к реакции нейтрализации аммиака серной кислотой. Реакция эта протекает с огромной скоростью и как всякая реакция нейтрализации, сопровождается выделением тепла. На 1кг сульфата аммония выделяется 1173,20 кДж (280 ккал), что является основным источником тепла в сатураторе. При правильном режиме работы сатуратора этого тепла должно быть достаточно для выпаривания всей избыточной влаги, которая поступает в сатуратор: с коксовым газом, с пароаммиачной смесью после колонны, с раствором после пиридиновой установки, с серной кислотой, от промывки трубопроводов, солевых насосов и ловушки, соли в центрифугах и сатуратора, это же тепло служит для поднятия температуры маточного раствора до оптимальной величины (50—55 °С), восполнения потерь тепла поверхностью сатуратора, потерь тепла с циркулирующим маточным раствором и выдаваемым сульфатом аммония.
Рис. 1.Схема получения сульфата аммония по сатураторному методу:
1-подогреватель; 2-сатуратор; 3-напорный бак серной кислоты; 4-кислотная ловушка; 5, 14 — насосы циркуляционные; 6 — ажитатор; 7 — насос солевой; 8-кристаллоприемник; 9-кастрюля обратных токов; 10- центрифуга; 11,15-сборники маточного раствора; 12-транспортер; 13-кастрюля циркуляционная
Рис. 2. Сатуратор с жидкостным ажитатором и инжектором:
1 — патрубки для выхода газа; 2 — крышка; 3 — цилиндрическая обечайка; 4 — штуцер; 5 — коническое днище; 6 — штуцер для вывода суспензии кристаллов; 7 — барботажный зонт; 8 — патрубок для входа газа; 9 — питающая труба; 10 — сопло; 11 — горловина жидкостного ажитатора (инжектор)
Рис. 3. Барботажный зонт:
1–коническая обечайка; 2–лопатки
Практически не всегда удается выдерживать оптимальный тепловой режим работы сатуратора только за счет тепла реакции нейтрализации. Это объясняется недостаточным охлаждением газа в первичных холодильниках и, следовательно, повышением содержания в газе паров воды, неудовлетворительной работой дефлегматора аммиачной колонны, влекущей увеличение количество водяных паров в пароаммиачной смеси и подачей в сатуратор более слабой серной кислоты.
В этих случаях не достигается испарения всей добавочной влаги, т. е. нарушается тепловое равновесие в сатураторе.
Вода из сатуратора выводится почти полностью в парообразном состоянии с коксовым газом (около 99% от ее ресурсов). Очень незначительное количество воды (около 1%) удаляется с сульфатом аммония.
При недостатке тепла в маточном растворе сатуратора происходит накапливание воды, что приводит к обводнению раствора и расстройству технологического процесса, так как из разбавленного раствора перестает выкристаллизовываться сульфат аммония. Образующийся избыток маточного раствора выводится из сатуратора в сборник. Выпаривание избыточной воды при возвращении раствора в сатуратор требует повышения температуры газа и маточного раствора, что связано с увеличением объема газа, сопротивления сатуратора, ухудшением качества сульфата аммония и затруднением в работе конечного газового холодильника. Поэтому обводнение маточного раствора сатуратора рассматривается как авария.
Для восстановления необходимого количества тепла газ перед входом в сатуратор подогревается в подогревателе или может нагреваться маточный раствор.
Нормальный (оптимальный) технологический режим при работе пиридиновой установки характеризуется следующим распределением температуры: температура газа после первичных холодильников 25—30°С, после нагнетателя 35—45°С, после подогревателя газа 53—58°С, температура маточного раствора в сатураторе 53—55°С.
Кристаллизация сульфата аммония из маточного раствора является таким же важным элементом сатураторного процесса, как и тепловое равновесие. Процесс кристаллизации состоит из двух стадий — образование центров кристаллизации (зародышей) и дальнейшего роста кристаллов. Количество образующихся центров кристаллизации зависит от различных причин: температуры маточного раствора, его кислотности и чистоты, интенсивности перемешивания у граней кристаллов.
Повышение температуры способствует образованию большого числа центров кристаллизации, т. е. получению мелких кристаллов. Поэтому необходимо поддерживать предельно низкую температуру ванны сатуратора, не выше той, при которой уже не нарушается тепловое равновесие сатуратора и не обводняется
ванна. Не следует допускать местного переохлаждения маточного
раствора при его циркуляции, так как это вызывает образование дополнительных центров кристаллизации. Росту кристаллов способствует более низкая температура маточного раствора. При температуре выше 55—60°С рост кристаллов сульфата аммония прекращается.
При высокой температуре ванны (выше оптимальной) образуется мелкая соль, кристаллы агрегируются в сростки с развитой поверхностью, на которой удерживается влага и кислота, что ухудшает качество сульфата аммония.
Образованию большого количества центров кристаллизации способствует повышенная концентрация кислоты, быстрое достижение состояния насыщения (при быстром охлаждении), а также наличие так называемой затравки, т. е. кристаллов, пыли и других примесей.
Кислотность маточного раствора влияет на рост и форму кристаллов, степень улавливания аммиака и пиридиновых оснований из коксового газа.
Повышенная кислотность раствора приводит к прекращению роста и растворению кристаллов, возрастанию вязкости и плотности раствора, в результате чего замедляется оседание кристаллов сульфата аммония в конусе сатуратора, а выводимый в кристаллоприемник раствор не содержит крупных кристаллов. Мелкие кристаллы очень плохо фугуются, забивают сита в центрифуге, плохо отмываются от кислоты, а при хранении быстро слеживаются, образуя глыбы и комья.
При кислотности раствора 1—2% получаются крупные и хорошие по форме кристаллы соли. Однако при этом происходит обильное выделение кристаллов, что затрудняет работу солевых насосов, вызывает наращивание кристаллов на стенках сатуратора, в щелях барботажного зонта, приводит к увеличению сопротивления сатуратора газовому потоку, к уносу брызг маточного раствора в ловушку. Низкая кислотность маточного раствора приводит к потерям аммиака и пиридиновых оснований с обратным газом. Таким образом, кислотность ванны сатуратора должка быть по возможности ниже, но достаточной для полноты улавливания аммиака и пиридиновых оснований из газа. В свою очередь кислотность раствора должна быть постоянной и не превышать 4—5%. При наличии эффективного перемешивающего устройства в ванне сатуратора кислотность раствора поддерживают на уровне 3—4%. С повышением кислотности до 6% и выше резко ухудшается форма кристаллов, уменьшаются их размеры, образуются сростки кристаллов, что приводит к отложению соли на стенках сатуратора. С повышением кислотности раствора затрудняется поддержание допустимой нормы содержания свободной серной кислоты в товарном сульфате аммония, увеличивается расход воды на его промывку в центрифуге, увеличивается время сушки.
Возникновение местных пересыщений маточного раствора предупреждается интенсивной циркуляцией раствора, подачей коксового газа и серной кислоты в строго эквивалентных количествах и по возможности равномерно во все точки ванны сатуратора.
Интенсификация роста кристаллов соли достигается перемешиванием и циркуляцией маточного раствора и объемной нагрузкой сатуратора по газу. Перемешивание раствора увеличивает время пребывания кристаллов во взвешенном состоянии, что обусловливает большую продолжительность их роста.
Интенсивное перемешивание верхних слоев маточного раствора в ванне сатуратора возможно благодаря особой конструкции барботажного зонта.
К нижней поверхности барботажного зонта по всей его окружности прикрепляются 50 направляющих лопаток, расположенных под углом к поверхности зонта, в результате коксовый газ, кроме перемешивания раствора при барботаже, приводит его также во вращательное движение. Интенсивное перемешивание в нижней части сатуратора достигается работой циркуляционного насоса.
Существуют различные устройства, обеспечивающие интенсивное перемешивание маточного раствора. Любая конструкция должна обеспечить: достаточное время пребывания кристаллов в пересыщенном растворе; непрерывный обмен абсорбционного слоя у граней кристаллов, т. е. приток к граням кристаллов новых порций пересыщенного раствора; сепарацию кристаллов, т. е. отделение крупных от мелких.
Одним из решающих факторов, обеспечивающих интенсификацию роста кристаллов, является перемешивание раствора, так как турбулизация потоков раствора в сатураторе способствует увеличению скорости подвода сульфата аммония из раствора к поверхностям кристаллов и скорости их роста. Однако само по себе перемешивание раствора еще не обеспечивает получения крупнокристаллической соли, так как при наличии мелких кристаллов в растворе, поступающем в кристаллоприемник, они оседают вместе с крупными и снижают качество продукта.
Поэтому перемешивание раствора в сатураторе должно производиться таким образом, чтобы обеспечивалась сепарация кристаллов по крупности в восходящем потоке с выделением более крупных на дно caтypaтора и уносом более мелких в зону пересыщенного раствора.
Восходящий поток в ванне сатуратора создается путем циркуляции раствора с помощью насоса или газлифта.
Жидкостный ажитатор представляет собой струйный аппарат, гдe рабочей средой служит маточный раствор, подаваемый в caтypaтоp насосом (Рис. 2). Он состоит из питающей трубы 9, оканчивающейся рабочим соплом 10. Диаметр сопла (100мм) выбран на основании гидравлического расчета из условия перепада давления 0,07 МПа. Напротив выхода раствора из сопла на расстоянии 800 мм установлен инжектор 11, из котopoгo раствор поступает через кольцевой зазор в сатуратор.
Недостатком жидкостных ажитаторов является интенсивное измельчение кристаллов под действием рабочего колеса насоса и при перемещении по трубопроводам.
Газовый ажитатор (Рис.4) состоит из конического стакана, pacположенногo под ним распределительного кольца 2 с отверстиями для выхода газа и газоподводящей трубы 3. Образуемая в стакане газожидкостная смесь поднимается вверх, создавая циркуляцию раствора внутри сатуратора.
Для подачи газа в ажитатор требуется установка компрессора типа 2ГМУ-48/3 производительностью 48м3/мин при давлении 0,2 МПа, что связано со значительными расходами. Применение газовой ажитации экономически целесообразно при наличии на предприятии сжатого коксового или природного газа.
В кольцо подается сжатый коксовый газ в количестве 1% производительности сатуратора по газу. Стакан устанавливается вертикально в конусной части сатуратора.
Газлифтный сепаратор обеспечивает движение раствора вверх внутри направляющего стакана и вниз вне стакана. Мелкие кристаллы уносятся потоком раствора внутрь стакана и длительное время находятся во взвешенном состоянии при благоприятных условиях для роста. Крупные кристаллы оседают из потока на дно ванны сатуратора, откуда подаются солевым насосом в кристаллоприемник.
На процесс кристаллизации и качество сульфата аммония сильно влияют примеси, имеющиеся в маточном растворе ванны сатуратора. Эти примеси попадают в маточный раствор с коксовым газом, серной кислотой, с парами из аммиачной колонны и в результате коррозии аппаратуры и материальной коммуникации. Содержание этих примесей в маточном растворе может колебаться в широких пределах.
Органические примеси — масла, смола, непредельные соединения, поступают в сатуратор с коксовым газом и с отработанной или регенерированной серной кислотой. Эти примеси образуют в сатураторе кислую смолку, покрывающую в виде пленки поверхность маточного раствора ванны, что увеличивает сопротивление проходу газа.
С серной кислотой в ванну сатуратора могут поступать неорганические примеси в виде соединений мышьяка, кадмия, свинца, хлора, хрома, железа, меди, алюминия и азотной кислоты, которые проявляются по-разному. Содержащиеся в маточном растворе ионы трехвалентного железа, алюминия и анионы хлора препятствуют росту кристаллов соли.
Наличие в маточном растворе органических и неорганических примесей затрудняет кристаллизацию соли, ухудшает качество сульфата аммония, затрудняет фугование соли в центрифугах, увеличивает влажность сульфата, его кислотность и требует усиленной промывки и длительной сушки товарного продукта.
Кроме того, многие примеси придают сульфату аммония специфическую окраску, которая может служить косвенным показателем чистоты товарного продукта. Серый цвет сульфату аммония придают смолистые вещества, черный — сернистые соединения железа, свинца и меди; роданистые соединения в присутствии железа придают красную или розовую окраску; цианистые соединения железа придают сульфату аммония цвет от зеленого до фиолетового; соединения мышьяка окрашивают соль в желтый цвет; смоляной туман в коричневый.
Большое значение для нормальной работы сатуратора имеет своевременное удаление солевых отложений на стенках сатуратора и на барботажном зонте. Эффективным способом удаления солевых отложений признана ежесуточная промывка сатуратора конденсатом пара (80—90°С) с подачей его в места наибольшего скопления соли.
Эффективными средствами улучшения потребительских свойств сульфата аммония, снижения eгo слеживаемости являются гранулирование и обработка поверхностно-активными веществами.
Для гранулирования сульфата аммония могут применяться грануляторы барабанного, тарельчатого и шнековогo типов, а также аппараты с псевдоожиженным слоем. В качестве антислеживающих добавок к сульфату аммония могут применяться сульфокислоты и их соли.
Рис. 4. Газовый ажитатор:
1- конический стакан; 2 — распределительное кольцо; 3 — труба для входа газа
Основными недостатками caтypaтopнoгo метода получения сульфата аммония являются:
— большое гидравлическое сопротивление барботажного аппарата, достигающее 6,5 КПа и более, что составляет 30% общего сопротивления газового тракта и аппаратуры после нагнетателей;
— совмещение в одном аппарате процессов улавливания аммиака и пиридиновых оснований и кристаллизации сульфата аммония не позволяет проводить их в наиболее благoприятных условиях, что отрицательно сказывается на работе установки и на качестве сульфата аммония;
— интенсивное отложение соли на стенках сатуратора и трубопроводов требует частых промывок большим количеством воды и кислоты, что нарушает процесс кристаллизации, делает eгo периодическим и затрудняет регулирование и обслуживание установки;
— низкая испарительная способность сатуратора, обусловленная малым временем и незначительной поверхностью контакта газа с раствором, что требует повышения температуры ванны сатуратора до 60°С и более во избежание обводнения, при которой невозможно получение крупнокристаллического продукта;
— громоздкость сатураторов, установка которых требует значительных производственных площадей и капитальных зaтpат.
Получение аммиака из коксового газа уравнение
В качестве сырья для производства аммиака может быть использован кокс, уголь, коксовый газ, природный газ. Однако, в основном, аммиак производят из природного газа. Важнейшим показателем является его потребление на тонну продукции…
Показатель потребления природного газа является одним из важнейших факторов, определяющих рентабельность производства аммиака. На выработку 1 тонны аммиака российские агрегаты потребляют 1115-1380 м3 природного газа. Зачастую высокое потребление природного газа связано с тем, что большинство российских агрегатов являются устаревшими и значительно уступают используемым в передовых странах по энерго- и материалоемкости и экологическим требованиям. Но в последние годы на большинстве предприятий проводятся работы по реконструкции и модернизации производств, в результате которых расход природного газа и электроэнергии снижается. Наилучшие показатели по расходу природного газа находятся на данный момент на уровне 1115 м3. Ниже представлены показатели потребления природного газа на некоторых российских производствах:
Таблица
Расход природного газа на производство аммиака на некоторых российских предприятиях
Предприятие
Источник: данные опросов
На данный момент основным конкурентным преимуществом российских производств аммиака является дешевый природный газ. Проследить изменение себестоимости производства аммиака в различных регионах мира можно по данным, представленным в нижеследующей таблице. Видно, что себестоимость производства аммиака в России одна из самых низких. В то же время, технологии производства, ресурсо- и энергопотребление на российских предприятиях существенно выше, чем на современных производствах, введенных в эксплуатацию в последние годы. Этот факт говорит о том, что без модернизации существующих производств, ввиду вероятного роста цен на исходное сырье, себестоимость аммиака существенно возрастет.
Таблица
Себестоимость производства аммиака в различных странах
| Страна | Цена пр. газа, $ /м 3 | Себестоимость пр-ва аммиака, $/т |
| США | 200-430 | 220-450 |
| Канада | 200-300 | 220-300 |
| Зап. Европа | 200-450 | 220-470 |
| Украина | 100-130 | 180-200 |
| Тринидад | 100 | 120-150 |
| Россия | 40-60 | 130-160 |
| Индонезия | 70-80 | 100-120 |
| Аргентина | 50-70 | 80-100 |
| Австралия | 40-60 | 70-90 |
| Венесуэла | 40-60 | 70-80 |
| Ближний Восток | 30-40 | 60-90 |
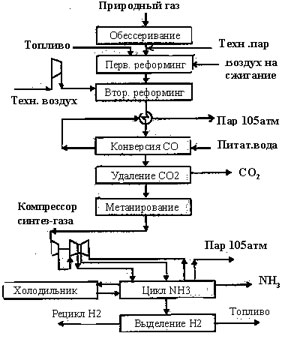
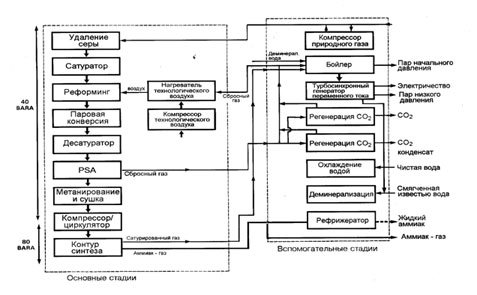
Традиционная схема получения аммиака из природного газа выглядит следующим образом:
Рис. 1.1. Традиционная схема получения аммиака из природного газа
На первой стадии происходит удаление серы из природного газа. В зависимости от содержания соединений серы в природном газе используется цеолитная очистка или очистка методом каталитического гидрирования и последующего поглощения H2S оксидом цинка. Далее природный газ поступает в реакторы реформинга. Следующим этапом идет конверсия моннооксида углерода и очистка газа от диоксида углерода. Важнейшей частью схемы является синтез аммиака. В агрегатах аммиака предыдущего поколения синтез аммиака проводят при давлении 280 — 330 бар. Для сжатия синтез газа, подаваемого в петлю синтеза требуется мощный 4-х ступенчатый компрессор с номинальной мощностью 32 МВт для агрегата, производящего 1360 тонн NH3 в сутки. Его турбина потребляет пар с давлением 100 бар и температурой 482°С в количестве 350 — 370 тонн в час. Именно эта турбина производит, а компрессор потребляет наибольшее количество механической энергии. Потери энергии только при конденсации мятого пара составляют 0.35 — 0.4 Гкал/т NH3. Чтобы сократить производство механической энергии и производство пара в рамках концепции энергосбережения и уменьшения инвестиций предлагаются новые схемы синтеза, в частности каскадный синтез аммиака при низком давлении.
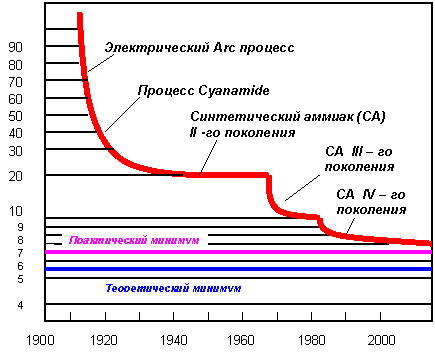
Энергопотребление является одним из важнейших параметров, определяющих рентабельность производства аммиака. В течении производителями ведутся работы по модернизации производства, которые в том числе ведут к снижению энергозатрат. По данным института катализа им. Г. К. Борескова в России действует 31 агрегат аммиака III-го поколения с расходом энергии 10.07-11.2 Гкал/т. То есть с 1960-х гг. энергопотребление снизилось на 29%.
На нижеследующей диаграмме представлена динамика изменения расхода электроэнергии по мере усовершенствования технологий производства аммиака.
Диаграмма
Динамика энергопотребления при производстве аммиака в 1920-2006 гг.
Источник: Институт катализа им. Г. К. Борескова
В результате работ по совершенствованию технологий производства карбамида был разработан ряд агрегатов IV поколения, технические показатели которых превосходят все существовавшие до этого аналоги.
Рассмотрим технологические решения, предложенные различными лицензиаторами для усовершенствования процесса синтеза аммиака.
Разработкой технологий синтеза аммиака являются фирмы Haldor Topsoe, Kellogg Brown& Root, Ammonia Casale, ICICF Braun, Uhde и др.
На рис. 1.10 и 1.11 представлены радиальные колонны синтеза аммиака, разработанные Ammonia Casale и Haldor Topsoe. Первый вариант предусматривает уменьшение давления синтеза на 30% и энергопотребления до 0,3 Гкал/т NH3. Второй – увеличение конверсии до 40% и снижение перепада давления до 60%.
 | 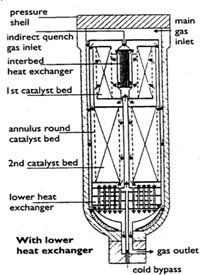 |
| Рис. 1.10. Радиальная насадка колонны синтеза Ammonia Casale | Рис. 1.11. Радиальная насадка колонны синтеза Haldor Topsoe |
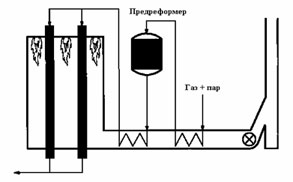
Метод повышения производительности установки реформинга без увеличения ее размеров заключается в использовании установки предриформинга. Это хорошо отработанная технология, впервые примененная компанией British Gas под названием процесса «Каталитического обогащения газа» при производстве бытового газа из лигроина в 1960-х гг.
Предреформинг позволяет снизить соотношение пар/газ, улучшить показатели сероочистки, достичь экономии топлива на 5-10% и повысить мощность собственно реформинга на 15-25%. Ниже приведен пример схемы предреформинга.
Рис. 1.12. Схема процесса предреформинга
Использование предреформинга предлагает в частности Haldor Topsoe. В целом агрегат синтеза аммиака IV-го поколения (Low Energy Process), разработанный данной компанией, представляет собой традиционную схему синтеза с оптимизированными стадиями.
Рис. 1.13. Схема агрегата ICI (LCA)
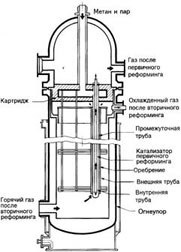
Для оптимизации процесса предлагаются следующие положения:
— соотношение пар/газ=2.8 за счет использования предреформинга и спец. катализатора СТК,
— высокая температура в первичном реформинге за счет использования жаропрочных труб,
— остаточный СОx после очистки от СО2 удаляется синтезом метанола.
Агрегаты IV-го поколения ICI (AMV Process) отличают следующие особенности:
— подача избыточного (на 20%) количества воздуха во вторичный реформинг и более мягкие условия первичного реформинга,
— низкое давление синтеза (80-110 атм),
— рекуперация водорода из продувочных газов при давлении синтеза,
— экономия энергии (6.8-6.9 Гкал/т).
В таблице представлены основные технические параметры процесса AMV фирмы ICI и традиционной технологии.
Таблица
Технические показатели процесса синтеза аммиака AMV (ICI) и традиционной технологии
| Показатели | AMV процесс | Традиционная технология |
| Типичные режимы первичного реформинга: Соотношение пар/углерод Температура газа на выходе, °С Проскок метана, %об. | 2.75-3.0 780 16 | 3.5 800-820 11 |
| Типичные режимы вторичного реформинга: Температура газа на выходе, 0С Проскок метана, %об. | 950 1.0 | 1000 0.3 |
Источник: Институт катализа им. Г. К. Борескова
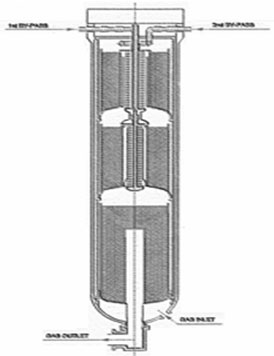
Второй процесс, разработанный ICI (LCA Process), предполагает использование первичного реформинга с газовым обогревом. На рис. 1.5 представлена схема реактора синтеза аммиака, разработанного ICI для данного процесса.
Основные особенности процесса:
— первичный реформинг без огневого подогрева,
— большой избыток воздуха во вторичном реформинге,
— соотношение пар:газ=2.5,
— конверсия СО в одну стадию,
— выделение N2, Ar, CO2 методом КЦА,
— давление синтеза – 80 атм.
Упрощенно схему процесса LCA можно представить следующим образом:
Также вкратце хотелось бы описать современные варианты агрегатов синтеза аммиака компаний Linde, Kellog Brown & Root, Lurgi.
Особенности агрегатов синтеза аммиака Linde (LAC):
— водород получают паровой конверсией при 850°С, одноступенчатой конверсией СО и КЦА,
— азот получают криогенным разделением воздуха,
— нет продувочных газов,
— общее количество катализатора снижено в 2 раза.
В агрегатах производства аммиака 4-го поколения Broun&Root Purifier process основная идея – использование во вторичном реформинге расхода воздуха на 50% выше стехиометрического с выделением избыточного азота криогенным разделением перед компрессором синтез-газа. Особенности данного процесса можно кратко представить следующим образом:
Рис. 1.14. Схема процесса синтеза аммиака LCA (ICI)
— метан и аргон выделяются криогенно. Синтез-газ содержит только 0.25% инерта (Ar),
— существенно снижена температура в первичном реформинге,
— соотношение пар/газ меньше 3,
— дополнительный воздух дает дополнительное тепло,
— остаточное содержание метана – 1.5%,
— концентрация СО после НТК – 2.35%.
Особенности процесса KAAP/KRES фирмы Kellog Brown & Root:
— отсутствие первичного реформинга,
— давление синтеза – около 90атм,
— катализатор синтеза – Ru/C,
— одноступенчатый компрессор синтез-газа,
— отделение H2 и N2 из продувочных газов,
— потребление энергии 6.5-6.7 Гкал/т NH3.
Особенности процесса Megammonia компании LURGI, мощностью 4000 тонн в сутки:
— нет первичного реформинга,
— автотермичный реформинг на кислороде при 60 атм.,
— нет НТК,
— азот после разделения воздуха,
— криогенное выделение СО2, рециркуляция СН4, СО и Ar,
— синтез при 200 атм.
С оценкой потенциала российского экспорта карбамида, текущей ситуации и прогнозе развития внутреннего рынка можно познакомиться в отчете маркетингового исследования Академии Конъюнктуры Промышленных Рынков « Рынок карбамида в СНГ ».
Об авторе:
Академия Конъюнктуры Промышленных Рынков оказывает три вида услуг, связанных с анализом рынков, технологий и проектов в промышленных отраслях — проведение маркетинговых исследований, разработка ТЭО и бизнес-планов инвестиционных проектов.
• Маркетинговые исследования
• Технико-экономическое обоснование
• Бизнес-планирование
http://pandia.ru/text/80/224/42016.php
http://www.newchemistry.ru/letter.php?n_id=682