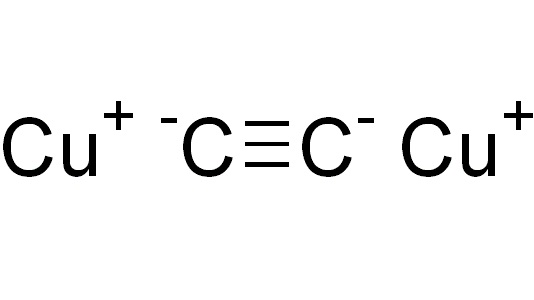Ацетиленид меди(I): получение и свойства
Ацетиленид меди является металлорганическим бинарным соединением. Данная формула известна науке по крайней мере с 1856 года. В кристаллах образует моногидрат с формулой Cu2C2×H2O. Термически неустойчив, при нагревании взрывается.
Строение
Ацетиленид меди является бинарным соединением. Можно условно выделить в нем отрицательно заряженную часть — анион C 2− 2, и положительно заряженную — катионы меди Cu + . На самом деле такое деление условно: в соединении есть лишь доля ионной связи, хотя она больше по сравнению со связью H-C≡. Но и указанная связь имеет очень сильную полярность (как для ковалентной) из-за того, что атом углерода с тройной связью находится в sp-гибридизации — его относительная электроотрицательность больше, чем в гибридизациях sp 3 (одинарная связь) или sp 2 (двойная связь). Именно это позволяет углероду в ацетилене сравнительно легко отщеплять от себя атом водорода и замещать его атомом металла, то есть проявлять свойства, присущие кислотам.
Получение
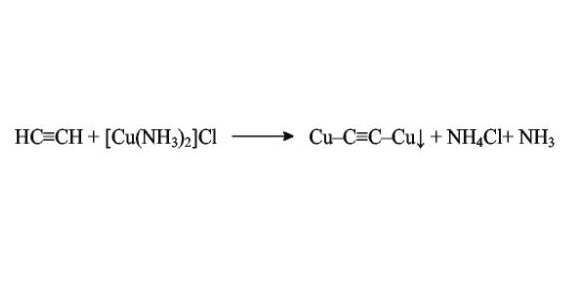
Наиболее распространенный способ получения ацетиленида меди в лаборатории — пропускание газообразного ацетилена сквозь аммиачный раствор хлорида меди(I). В результате образуется нерастворимый осадок ацетиленида красноватого цвета.
Вместо хлорида меди(I) также можно использовать ее гидроксид Cu2O. В обоих случаях важно то, что фактически реакция идет с аммиачным комплексом меди.
Физические свойства
Ацетиленид меди в чистом виде — темные красно-коричневые кристаллы. На самом деле это моногидрат — в осадке каждой молекуле ацетиленида соответствует одна молекула воды (записывается в виде Cu2C2×H2O). Сухой ацетиленид меди взрывоопасен: может сдетонировать при нагревании (он менее термически устойчив, чем ацетиленид серебра), а также при механическом воздействии, например при ударе.
По этому поводу существует предположение, что медные трубы на химических производствах несут большую опасность, так как при длительной эксплуатации внутри образовывается ацетиленид, который потом может привести к сильному взрыву. Особенно это актуально для области нефтехимии, где медь, а также ее ацетилениды используются также и в качестве катализаторов, что повышает уровень риска.
Химические свойства
Мы уже говорили о том, что углерод с тройной связью в ацетилене гораздо более электроотрицателен, чем, например, углерод со связью двойной (как в этилене) или одинарной (в этане). Способность ацетилена реагировать с некоторыми металлами, отдавая ион водорода и замещая его ионом металла (например, реакция образования ацетиленида натрия при взаимодействии ацетилена с металлическим натрием) подтверждает это. Мы называем эту способность ацетилена одним из кислотных свойств в соответствии с теорией Бренстеда — Лоури: согласно ей, кислотность вещества определяется его способностью отщепить от себя протон. Кислотность ацетилена (в ацетилениде меди также) можно рассмотреть относительно аммиака и воды: при взаимодействии амида металла с ацетиленом образуется ацетиленид и аммиак. То есть ацетилен отдает протон, что характеризует его как более сильную, чем аммиак, кислоту. В случае с водой ацетиленид меди разлагается, образуя ацетилен — он принимает протон воды, показывая себя менее сильной кислотой, чем вода. Так, в относительном ряде кислотности (по Бренстеду — Лоури) ацетилен является слабой кислотой, находясь где-то между водой и аммиаком.
Ацетиленид меди(I) неустойчив: в воде (как нам уже известно) и в растворах кислот он разлагается с выделением газа ацетилена и красно-коричневого осадка — оксида меди(I) или белого осадка хлорида меди(I) в случае разбавления раствором соляной кислоты.
Чтобы избежать взрыва, разложение ацетиленида проводят аккуратным нагреванием во влажном виде в присутствии сильной минеральной кислоты, например разбавленной азотной.
Использование
Реакция образования ацетиленида меди(I) может быть качественной для обнаружения терминальных (с тройной связью на конце) алкинов. Индикатором является выпадения нерастворимого красно-коричневого осадка ацетиленида.
На крупнотоннажном производстве — например, в нефтехимии — ацетиленид меди(I) не используется, поскольку взрывоопасен и неустойчив в воде. Однако с ним связаны несколько специфичных реакций в так называемом тонком синтезе.
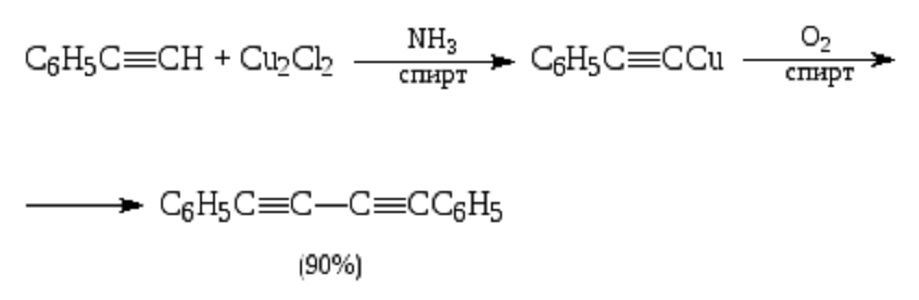
Ацетиленид меди(I) также может использоваться в качестве нуклеофильного реагента в органическом синтезе. В частности, важную роль он играет в процессе синтеза полиинов — соединений с несколькими чередующимися тройными и одинарными связями. Ацетилениды меди(I) в спиртовом растворе окисляются кислородом воздуха, конденсируясь с образованием диинов. Это реакция Глазера — Эллингтона, открытая в 1870 году и позже усовершенствованная. Медь(I) здесь играет роль катализатора, так как сама в процессе не расходуется.
Позже вместо кислорода в качестве окислителя был предложен гексацианоферрат(III) калия.
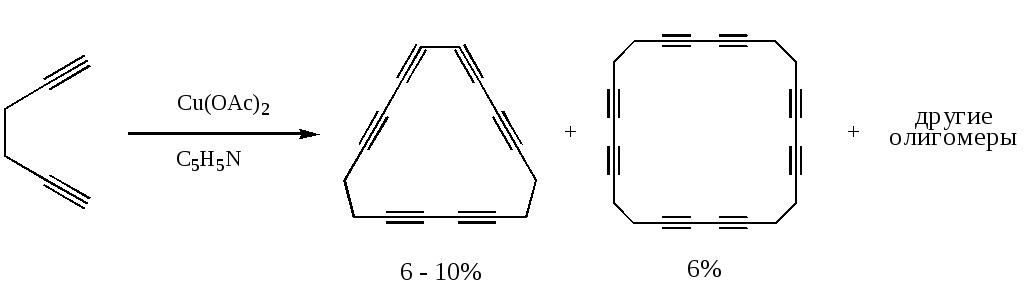
Эллингтон усовершенствовал метод получения полиинов. Вместо изначально вводившихся в раствор алкинов и солей меди(I), например хлорида он предложил брать ацетат меди(II), который окислял бы алкин в среде уже другого органического растворителя — пиридина — при температуре 60-70 °С.
Такая модификация позволила получать из диинов гораздо более крупные и устойчивые молекулы — макроциклы.
Ацетиленид меди (I)
| Ацетиленид меди (I) | |
|---|---|
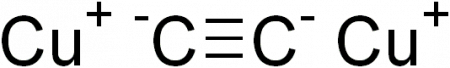 | |
| Систематическое наименование | Ацетиленид меди (I) |
| Традиционные названия | Углеродистая медь; карбид меди |
| Хим. формула | Cu2C2 |
| Состояние | кристаллы |
| Молярная масса | 151,11 г/моль |
| Рег. номер CAS | 1117-94-8 |
| PubChem | 19021056 |
| SMILES | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетиленид меди (I) — бинарное неорганическое соединение меди и углерода, химическая формула Cu2C2 красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. При детонации в отсутствие кислорода не образуется газообразных веществ. Известен моногидрат соединения состава Cu2C2·H2O.
Содержание
Получение
Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди (I).
Эта реакция используется для качественного обнаружения ацетилена.
Химические свойства
Разлагается под действием кислот. В сухом виде взрывоопасен.
Получение ацетиленида меди уравнение реакции
При пропускании ацетилена через раствор аммиачного комплекса одновалентной меди [Cu(NH3)2](OH) выпадает красно-коричневый осадок ацетиленида одновалентной меди. Данный комплекс образуется при действии на аммиакат двухвалентной меди [Cu(NH3)4](OH)2 различных восстановителей (например, в статье [1] был использован гидроксиламин).
Одним из самых доступных восстановителей является металлическая медь. Если в интенсивно-синий раствор аммиаката двухвалентной меди насыпать медных проволочек или медную стружку, он со временем обесцветится — образуется аммиакат одновалентной меди:
Аммиакат одновалентной меди [Cu(NH3)2](OH) очень легко окисляется на воздухе: при встряхивании или переливании раствор синеет буквально на глазах [2], поэтому сосуд, в котором осуществляется восстановление аммиаката двухвалентной меди до аммиаката одновалентной, должен быть герметично закрыт, а количество воздуха, который остался над раствором должно быть минимальным [3].
В свое время я поместил аммиакат двухвалентной меди вместе с медной проволокой в мерный цилиндр, закрыл его и оставил, чтобы прошло восстановление. Со временем про цилиндр забыл, но вчера случайно на него наткнулся.
В цилиндре было примерно 115 мл раствора, однако, раствор был не синий, а почти бесцветный (слегка желтоватый) — значит, реакция прошла. Сегодня утром собрал «прибор» для получения ацетилена — колба с газоотводной трубкой. Получил ацетиленид меди, отфильтровал, хорошенько промыл водой, высушил. Измельчил в порошок. К сожалению, не взвесил, но было много.
Взял шприц на 5 мл, отрезал носик (иначе трудно будет продеть замедлитель). В отверстие, где был носик, вставил замедлитель [4]. Небольшими порциями засыпал в шприц ацетиленид и аккуратно прессовал карандашом, когда до конца шприца осталось около 1 мл, вставил поршень.
Привязал шприц к ветке сосны.
Рассчитывал, что замедлитель даст минимум секунд 5 (сахар хорошо стабилизирует горение), но вышло около 30. Хлопок был громкий, раза в три громче мощной петарды, но на ветке никаких повреждений не осталось (если не считать копоти).
Осталось примерно столько же ацетиленида. Набил еще один шприц (на 5 мл) точно таким же способом, как и предыдущий. Но в этот раз я не стал привязывать его к дереву, а сделал ломом в земле отверстие и опустил туда шприц (шприц был ниже поверхности примерно на 1 см). На этот раз замедлитель успел сгореть примерно наполовину, после чего сразу же сработал «заряд» (видимо, произошел проскок пламени [5]). Ничего особенного я не ожидал и очень удивился, когда в воздух полетели комья земли. Получилось красиво и гораздо тише, чем взрыв шприца с ацетиленидом на сосне.
_____________________________________________
1 См. статью Эксперименты с ацетиленом ч.7. Ацетиленид меди (I) — получение [ссылка]
2 См. статью Реакции с участием воздуха (Окисление аммиаката меди (I) [Cu(NH3)2]OH воздухом) [ссылка]
3 Если в качестве восстановителя используется не металлическая медь, а гидроксиламин, проблема окисления раствора воздухом не стоит столь остро, т.к. избыток гидроксиламина быстро восстанавливает медь, которая окислилась до двухвалентной от контакта с воздухом.
4 Стопин у меня кончился, это выяснилось примерно за полчаса до испытания. Делать новый стопин времени не было, тогда взял «карамельную» бумагу, которую в большом количестве заготовил для ракет (извел более килограмма натриевой селитры!), и плотно ее скрутил, перевязал веревкой.
5 Возможные причины проскока пламени в замедлителях (и чем это грозит) описаны в статье О фитиле (замедлителе) из газеты, пропитанной раствором селитры [ссылка]
Взрыв шприца с ацетиленидом меди |
Взрыв шприца с ацетиленидом меди |
Осталось совсем немного ацетиленида меди, я поджег его на ладони (в два приема). Тепла не почувствовал, хлопок был слабый, вещество скорее сгорело, чем взорвалось. источники: http://chem.ru/acetilenid-medi-i.html http://chemistry-chemists.com/N4_2013/ChemistryAndChemists_4_2013-P9-1.html |