Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Получение азотной кислоты из аммиака уравнение
Различают производство слабой (разбавленной) азотной кислоты и производство концентрированной азотной кислоты.
Процесс производства разбавленной азотной кислоты складывается из трех стадий:
1) конверсии аммиака с целью получения оксида азота
4NH3 + 5О2 → 4NO + 6Н2О
2) окисления оксида азота до диоксида азота
2NO + О2 → 2NO2
3) абсорбции оксидов азота водой
4NO2 + О2 + 2Н2О → 4HNO3
Суммарная реакция образования азотной кислоты выражается
NH3 + 2О2 → HNO3 + Н2О
Производство азотной кислоты по схеме АК-72.
В основу схемы АК-72, разработанной в СССР, положен замкнутый энерготехнологический цикл с двухступенчатой конверсией аммиака и охлаждением нитрозных газов под давлением 0,42–0,47 МПа и абсорбцией оксидов азота при давлении 1,1—1,26 МПа; продукция выпускается в виде 60%-ной HNO3. Первый агрегат АК-72 мощностью 380 тыс. т/год был пущен в 1976 г.
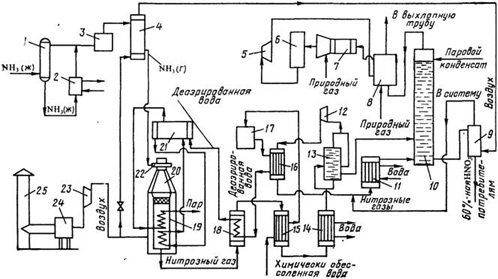
Принципиальная технологическая схема процесса приведена на рисунке 1.1.
Рисунок1.1 –Технологическая схема производства азотной кислоты АК-72:
1 – ресивер; 2 – испаритель; 3, 24 – фильтры; 4, 15 – подогреватели; 5 – рекуперационная турбина; 6 – реактор каталитической очистки; 7 – смеситель; 8 – топочное устройство; 9 – продувочная колонна; 10 – абсорбционная колонна, 11, 14 – водяные холодильники; 12, 23 – компрессоры; 13 – газовый промыватель; 16, 18 – холодильники нитрозных газов; 17 – деаэрационная колонна; 19 – котел-утилизатор; 20 – контактный аппарат; 21 – барабан с сепарационным устройством; 22 – смесительная камера; 25 – труба для забора воздуха
Воздух забирают из атмосферы через трубу 25, очищают от пыли в фильтре 24, сжимают воздушным компрессором 23 до 0,42 МПа и, разделив на два потока, подают в контактный аппарат и подогреватель аммиака. Жидкий аммиак (парожидкостная смесь) через ресивер 1 поступает в испаритель 2, где испаряется при 10–16 °С и давлении 0,6 МПа.
После испарителя газообразный аммиак очищают от масла и механических примесей в фильтре 3 и направляют в подогреватель аммиака 4, где он нагревается до 80–120 °С воздухом.
Очищенный воздух и аммиак поступают в смесительную камеру 22 контактного аппарата 20. Образующаяся аммиачно-воздушная смесь содержит 9,6–10,0% NH3. Пройдя тонкую очистку в фильтре, встроенном в контактный аппарат, аммиачно-воздушная смесь поступает на двухступенчатый катализатор, состоящий из трех платиноидных сетоь и слоя неплатинового катализатора. Нитрозные газы при температуре 840–860 °С поступают в котел-утилизатор 19, расположенный под контактным аппаратом, где за счет их охлаждения получают пар давлением 40 МПа с температурой 440 °С. Котел питают химически очищенной водой, деаэрированной в колонне 17. Деаэрированная вода проходит теплообменник 16, где нагревается нитрозными газами до 150 °С, экономайзер 18 и затем поступает в барабан котла-утилизатора 21.
Нитрозные газы после котла-утилизатора охлаждаются в экономайзере 18, отдают свою теплоту в подогревателе 15 и затем поступают в водяной холодильник 14 для дальнейшего охлаждения до 55 СС. При охлаждении нитрозных газов происходит конденсация паров воды с образованием 40–45%-ной азотной кислоты, которая подается в газовый промыватель 13. Сюда же поступают нитрозные газы.
В промывателе происходит одновременно с охлаждением промывка нитрозных газов от нитрит-нитратных солей и дальнейшая конденсация азотной кислоты. Кислота из нижней части промывателя подается в абсорбционную колонну 10, а нитрозные газы сжимаются в компрессоре 12 до 11–12,6 МПа, нагреваясь при этом до 210–230 °С. После сжатия нитрозные газы охлаждают в холодильнике 16 до 155–165 °С. в холодильнике 11 второй ступени до 60–65 °С и подают в абсорбционную колонну 10. На тарелках колонны расположены земеевики для охлаждения кислоты. Сверху в колонну поступает паровой конденсат (Н2O) с температурой не выше 40 °С. Снизу колонны выводится 58–60%-ная азотная кислота; она поступает в продувочную колонну 9 для удаления растворенных в ней оксидов азота и далее направляется в хранилище.
Отходящий газ из абсорбционной колонны нагревается в подогревателе (топочном устройстве) 8, смешивается в смесителе 7 с природным газом и подогретый до 480 °С направляется на каталитическую очистку от оксидов азота в реактор. Катализатором очистки служит алюмопалладиевый катализатор АПК-2. После каталитического разложения выхлопные газы, содержащие до 0,008% оксидов азота при температуре 750 °С, поступают в рекуперационную турбину 5, входящую в состав газотурбинного агрегата. Здесь тепловая энергия выхлопных газов преобразуется в механическую с одновременным снижением давления газа до 0,95–1,05МПа. Энергия, вырабатываемая в газовой турбине, используется для привода компрессоров 12 и 23 (нитрозного и воздушного).
Производство слабой азотной кислоты под повышенным давлением.
В 1960-х годах разработан агрегат по производству азотной кислоты мощностью 120 тыс. т год под давлением 0,716 МПа с использованием высокотемпературной каталитической очистки выхлопных газов, выпускающий продукцию в виде 53-58%-ной HNO3 [1]. При разработке этой схемы были пересмотрены вопросы экономической эффективности производства по схеме АК-72, в результате чего уменьшена мощность установки с 380 тыс. тонн до 120 тыс. тонн в год и снижено давление во всей схеме. В частности, абсорберы работают при давлении 0,5–0,7 МПа. Улучшена схема очистки хвостовых газов.
Производство концентрированной азотной кислоты прямым синтезом из оксидов азота.
Прямой синтез HNО3 основан на взаимодействии жидких оксидов азота с водой и газообразным кислородом под давлением до 5 МПа по уравнению
2N2O4 + O2 + 2H2O → 4HNO3
100%-ный диоксид азота при атмосферном давлении и температуре 21,5 °С полностью переходит в жидкое состояние. При окислении аммиака полученный NO окисляется в NO2, содержание которого в газовой смеси составляет около 11%. Перевести диоксид азота такой концентрации в жидкое состояние при атмосферном давлении не представляется возможным, поэтому для сжижения оксидов азота применяют повышенное давление.
Концентрирование азотной кислоты с помощью водоотнимающих веществ. Получить концентрированную азотную кислоту перегонкой разбавленной кислоты невозможно. При кипении и перегонке разбавленной азотной кислоты ее можно упарить лишь до содержания 68,4 % HNO3 (азеотропная смесь), после чего состав перегоняемой смеси не изменится [1].
В промышленности перегонку разбавленных водных растворов азотной кислоты осуществляют в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота, концентрированные растворы нитратов и др.). Применение водоотнимающих веществ дает возможность понизить содержание водяных паров над кипящей смесью и увеличить содержание паров азотной кислоты, при конденсации которых получается 98%-ная HNО3.
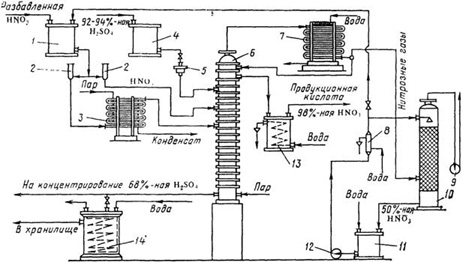
Технологическая схема концентрирования азотной кислоты с применением серной кислоты показана на рисунке 1.2.
Рисунок 1.2 – Схема концентрирования разбавленной азотной кислоты в присутствии серной кислоты:
1, 4 – напорные баки для азотной и серной кислоты; 2 – контрольные фонари; 3 – испаритель разбавленной азотной кислоты; 5 – коробка для регулировании подачи кислоты,;6 – концентрационная колонна, 7 – холодильник конденсатор; 8 – холодильник кислоты, циркулирующей в башне; 9 –вентилятор: 10 – поглотительная башня; 11 – сборник; 12 – насос; 13 – холодильник концентрированной азотной кислоты, 14 – холодильник отработанной серной кислоты
Разбавленная азотная кислота из напорного бака 1 подается в колонну 6 через два расходомера 2, включенные параллельно. Один поток кислоты проходит в испаритель 3 и подается в виде смеси жидкости и пара на 10-ю тарелку колонны 6, другой поток без подогрева поступает на вышележащую тарелку [1].
Серная кислота из напорного бака 4 через регулятор 5 подается в верхнюю часть колонны 6 выше ввода холодного потока азотной кислоты. В нижнюю часть колонны вводится острый пар, при нагревании которым из тройной смеси начинает испаряться азотная кислота.
Пары азотной кислоты при температуре 70–85 °С, поднимаясь вверх, выходят через штуцер в крышке колонны и поступают в холодильник-конденсатор 7. В этих парах имеются примеси оксидов азота и воды.
В холодильнике-конденсаторе пары азотной кислоты при температуре около 30 °С конденсируются с образованием 98–99%-ной HNО3, при этом оксиды азота частично поглощаются этой кислотой. Концентрированная азотная кислота, содержащая оксиды азота, направляется на две верхние тарелки и проходит их последовательно, причем оксиды выдуваются из раствора парами азотной кислоты, поступающими в конденсатор 7. Несконденсировавшиеся пары азотной кислоты и выделившиеся оксиды азота направляют на абсорбцию в башню 10, орошаемую водой. Полученная 50%-ная кислота поступает в сборник 11 и вновь направляется на концентрирование. Концентрированную азотную кислоту после охлаждения направляют на склад готовой продукции.
Отработанная серная кислота, содержащая 65–85% H2SO4, поступает на концентрирование. При концентрировании азотной кислоты с применением 92–93%-ной серной кислоты расход последней значительно сокращается при подаче на концентрирование 59–60%-ной HNO3 вместо 48–50%-ной. Поэтому в некоторых случаях выгодно проводить предварительное концентрирование 50%-ной HNO3 до 60%-ной путем простого упаривания.
Большим недостатком концентрирования азотной кислоты с помощью серной кислоты является высокое содержание паров и тумана H2SO4 в выхлопных газах после электрофильтров (0,3–0,8 г/м 3 газа). Поэтому серную кислоту заменяют, например, нитратом магния или цинка.
Концентрирование азотной кислоты с помощью нитрата магния.
Этот способ концентрирования обеспечивает получение чистой концентрированной азотной кислоты без вредных выбросов в атмосферу. Однако у него есть ряд существенных недостатков, не позволяющих использовать такой способ повсеместно. В первую очередь это связано с повышенной по сравнению с другими способами себестоимостью получаемого продукта и проблемы утилизации трудно перерабатываемых твердых отходов.
Одним из способов уменьшения выбросов и повышения эффективности производства аммиака является применение энерготехнологической схемы с парогазовым циклом, в котором в качестве рабочей теплоты используется не только теплота водяного пара, но и продуктов сгорания топлива.
Такая схема реализована в ряде производств химической технологии. К достоинствам этого химико-технологического процесса относятся: 1) использование теплоты промежуточных реакций для сжатия сырья (рекуперация энергии); 2) возможность организовать тщательную очистку отработанных газов [1].
Технологическая схема производства азотной кислоты под давлением 0,7 МПа.
Атмосферный воздух проходит тщательную очистку в двухступенчатом фильтре 1 (первая ступень фильтра выполнена из лавсановой ткани, вторая – из ткани Петрянова). Очищенный воздух сжимают двухступенчатым воздушным компрессором. В первой ступени 18 воздух сжимают до 0,35 МПа, при этом он нагревается до 165–175 °С за счет адиабатического сжатия. После охлаждения воздух направляют на вторую ступень сжатия 16, где его давление возрастает до 0,716 МПа.
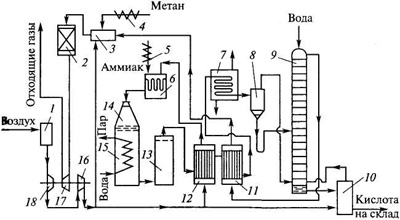
Рисунок 2.1 – Схема производства азотной кислоты под давлением 0,7 МПа:
1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 – топочное устройство; 4 – подогреватель метана; 5 – подогреватель аммиака; 6 – смеситель аммиака и воздуха; 7 – холодильник-конденсатор; 8 – сепаратор; 9 – абсорбционная колонна: 10 — продувочная колонна; 11 – подогреватель отходящих газов; 12 – подогреватель воздуха; 13– сосуд для окисления нитрозных газов; 14 – контактный аппарат; 15 – котел-утилизатор; 16, 18 – двухступенчатый турбокомпрессор: 17 – газовая турбина
Основной поток воздуха после сжатия нагревают в подогревателе воздуха 12 до 250–270 °С теплотой нитрозных газов и подают на смешение с аммиаком в смеситель 6.
Газообразный аммиак, полученный путем испарения жидкого аммиака, после очистки от влаги, масла и катализаторной пыли через подогреватель 5 при температуре 150 °С также направляют в смеситель 6. Смеситель совмещен в одном аппарате с поролитовым фильтром. После очистки аммиачно-воздушную смесь с содержанием NH3 не более 10% подают в контактный аппарат 14 на конверсию аммиака.
Конверсия аммиака протекает на платинородиевых сетках при тем¬пературе 870–900 °С, причем степень конверсии составляет 96%. Нитрозные газы при 890–910 °С поступают в котел-утилизатор 15, расположенный под контактным аппаратом. В котле за сжег охлаждения нитрозных газов до 170 °С происходит испарение химически очищенной деаэрированной воды, питающей котел-утилизатор; при этом получают пар с давлением 1,5 МПа и температурой 230 °С, который выдается потребителю.
После котла-утилизатора нитрозные газы поступают в окислитель нитрозных газов 13. Он представляет собой полый аппарат, в верхней части которого установлен фильтр из стекловолокна для улавливания платинового катализатора. Частично окисление нитрозных газов происходит уже в котле-утилизаторе (до 40%).
В окислителе 13 степень окисления возрастает до 85%. За счет реакции окисления нитрозные газы нагреваются до 300–335 °С. Эта теплота используется в подогревателе воздуха 12. Охлажденные в теплообменни¬ке 12 нитрозные газы поступают для дальнейшего охлаждения в теплообменник 11, где происходит снижение их температуры до 150 ºС и нагрев выхлопных (хвостовых) газов до 110–125 °С. Затем нитрозные газы направляют в холодильник-конденсатор 7, охлаждаемый оборотной водой. При этом конденсируются водяные пары и образуется сла¬бая азотная кислота. Нитрозные газы отделяют от сконденсировавшейся азотной кислоты в сепараторе 8, из которого азотную кислоту направляют в абсорбционную колонну 9 на 6–7-ю тарелку, а нитрозные газы – под нижнюю тарелку абсорбционной колонны. Сверху в колонну подают охлажденный паровой конденсат.
Образующаяся в верхней части колонны азотная кислота низкой концентрации перетекает на нижележащие тарелки. За счет поглощения оксидов азота концентрация кислоты постепенно увеличивается и на выходе достигает 55–58%, причем содержание растворенных в ней оксидов азота достигает
1%. Поэтому кислота направляется в продувочную колонну 10, где подогретым воздухом из нее отдувают оксиды азота, и отбеленная азотная кислота поступает на склад. Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны 9.
Степень абсорбции оксидов азота достигает 99%. Выходящие из колонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35 °С проходят подогреватель 11, где нагреваются до 110–145 °С и поступают в топочное устройство (камера сжигания) 3 установки каталитической очистки. Здесь газы нагреваются до температуры 390–450 °С за счет горения природного газа, подогретого предварительно в подогревателе 4, и направляются в реактор с двухслойным катализатором 2, где первым слоем служит оксид алюминия, с нанесенным на него палладием, вторым слоем – оксид алюминия. Очистку осуществляют при 760 °С.
Очищенные газы поступают в газовую турбину 17 при температуре 690–700 °С. Энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомпрессора 18. Затем газы направляют в котел-утилизатор и экономайзер (на схеме не показаны) и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005–0,008%, содержание СО2 – 0,23%.
Поникаров И.И., Перелыгин О.А. Машины и аппараты химических производств
Получение азотной кислоты из аммиака уравнение
к списку лекций
к списку предметов
Производство азотной кислоты.
Чистая азотная кислота – бесцветная жидкость, замерзающая при — 41 ° С, кипящая при 86 ° С. Максимальная температура кипения 121,9 ° С имеет раствор содержащий 68,4% HNO3 и представляющий собой азеотропную смесь. Азотная кислота – очень сильный окислитель. Многие органические вещества при действии азотной кислоты разлагаются, а некоторые способны воспламеняться. Особенно сильна как окислитель разбавленная азотная кислота. Концентрированная азотная кислота пассивирует такие металлы как железо. На этом основано использование стали как конструкционного материала в производстве азотной кислоты.
Промышленность выпускает азотную кислоту двух видов: разбавленную с содержанием 50 – 60 % HNO3 и концентрированную, содержащую 96 – 98 % HNO3. Разбавленная кислота используется в основном для производства азотсодержащих минеральных удобрений. Крепкая азотная кислота применяется для производства взрывчатых веществ, красителей, пластических масс, нитролаков, кинопленки, и других важных продуктов. Азотную кислоту производят из аммиака.
Физико-химические основы процесса.
Производство разбавленной азотной кислоты из аммиака складывается из следующих стадий:
1. контактное окисление аммиака до оксида азота ( II );
2. доокисление оксида азота ( II ) до оксида азота ( IV );
3. поглощение оксида азота ( IV ) водой с образованием азотной кислоты.
Суммарная реакция образования азотной кислоты выражается уравнением:
Контактное окисление аммиака.
При окислении аммиака кроме основной реакции могут протекать параллельные побочные процессы.
и последовательная реакция

Обоснование роли параметров и их выбор.
Температура оказывает слабо ускоряющее действие на процесс, поскольку реакция лимитируется внешней диффузией. В то же время выход NO изменяется с ростом температуры по экстремальному закону с максимумом в области 900 – 920 ° С в связи с прогрессированием в этой области реакции ( 5), а также термической диссоциацией аммиака
и других побочных реакций. Кроме того с ростом температуры возрастает унос катализатора в виде летучего оксида PtO2. Для улавливания Pt под сетки кладут поглотитель на основе CaO, который улавливает более 50% платины. Учет действия указанных противоположных факторов приводит к выбору оптимальной температуры 830 – 930 ° С (в зависимости от совокупности других параметров). Следует иметь в виду, что положение оптимума температуры зависит от давления. При повышении давления он смещается в область более высоких температур, хотя само значение максимального выхода снижается из-за увеличения удельного веса реакции ( 6) с ростом давления.
Давление является фактором ускорения процесса, так как является движущей силой внешней диффузии. Вместе с тем, с ростом давления наблюдается снижение выхода оксида азота (II). Поэтому давление является оптимальной величиной, сочетающей взаимно противоположные требования увеличения производительности и уменьшения габаритов установки и повышение выхода NO. Следует также иметь ввиду, что при повышении давления существенно возрастает унос мельчайших частиц платины с газами, что удорожает товарную кислоту, т.к. платина имеет высокую стоимость, а процесс ее улавливания из нитрозных газов после контактного аппарата весьма сложен и не обеспечивает полноту компенсации потерь. На современных установках большой мощности оптимум давления составляет 0,4 – 0,7 МПа.
Состав газовой смеси. При выборе соотношения O2 : NH 3 руководствуются зависимостью выхода NO от этого соотношения (рисунок 1), связанной с лимитированием процесса диффузией кислорода к поверхности катализатора. Оптимальными значениями O2 : NH 3 является величина 1,8 – 2,0, что соответствует содержанию аммиака в аммиачно-воздушной смеси 9,5 – 10,5 (об. %). Следует учитывать, что при обычной температуре смесь аммиака с воздухом взрывается в интервале 16 – 27 (об. %), а при увеличении температуры и давления предел взрываемости расширяется.
Время контакта. Высокая селективность катализаторов позволяет в условиях оптимальных давлений, температур и соотношения O2 : NH 3 достигать 97 – 98% выхода NO при практически полной конверсии аммиака. Поскольку NO при увеличении времени контактирования может далее разлагаться на элементарные N2 и О2, то за время контакта выбирается то минимальное время, при котором достигается практически полная конверсия и которое обеспечивает минимальный объем реактора в условиях практически полного превращения NH3. Это время составляет (1 – 2) × 10 -1 с.
Окисление оксида азота (II) до диоксида.
Нитрозные газы, полученные при окислении аммиака содержат NO и другие оксиды азота, кислород, азот и пары воды. Для получения азотной кислоты оксид азота (II) окисляют до диоксида.
Процесс окисления NO кислородом воздуха описывается уравнением
В соответствии с принципом Ле Шателье равновесие этой реакции сдвигается вправо при повышении давления и снижении температуры. Практически равновесие образования диоксида азота при 100 ° С почти полностью смещено вправо. Константа скорости процесса также увеличивается с понижением температуры. Такое аномальное поведение системы связано с тримолекулярным характером процесса (см. раздел «Химическая кинетика» курса «Физическая химия»). В связи с требованиями смещения равновесия и ускорения процесса температуру необходимо понижать. Однако имеется нижний предел температуры, определяемый прогрессивным возрастанием энергетических затрат, связанных с использованием хладагентов. Вместе с тем понижение температуры обусловливает частичное превращение NO2 в димер
На практике процесс осуществляется при температуре 10 – 50 ° С.
Давление является фактором ускорения основной реакции и фактором смещения ее равновесия в сторону целевого продукта. Однако одновременно рост давления обусловливает смещение равновесия димеризации в правую сторону. Чрезмерное повышение давления нецелесообразно, так как приводит к росту энергетических затрат на компримирование, а также образованию и выпадению в конденсат значительных количеств N2 O 4 и HNO3. На практике работают при давлениях 0,40 – 0,45 МПа. Выходящие после реакции контактные газы содержат NO2, N 2 O 4, O 2, N 2 O , NO , N 2 O 3, пары воды.
Время контакта и степень превращения. Реакция окисления протекает самопроизвольно без каких-либо внешних ускорителей. В то же время общий третий порядок реакции обусловливает резкое снижение скорости с увеличением степени конверсии. Поэтому в качестве реактора окисления используют полый цилиндрический аппарат, работающий в режиме вытеснения. При этом резкое снижение скорости с ростом степени превращения реагентов не позволяет осуществить процесс до их полного превращения. Поэтому его проводят до оптимальной степени превращения 92%. Этой величине соответствуют времена контакта порядка нескольких секунд.
Соотношение реагентов необходимо поддерживать в соответствии с требованиями стехиометрии, т.е. 2 : 1. При этом достигается максимальная производительность процесса.
Абсорбция диоксида азота.
Все оксиды азота, за исключением NO взаимодействуют с водой с образованием азотной кислоты. Поглощение оксидов азота с водой протекает через две макростадии – физическое растворение этих газов в воде и последующее их химическое взаимодействие с водой с образованием азотной и азотистой кислот. Азотистая кислота является малоустойчивым соединением и распадается на азотную кислоту, оксид азота (II) и воду.
Суммарно взаимодействие NO2 с водой можно представить уравнением
Образующийся NO снова окисляется до NO2
Из двух макростадий – физическое растворение и химическая реакция вторая протекает значительно быстрее и ее скорость определяется скоростью массопереноса газовой фазы в жидкую. Разложение азотистой кислоты происходит сравнительно медленно. Образующийся NO частично окисляется в растворе кислородом, но его большая часть взаимодействует с кислородом уже в газовой фазе по реакции ( 13). Одновременно с абсорбцией и протеканием химических реакций в растворе в газовой фазе так же частично протекают те же реакции, приводящие к образованию азотной кислоты. При взаимодействии паров воды и NO2 в газовой фазе происходит образование кислотного тумана.
Степень поглощения диоксида азота водными растворами азотной кислоты определяется такими факторами как температура, давление, концентрация кислоты. При понижении температуры и концентрации кислоты и повышении давления степень превращения диоксида азота растет. При концентрации азотной кислоты выше 65% поглощение практически прекращается.
Следует также отметить, что степень окисления NO зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности контакта фаз. Поэтому одно из основных требований, предъявляемых к абсорбционной аппаратуре – создание максимального свободного объема при одновременно сильно развитой поверхности поглощения. Поэтому реактор образования азотной кислоты – абсорбционная колонна с копачковыми или ситчатыми тарелками. Пространство между тарелками работает как газофазный окислитель основного количества выделившегося NO . Барботаж в новом слое жидкости на тарелке обеспечивает интенсивный массообмен с газом, способствуя поглощению компонентов газофазной смеси и тем самым образованию HNO3 и жидкофазному окислению NO . Достаточно большой объем газовой фазы между тарелками позволяет достичь высоких степеней газофазного окисления NO в NO2, можно считать, что в абсорбционной колонне протекает превращение, описываемые следующим брутто-уравнениями:
Для отвода избыточного тепла на тарелках установлены плоские змеевидные холодильники с циркулирующей в них водой.
Современные установки, работающие под повышенным давлением (от 0,2 до 1 МПа) разработаны по принципу энерготехнологических схем, в которых энергия отходящих газов (связанная с их высокой температурой и давлением) и теплота реакции окисления аммиака, используются для сжатия воздуха и нитрозных газов, а также получения технологического пара. Этими же схемами предусмотрено более полное использование низкопотенциальной энергии. Принципиальная технологическая схема получения разбавленной азотной кислоты под повышенным давлением приведена на рисунке 2

Основной поток воздуха после сжатия нагревают в подогревателе ( 12) до 250 – 270 ° С теплотой нитрозных газов и подают на смешение с аммиаком в смеситель ( 6).
Газообразный аммиак, полученный испарением жидкого аммиака, после очистки от влаги, масел и катализаторной пыли через подогреватель ( 5) при температуре 150 ° С также направляют в смеситель ( 6). Смеситель совмещен в одном аппарате с поронитовым фильтром. После очистки аммиачно-воздушную смесь с содержанием аммиака не более 10% подают в контактный аппарат ( 14) на окисление аммиака. Конверсия аммиака протекает на Pt-Pd-Rh-сетках при 870-900 ° С причем степень конверсии составляет 97 – 98%. Нитрозные газы при 890 – 910 ° С поступают в котел-утилизатор ( 15), расположенный под контактным аппаратом. В котле за счет тепла контактных газов протекает испарение химически очищенной деаэрированной воды, питающей котел-утилизатор. При том получается пар с давлением 1,5 МПа и температурой 230 ° С, который поступает потребителю.
После котла-утилизатора нитрозные газы поступают в окислитель нитрозных газов ( 13). Он представляет собой полый аппарат в верхней части которого установлен фильтр из стекловолокна для улавливания платинового катализатора. Частично окисление нитрозных газов происходит уже в котле-утилизаторе (до 40%). В окислителе ( 13) степень окисления нитрозных газов доводят до 85%. За счет реакции окисления нитрозные газы нагреваются до 300 – 335 ° С. Эта теплота используется в подогревателе воздуха ( 12). Охлажденные в теплообменнике ( 12) нитрозные газы поступают для дальнейшего охлаждения в теплообменник ( 11), где происходит снижение их температуры до 150 ° С и нагрев хвостовых газов до 110 – 125 ° С. Затем нитрозные газы направляют в холодильник-конденсатор ( 7), охлаждаемый оборотной водой. При этом конденсируются водяные пары и образуется слабая азотная кислота. Нитрозные газы отделяют от сконденсировавшейся азотной кислоты в сепараторе ( 8), из которого азотную кислоту направляют в абсорбционную колонну ( 9) на одну из средних тарелок, с соответствующей концентрацией кислоты. Нитрозные газы направляют в нижнюю часть колонны ( 9). Сверху в нее подают охлажденный конденсат. Образующаяся в верхней части азотная кислота низкой концентрации перетекает на нижние тарелки и по мере их прохождения укрепляется за счет поглощения новых порций нитрозных газов. При выходе из нижней части колонны концентрация кислоты достигает 55 – 58%, причем содержание растворенных в ней оксидов азота достигает
1%. Поэтому кислота направляется в продувочную колонну ( 10), где подогретым воздухом из нее отдуваются оксиды азота, а отдутая кислота направляется на склад. Воздух после продувочной колонны подается в нижнюю часть абсорбционной колонны ( 9).
Степень абсорбции оксидов азота достигает 99%. Выходящие из колонны хвостовые газы с содержанием оксидов азота до 0,11% при температуре 35 ° С проходят подогреватель ( 11), где нагреваются до 110 – 145 ° С и поступают в топочное устройство (камера сжигания) ( 3) установки каталитической очистки. Здесь газы нагреваются до температуры 390 – 450 ° С за счет горения природного газа, подогреваемого в подогревателе ( 4), и направляемого в реактор с двухслойным катализатором ( 2), где первым слоем служит оксид алюминия. Очистку осуществляют при температурах 690 – 700 ° С. Энергия, вырабатываемая турбиной за счет теплоты хвостовых газов, используется для привода турбокомперессора ( 18). Затем газы направляют в котел-утилизатор и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005 – 0,008%, содержание СО2 – 0,23%. Таким образом данный агрегат полностью автономен по энергии.
http://www.newchemistry.ru/printletter.php?n_id=4225
http://www.trotted.narod.ru/chemtech/lec-14.htm