Химия, Биология, подготовка к ГИА и ЕГЭ
Получение бензола и его
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего» 🙂
«Классические» реакции
получения бензола
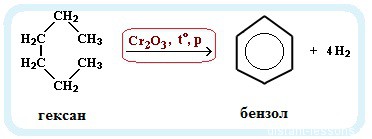
- Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
С6H12 → C6H6 + 3H2
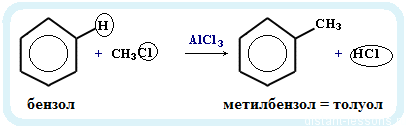
- Получение гомологов бензола: алкилирование бензола:
реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
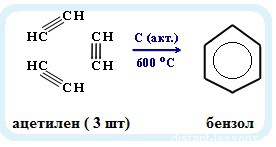
Именная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
1. Получение бензола из неорганических веществ:
- 1 вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского : 3С2H2 → C6H6 Это самый короткий путь получения. - 2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH( Br )-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH( Br )-(CH2)4-CH2 Br
CH3-CH( Br )-(CH2)4-CH2 Br + Zn → C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
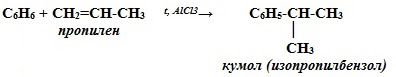
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Получение бензола из циклогексана уравнение реакции
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Бензол: физические и химические свойства, получение и применение
I. Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Таблица. Физические свойства некоторых аренов
Бензол – легкокипящая (t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
II. Получение аренов (бензола и его гомологов)
1. В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5—R + 2NaГ
2. В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
2. Тримеризация ацетилена (только для бензола) – реакция Зелинского
3. Дегидрированием циклогексана и его гомологов
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов)
4. Алкилирование бензола (получение гомологов бензола) – реакция Фриделя-Крафтса
III. Химические свойства аренов
I. Реакции окисления
1. Горение (коптящее пламя):
Видео-опыт: “ Горение бензола ”
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
а) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
б) в нейтральной и слабощелочной до солей бензойной кислоты
II. Реакции присоединения (труднее, чем у алкенов)
1. Галогенирование
2. Гидрирование
3. Полимеризация
III. Реакции замещения – ионный механизм (легче, чем у алканов)
1. Галогенирование
a) бензола
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
2)
в) гомологов бензола в присутствии катализатора
2. Нитрование (с азотной кислотой)
2,4,6-тринитротолуол (тол, тротил)
IV. Применение бензола и его гомологов
Бензол C6H6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C6H5NO2 (растворитель, из него получают анилин), хлорбензола C6H5Cl, фенола C6H5OH, стирола и т.д.
Толуол C6H5–CH3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2. Технический ксилол – смесь трех изомеров (орто-, мета— и пара-ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C6H5–CH(CH3)2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С6Сl6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C6H5 – CH = CH2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
V. Тренажеры
ЦОРы
Видео-опыт: “ Горение бензола ”
Видео-опыт: “ Бромирование бензола ”
Видео-опыт: “ Нитрование бензола ”
http://chemege.ru/sposoby-polucheniya-arenov/
http://kardaeva.ru/dlya-uchenika/10-klass/94-uroki/275-benzol-fizicheskie-i-khimicheskie-svojstva-poluchenie-i-primenenie