Получение бертолетовой соли электролизом уравнение
Хлорат калия — ценный реактив, мечта многих юных химиков, который позволяет провести множество красивых и интересных опытов:
запал Кибальчича ссылка
горение фосфора под водой ссылка
взрыв смеси бертолетовой соли и красного фосфора ссылка
горение угля и серы в расплаве хлората калия ссылка
приготовление смесей для цветных огней ссылка и т.д.
К сожалению, на данный момент хлорат калия в быту не применяется, потому достать его можно только в химмагах. (Раньше хлорат калия использовали в медицине как антисептическое средство и не только. Например, людям, которые работали со ртутью, рекомендовали полоскать рот раствором хлората или перманганата калия [k1].) Для многих юных химиков остается только один выход: получить хлорат калия самостоятельно.
Для получения хлората калия обычно используют два метода — реакцию диспропорционирования гипохлорита натрия (средство «белизна») и электрохимический метод.
Первый способ позволяет получить небольшие (до 200 г) количества реактива. Преимуществом данного метода является быстрота. Он основан на том, что гипохлорит натрия при нагревании в растворе примерно до 75-80°С переходит в хлорид и хлорат натрия.
Как видно из уравнения реакции, этот метод довольно нерациональный: большая часть гипохлорита переходит в хлорид и только треть — в хлорат [k3].
Если к полученному раствору хлората натрия добавить хлорид калия, при охлаждении выпадет хлорат калия, который сравнительно плохо растворим. Вместо гипохлорита натрия можно использовать также гипохлорит кальция (хлорная известь) [k2].
С помощью электрохимического метода можно получать значительные количества бертолетовой соли (килограммы), но придется запастись терпением. Мы воспользовались именно электрохимическим методом, поэтому остановимся на нем подробнее.
При электролизе раствора хлорида натрия без диафрагмы (т.е. электродные пространства не разделены) в растворе происходит окисление хлорида натрия в хлорат. Процесс описывается общим уравнением:
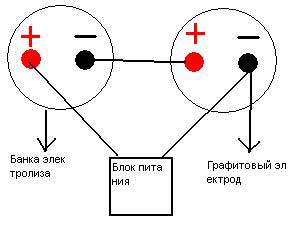
В теории все просто. Теперь приступим к практической реализации метода. Необходимы емкость для электролиза, электроды, электролит и блок питания (который будет подавать ток на электроды).
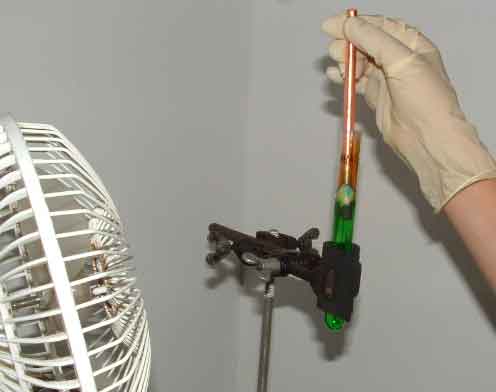
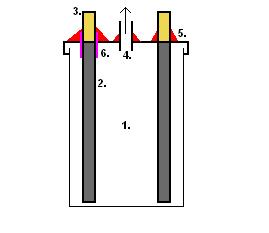
Установка для электрохимического получения хлората Электролит представляет собой насыщенный раствор поваренной соли, в который добавлено немного хромата натрия (на 4 литра электролита мы взяли около 5-6 г хромата натрия). [Хромат натрия легко получить взаимодействием бихромата аммония с едким натром]. В качестве емкостей для электролиза (электролизеров) мы воспользовались четырьмя литровыми банками для консервирования. Они были заполнены электролитом, в крышках банок (бытовые пластиковые крышки) было сделано пять отверстий — по два с каждой стороны для электродов и одно для выхода выделяющихся газов. Электролизеры были соединены параллельно. Перейдем к электродам. Необходимо, чтобы в каждой ячейке (в нашем случае — банке) было как минимум по два электрода. Один из них — анод следует взять из инертного материала (графит, благородные металлы, токопроводящие оксиды), а второй — из любого подходящего токопроводящего материала (например, графита, стали). Естественно, самым доступным материалом для анода является графит, но с ним не все так просто. Многие сорта графита просто рассыпаются в порошок при попытке использовать их в качестве электрода. Особенно этим «грешит» графит, взятый из грифелей простых карандашей. Мы использовали в качестве электродов графитовые электроды для электродуговой резки (продающиеся в отделах «материалы для сварки»). Некоторые химики использовали графит от троллейбусных контактов (его можно найти на конечных остановках троллейбусов: нередко после замены контактов куски графита просто выбрасывают на дорогу). В каждой банке было по четыре электрода (два анода и два катода). Их вставили в отверстия, сделанные по краям крышек. Банки заполнили электролитом, закрыли крышками. Выступающие из крышек края электродов обмотали медной проволокой, концы проволоки подсоединили проводами к источнику питания — так, чтобы банки были подключены параллельно. Исключительно важной частью нашей электрохимической установки является источник питания. Он должен обладать целым рядом характеристик — давать устойчивое постоянное напряжение, выдерживать высокий ток (10 ампер), быть надежным и т.д. [k4] Мы воспользовались трансформатором от токарного станка. Одна из его обмоток преобразует напряжение 380В => 22В, однако, если дать на первичную обмотку 220В, то вторичная выдаст 12,7В, которые под десятиамперной нагрузкой электролизера упадут до 5В. Но трансформатор выдает переменный ток, а для электролиза необходим постоянный. Для выпрямления тока мы воспользовались диодным мостом с мощным радиатором и двумя конденсаторами (по 200 мкФ) для сглаживания напряжения. Также необходима система охлаждения, а иначе трансформатор и диоды могут перегреться и сгореть. Для охлаждения мы воспользовались двенадцативольтовым компьютерным кулером. Так как после диодного моста напряжение под нагрузкой электролизера падает, то пришлось ставить отдельный блок питания для кулера. Для этого использовали старый блок питания для демонстраций на уроках физики. Чтобы не подключать еще один трансформатор, провода из блока питания вывели наружу и подключили к силовому трансформатору. |
Установка для электрохимического получения хлората калия |
Графитовые электроды |
Электролизер (банка) Электролиз продолжался две недели [1]. После этого срока электролизер выключили, электролит слили, отфильтровали через вату от взвеси графита. Чтобы узнать, насколько успешным был электролиз к 25 миллилитрам раствора добавили немного насыщенного раствора хлорида калия, охладили. Осадок хлората калия отделили, высушили и взвесили. Таким образом мы определили примерное содержание хлората в растворе. Два литра электролита налили в трехлитровую бытовую банку, нагрели на водяной бане до кипения и добавили насыщенный раствор хлористого калия [2]. После охлаждения раствора выпало значительное количество кристаллов загрязненного хлората калия. В принципе его можно использовать для опытов, однако составы цветных огней с таким хлоратом калия не получатся — все цвета забьют примеси натрия (пламя будет желтым). Чтобы очистить хлорат калия от примесей (в основном — примесей натрия) необходимо провести его перекристаллизацию. Ниже дано описание этой процедуры. С осадка слили «рассол», промыли его ледяной водой, еще раз залили чистой водой, и опять нагрели до кипения на водяной бане, подливая кипяток до полного растворения кристаллов [3]. Раствор охладили и слили с осадка, осадок промыли, но уже дистиллированной водой. Первая перекристаллизация завершена. Большинство примесей осталось в слитом растворе, а кристаллы стали чище — в этом и состоит суть метода перекристаллизации. Разумеется, за чистоту нужно платить: часть хлората калия теряется вместе с отбрасываемой жидкостью (маточным раствором). Теперь вторая перекристаллизация. Берем осадок и повторяем все описанные выше операции, но уже используя дистиллированную воду. Полученный осадок чище, чем исходные кристаллы, которые мы растворяли, но снова часть хлората калия теряется с маточным раствором. Выпавшие кристаллы выложили на фильтр из стеклоткани и дали стечь воде. Затем их переложили в лоток, который поставили на кастрюлю с кипящей водой. Кристаллы быстро высохли и их пересыпали в герметично закрывающуюся емкость. Аналогичным образом мы переработали оставшиеся два литра электролита (раствора хлората натрия). В результате синтеза мы получили примерно полкилограмма чистого хлората калия. __________________________________________ 2 В нашем случае понадобилось по 250 г хлорида калия на каждые 2 л электролита. 3 Нужно использовать минимальное количество воды, необходимое для растворения осадка. Лишняя вода увеличивает потери хлората калия. |
Хлорат калия | ||||
K1 Хлораты натрия, кальция и магния все еще применяют в качестве неселективных гербицидов — для очистки железнодорожного полотна, промплощадок и др.; как дефолианты при уборке хлопка. Кислотное разложение хлоратов используют при получении двуокиси хлора «на месте» (on-site) для отбеливания высокопрочной целлюлозы. K2 К сожалению, серьезным недостатком этого способа является низкое качество бытовых дезинфицирующих средств и отбеливателей. После смягчения политики «обязательной стандартизации» производители средств типа «белизна» стали использовать собственные технические условия, понизив содержание гипохлорита в продукте со стандартных 5% масс. до 3% и менее. Теперь для получения того же количества хлората с хорошим выходом потребуется не просто израсходовать намного больше «белизны» но и удалить большую часть воды из раствора. Вероятно, наиболее удобным может быть предварительное концентрирование «белизны» частичным вымораживанием. Профессиональные жидкие средства для нейтрализации стоков на судах содержат до 40% гипохлорита натрия. K3 Диспропорционирование гипохлорита в хлорид и хлорат протекает с высокой скоростью при pH K4 Действительно, высокоэффективный источник питания значительной мощности для электролиза — половина успеха дела и тема для особого разговора. Здесь же хотелось бы напомнить о необходимости соблюдать правила электробезопасности. Работы, связанные с электролизом в значительных масштабах, считаются особо опасными относительно поражения электрическим током. Это связано с тем, что контакт кожи экспериментатора с проводящим электролитом практически неизбежен. Выделение газов на электродах вызывает образование коррозионно-активных аэрозолей электролита, которые способны оседать на компонентах электрооборудования, особенно при использовании принудительного воздушного охлаждения. Последствия могут быть весьма печальны — от коррозии металлических частей и выхода блока питания из строя до пробоя изоляции с попаданием сетевого напряжения на электролизер и всеми последствиями для экспериментатора. Ни в коем случае не следует устанавливать высоковольтные части установки в непосредственной близости от электролизера. Все компоненты источника питания следует располагать на достаточном расстоянии от электролизера и таким образом, чтобы полностью исключить как попадание на них электролита в случае аварии электролизера, так и осаждение токопроводящих аэрозолей. При этом сильноточные провода от источника до электролизера должны иметь достаточное сечение, соответствующее току процесса. Все проводники (и их соединения), непосредственно связанные с электросетью, должны быть герметично изолированы влагостойкой изоляцией. Обязательна гальваническая развязка электролизера от электросети. Обычный трансформатор обеспечивает адекватную изоляцию, но категорически запрещается питание электролизера непосредственно от автотрансформаторов типа ЛАТР и т.п., так как при этом электролизер может оказаться прямо соединенным с фазным проводом сети. Однако ЛАТР (или бытовой автотрансформатор) вполне можно использовать для регулирования напряжения на первичной обмотке основного трансформатора. Следует только позаботиться о том, чтобы мощность ЛАТРа была не меньше мощности основного трансформатора. При долговременной работе установки защита электронных компонентов от перегрева и короткого замыкания была бы полезной. Для начала вполне возможно ограничиться установкой плавкого предохранителя в первичной обмотке трансформатора на ток, соответствующий его номинальной мощности. Питание на электролизер также разумно подавать через соответствующий плавкий предохранитель (лучше — регулируемый электромагнитный расцепитель), имея в виду, что короткое замыкание в электролизере вполне возможно. Вопрос о необходимости заземления установки в данном случае не такой простой. Дело в том, что во многих жилых помещениях заземление изначально отсутствует и его непросто устроить собственными силами. В некоторых случаях вместо заземления хитрые электрики организуют «зануление», соединяя шину заземления и нейтраль сети непосредственно у потребителя. При этом «заземляемый» прибор оказывается непосредственно подключен к токоведущему контуру сети. В наших условиях можно рекомендовать отдать приоритет качественной изоляции электролизера от сети и экспериментатора от всей установки. Правилами безопасности не следует пренебрегать еще и по той причине, что длительный эксперимент в любительской лаборатории всегда привлекает внимание других людей, навыки и поведение которых экспериментатор не может контролировать. Помните об окружающих и работайте безопасно. Получение хлората калия электролизом(с фотками), для новичковПолучение хлората калия Для изготовления хлората нам понадобится: В приготовление хлората есть три стадии: I-приготовление электролита: Потом когда вся соль растворилась я охлаждаю и процеживаю от осадка который не растворился: На этом стадия приготовления начального раствора закончена, и мы переходим к: II-приготовление электролизера ( подсчет время электролиза): Не малую роль играют сами электроды в электролизе! Анод а он (+) обязан быть из стойкого материала например графит, а лучше поставить и анод и катод из графита(хотя катод можно сделать просто из куска железа, обычного гвоздя)! Скорость получения продукта: Изготовление банки электролиза(и самых электродов): Делаете в крышке 3 дырки одну дырку для электрода делаете чуть больше, потому как крышка железная и нам придется на один из электродов намотать резинку или налить какой-то пластик чтоб не замкнула. Изготовление электрод: Мы его распиливаем по полам: Дальше начинам обрабатывать (снимать медь с графита) лучше всего это сделать при помощи азотки (HNO3) Затем медленно опускаем в азотку наш электрод: Вот так выглядят электроды после обработки: Затем вставляем электроды в крышку где мы заранее сделали дырки, по следующей схеме: 1. Банка электролиза Вот фотка моего электролиза! Там хорошо видно клей, видно газоотводную трубку, так же если присмотреться видно графитовые электроды через стеклянную банку а сверху медное покрытие и видно на (+) красную резинку чтоб электроды не замыкали с друг другом! Затем герметизируем банку электролиза тонкой лентой для инсталляции (для водопроводный труб) Затем припаиваем провода к электродам: Наливаем в банки наш обработанный раствор NaCl Включаем блок питания и видим как с двух электродов выделяется газ хлор Ну вот мой электролиз После того как прошло определенное количество времени и вы отключили ваш электролиз то раствор не обходима очистить в несколько стадиях. 1. Во-первых в растворе присутствует разные крупные частицы(куски графита и тд) их легко удалить если процедить раствор через фильтр. 2. Берем наш раствор и кипятим в течение 10 мин,
Дата добавления: 2014-12-08 ; просмотров: 7405 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ Лабораторный и промышленный способы получения хлората калия. Получение хлорной известиЗадача 827. Находим массу бертолетовой соли из пропорции: 168 : 336 = х : 122,45; х = (168 . 122,45)/336 = 61,225 г. Количество бертолетовой соли рассчитаем из уравнения:
Ответ: m(KClO3) = 61,225 г; М(KClO3) = 0,5 моль. Задача 828. б) Оксид кальция, растворяясь в воде, образует гидроксид кальция: в) Электролизом водного раствора хлорида натрия можно получить хлор, который выделяется у анода: у катода: 2Н2О + 2 г) При действии хлора на гашеную известь получается так называемая белильная (или хлорная) известь и вода: CaOCl2 соответствует структурная формула: Хлорная известь применяется для отбелки растительных волокон (тканей, бумаги) и для дезинфекции. Задача 829. Для них
2Cl2(г) + О2(г) → 2Cl2O; Из данного уравнения реакции видно, что процесс идёт с поглощением теплоты. Так как Исходя из уравнения:
При положительном значении дельта Задача 830. При охлаждении раствора хлорат калия выпадает в осадок, так как мало растворим в холодной воде. 3Cl2 + 6KOH Поскольку хлорат калия (или бертолетовая соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок. источники: http://helpiks.org/1-43539.html http://buzani.ru/zadachi/khimiya-glinka/1272-sposoby-polucheniya-khloratov-zadachi-827-830 |
















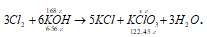
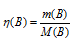 , где
, где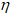 (B) — количество вещества, моль;
(B) — количество вещества, моль; 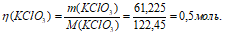
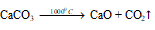
 = Н2↑ + 2ОН-;
= Н2↑ + 2ОН-; 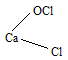
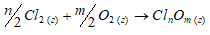
 S
S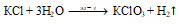
 5KCl + KClO3 + 3H2O.
5KCl + KClO3 + 3H2O.