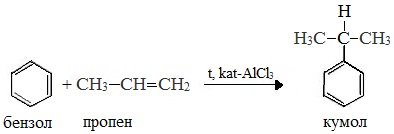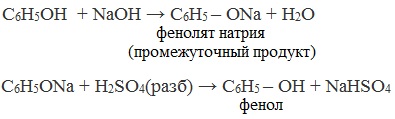Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
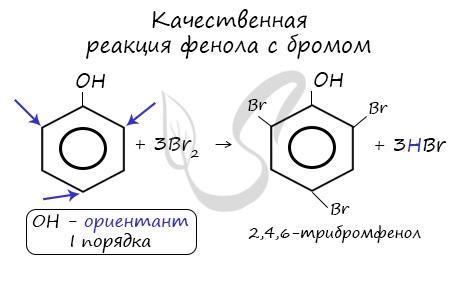
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
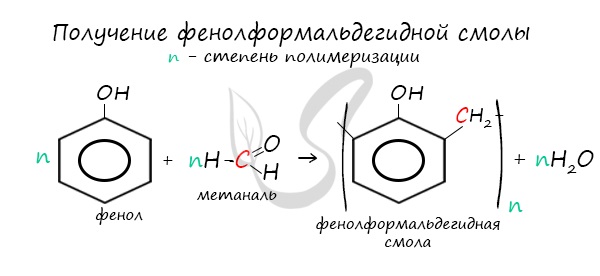
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
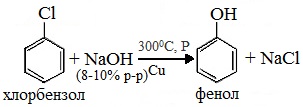
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
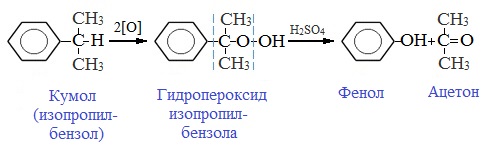
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Получение фенола в лаборатории уравнения реакции
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
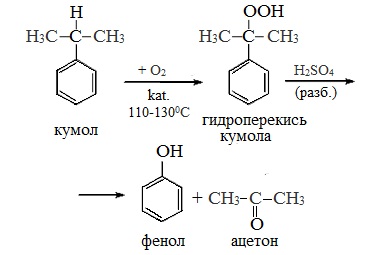
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Получение фенола в промышленности
1. Кумольный способ
(СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
1 стадия – получение кумола
2 стадия – каталитическое окисление
2. Из каменноугольной смолы (как побочный продукт – выход небольшой)
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
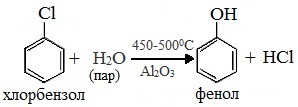
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами
или с водяным паром
4. Сплавлением солей аренсульфокислот с твёрдыми щелочами
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
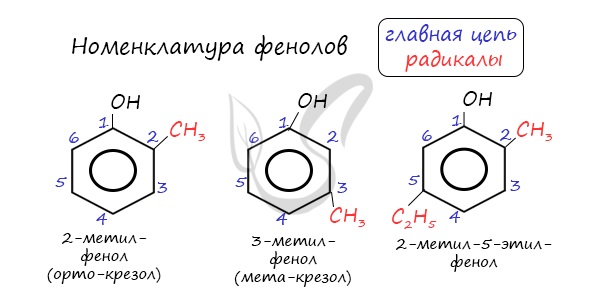
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
- Кислотные свойства
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
http://himija-online.ru/organicheskaya-ximiya/fenol/poluchenie-fenolov.html
http://studarium.ru/article/188