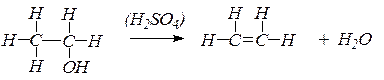Получение этилена и его горение
В сухую пробирку помещают несколько крупинок песка, 2 капли этилового спирта и 4 капли концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки — он горит светящимся пламенем.
CНз-СН2ОН + НОSОзН 
Этилсерная кислота — моноэфир неорганической двухосновной кислоты — при нагревании разлагается:
СНз-СН2-OSOзН 
Таким образом, при взаимодействии этилового спирта с серной кислотой происходит дегидратация спирта:
Выделяющийся этилен горит светящимся пламенем:
C2H4 + ЗO2 
Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется, кроме этилена и следов диэтилового эфира (СзН5)2О, ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до сернистого ангидрида:
2H2SO4 + С 
Сернистый ангидрид также может обесцвечивать растворы брома и марганцевокислого калия подобно этилену. Поэтому образующийся этилен промывают раствором щелочи для очистки от SO2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, сернистый ангидрид не образуется.
Дегидратация спиртов является общим способом получения непредельных углеводородов.
Дата добавления: 2015-09-11 ; просмотров: 2993 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Практическая работа № 2 Получение этилена и изучение его свойств.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 .
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха);
Mr ( алкена) = D (возд.)* Mr (воздуха);
Mr ( алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 );
Mr ( алкена) = 14*2 = 28.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 945 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 25 человек из 16 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 590 352 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 13.02.2018
- 1736
- 3
- 13.02.2018
- 641
- 0
- 13.02.2018
- 603
- 1
- 13.02.2018
- 68191
- 758
- 13.02.2018
- 1464
- 6
- 13.02.2018
- 1116
- 0
- 13.02.2018
- 299
- 0
- 13.02.2018
- 1596
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 13.02.2018 140837
- DOCX 209.6 кбайт
- 998 скачиваний
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Нечаев Дмитрий Валерьевич. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 года
- Подписчики: 0
- Всего просмотров: 285318
- Всего материалов: 25
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
Университет им. Герцена и РАО создадут портрет современного школьника
Время чтения: 2 минуты
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Минобрнауки создаст для вузов рекомендации по поддержке молодых семей
Время чтения: 1 минута
Минпросвещения подключит студотряды к обновлению школьной инфраструктуры
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Химические свойства этилена. Формула этилена
Непредельные углеводороды с двойной химической связью в молекулах относят к группе алкенов. Первым представителем гомологического ряда является этен, или этилен, формула которого: C2H4. Алкены часто называют олефинами. Название является историческим и возникло в 18-м веке, после получения продукта взаимодействия этилена с хлором – этилхлорида, имеющего вид маслянистой жидкости. Тогда этен и назвали маслородным газом. В нашей статье мы изучим его химические свойства, а также получение и применение в промышленности.
Взаимосвязь между строением молекулы и свойствами вещества
Согласно теории строения органических веществ, предложенной М. Бутлеровым, характеристика соединения полностью зависит структурной формулы и вида связей его молекулы. Химические свойства этилена также определяются пространственной конфигурацией атомов, гибридизацией электронных облаков и наличием в его молекуле пи-связи. Два негибридизованных p-электрона атомов углерода перекрываются в плоскости, перпендикулярной плоскости самой молекулы. Формируется двойная связь, разрыв которой обусловливает способность алкенов к реакциям присоединения и полимеризации.
Физические свойства
Этен – это газообразное вещество, с едва уловимым своеобразным запахом. Оно плохо растворимо в воде, но хорошо растворяется в бензоле, тетрахлорметане, бензине и других органических растворителях. Исходя из формулы этилена С2Н4, его молекулярная масса равна 28, то есть этен немного легче воздуха. В гомологическом ряду алкенов с увеличением их массы агрегатное состояние веществ изменяется по схеме: газ – жидкость – твердое соединение.
Получение газа в лаборатории и промышленности
Нагревая этиловый спирт до 140 °С в присутствии концентрированной серной кислоты, можно получить этилен в лабораторных условиях. Еще один способ – отщепление атомов водорода от молекул алканов. Действуя едким натрием или калием на галогензамещенные соединения предельных углеводородов, например на хлорэтан, добывают этилен. В промышленности наиболее перспективным способом его получения является переработка природного газа, а также пиролиз и крекинг нефти. Все химические свойства этилена — реакции гидратации, полимеризации, присоединения, окисления — объясняются наличием в его молекуле двойной связи.
Взаимодействие олефинов с элементами главной подгруппы седьмой группы
Все члены гомологического ряда этена присоединяют атомы галогенов по месту разрыва пи-связи в своей молекуле. Так, водный раствор брома красно-коричневого цвета обесцвечивается, в результате чего образуется уравнение этилена — дибромэтан:
Аналогично протекает реакция с хлором и йодом, в ней присоединение атомов галогенов также происходит по месту разрушения двойной связи. Все соединения – олефины могут взаимодействовать с галогеноводородами: хлороводородом, фтороводородом и т.д. В результате реакции присоединения, протекающей по ионному механизму, образуется вещества – галогенопроизводные предельных углеводородов: хлорэтан, фторэтан.
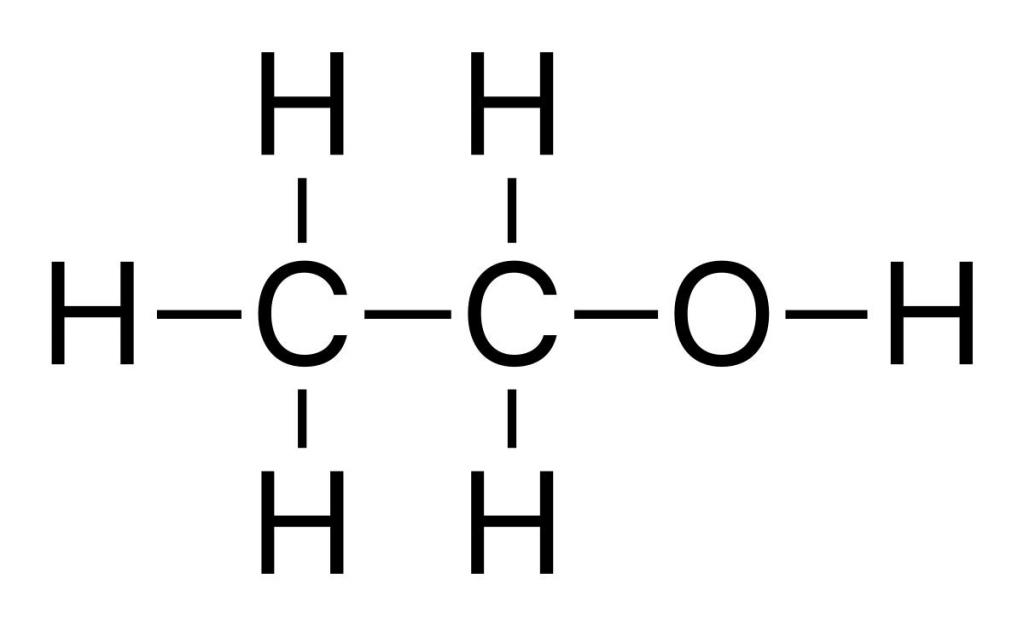
Промышленное производство этанола
Химические свойства этилена часто используют для получения важных веществ, широко применяемых в промышленности и быту. Например, нагревая этен с водой в присутствии ортофосфорной или серной кислот, под действием катализатора происходит процесс гидратации. Он идет с образованием этилового спирта – многотоннажного продукта, получаемого на химических предприятиях органического синтеза. Механизм реакции гидратации протекает по аналогии с другими реакциями присоединения. Кроме того, взаимодействие этилена с водой также происходит в результате разрыва пи-связи. К свободным валентностям атомов углерода этена присоединяются атомы водорода и гидроксогруппа, входящие в состав молекулы воды.
Гидрогенизация и горение этилена
Несмотря на все вышесказанное, реакция соединения водорода не имеет большого практического значения. Однако она показывает генетическую связь между различными классами органических соединений, в данном случае алканов и олефинов. Присоединяя водород, этен превращается в этан. Противоположный процесс – отщепление от предельных углеводородов атомов водорода приводит к образованию представителя алкенов – этена. Жесткое окисление олефинов, называемое горением, сопровождается выделением большого количества тепла, реакция является экзотермической. Продукты сгорания одинаковы для веществ всех классов углеводородов: алканов, непредельных соединений ряда этилена и ацетилена, ароматических веществ. К ним относятся углекислый газ и вода. Воздух в реакции с этиленом образует взрывчатую смесь.
Реакции окисления
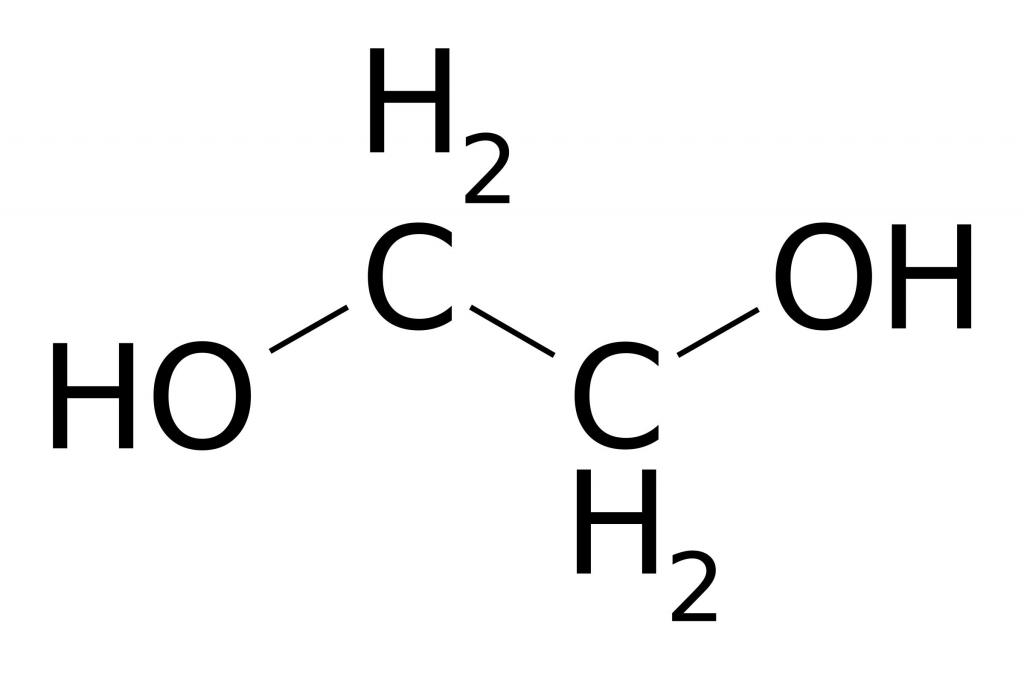
Этен может окисляться раствором перманганата калия. Это одна из качественных реакций, с помощью которой доказывают наличие двойной связи в составе определяемого вещества. Фиолетовая окраска раствора исчезает вследствие разрыва двойной связи и образования двухатомного предельного спирта – этиленгликоля. Продукт реакции имеет широкий спектр применения в промышленности в качестве сырья для получения синтетических волокон, например лавсана, взрывчатых веществ и антифризов. Как видим, химические свойства этилена используются для получения ценных соединений и материалов.
Полимеризация олефинов
Повышение температуры, увеличение давления и применение катализаторов – это необходимые условия для проведения процесса полимеризации. Его механизм отличается от реакций присоединения или окисления. Он представляет собой последовательное связывание многих молекул этилена в местах разрыва двойных связей. Продуктом реакции является полиэтилен, физические характеристики которого зависят от величины n — степени полимеризации. Если она невелика, то вещество находится в жидком агрегатном состоянии. Если показатель приближается к 1000 звеньев, то из такого полимера изготовляют полиэтиленовую пленку, гибкие шланги. Если степень полимеризации превышает 1500 звеньев в цепи, то материал представляет собой твердое вещество белого цвета, жирное на ощупь.
Он идет на изготовление цельнолитых изделий и пластиковых труб. Галогенпроизводное соединение этилена – тефлон обладает антипригарными свойствами и является широко применяемым полимером, востребованным при изготовлении мультиварок, сковород, жаровен. Его высокая способность противостоять истиранию используется в производстве смазок к автомобильным двигателям, а низкая токсичность и толерантность к тканям человеческого организма позволили применять тефлоновые протезы в хирургии.
В нашей статье мы рассмотрели такие химические свойства олефинов, как горение этилена, реакции присоединения, окисления и полимеризации.
http://infourok.ru/prakticheskaya-rabota-poluchenie-etilena-i-izuchenie-ego-svoystv-2596196.html
http://www.syl.ru/article/373013/himicheskie-svoystva-etilena-formula-etilena