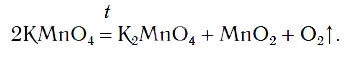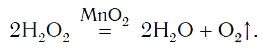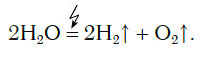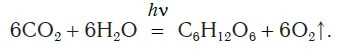Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Урок 17. Получение кислорода
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
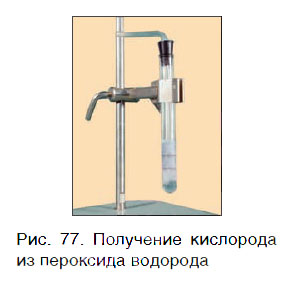
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
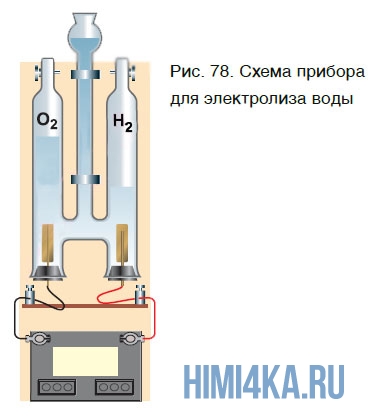
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Вариант получения кислорода — какие нужны условия для реакции
Что такое кислород в химии — где находится в природе
Кислород (O, лат. oxygenium) — является химическим элементом 16-й группы (согласно устаревшей сокращенной форме периодической системы, относится к главной подгруппе VI группы, или к группе VIA) второго периода периодической системы, имеет атомный номер 8.
Кислород относят к химически активным неметаллам. Элемент представляет собой наиболее легкий из всех в группе халькогенов. Являясь простым веществом, кислород при нормальных условиях принимает вид бесцветного и безвкусного газообразного вещества, не обладающего запахом. В молекуле кислорода имеются два атома.
Формула простого вещества кислорода: O 2 . По этой причине вещество называют дикислородом. Кислород в жидком агрегатном состоянии характеризуется светло-голубой окраской. Твердый кислород в виде кристаллов имеет светло-синий оттенок.
Одной из аллотропных форм кислорода является о з о н . В нормальных условиях вещество имеет голубую окраску и специфический запах. Молекула озона состоит из трех атомов кислорода. Формула вещества: O 3 .
Электронная конфигурация атома кислорода: 1 s 2 2 s 2 2 p 4
Валентные возможности кислорода: может проявлять валентности II и III, учитывая способность формировать связи по донорно–акцепторному механизму, к примеру, в ионе гидроксония Н 3 О + . Кислород может иметь следующие степени окисления:
- +2 — соединяясь со фтором O F 2 ;
- +1 — соединяясь со фтором О 2 F 2 ;
- 0 — в простых веществах O 2 (кислород), O 3 (озон);
- –1 — в пероксидах ( Н 2 O 2 , N a 2 O 2 ) ;
- –2 — в других соединениях кислорода (за исключением супероксидов).
Простое вещество кислород включает в состав двухатомные молекулы. Атомы в молекуле соединены с помощью ковалентной неполярной связи. Связь является двойной по той причине, что каждый из атомов кислорода обладает двумя неспаренными электронами, которые расположены на внешнем энергетическом уровне. Структурная и электронная формулы кислорода:
Кислород представляет собой наиболее распространенный из всех элементов, составляющих земную кору. Вещество представлено различными соединениями, в большей степени, силикатами. Его концентрация достигает примерно 47% в массе твердой земной коры. В морской и пресной воде содержание кислорода приближено к 82% по массе. Свыше 1,5 тысяч соединений, находящихся в коре Земли, состоят из кислорода.
Атмосфера содержит 20,95% кислорода в свободном виде по объему и по массе 23,10%, что равно примерно 10 15 тоннам. С другой стороны, до формирования первых микробов, питающихся за счет фотосинтеза, в архее 3,5 млрд лет назад атмосфера почти не содержала кислород. Появление свободного кислорода в больших объемах связано с изменениями состава атмосферы глобального характера, которые начались в палеопротерозое 3—2,3 млрд лет назад. Данный процесс получил название кислородной катастрофы.
В течение первого миллиарда лет почти весь запас кислорода поглощался железом, которое было растворено в океанических водах. Таким образом, формировались залежи джеспилита. Примерно 3—2,7 млрд лет назад началось активное выделение кислорода в атмосферу. Около 1,7 млрд лет назад содержание кислорода в атмосфере достигло 10 % от нынешнего уровня.
По причине высокой концентрации растворенного и свободного кислорода в океанических водах и земной атмосфере, вымерло большинство анаэробных существ. Несмотря на это, благодаря клеточному дыханию, осуществляемому за счет кислорода, аэробные организмы смогли вырабатывать существенно больше АТФ по сравнению с анаэробными, что позволило занять им доминирующие позиции в природном мире.
С начала кембрия 540 млн лет назад кислород содержался в атмосфере на уровне 15% — 30% по объему. Конец каменноугольного периода (около 300 миллионов лет назад) отмечен максимальной концентрацией кислорода в 35% по объему, который, вероятно, являлся одной из причин существования гигантских насекомых и земноводных в тот период.
Превалирующая часть кислорода на планете является результатом жизнедеятельности фитопланктона, место обитания которого — Мировой океан. Примерно 60 % кислорода от используемого живыми организмами тратится на реализацию процессов гниения и разложения, 80 % кислорода, который производят леса, уходит на гниение и разложение лесной растительности. Деятельность человека в меньшей степени оказывает влияние на количество свободного кислорода в атмосфере. При современных темпах фотосинтеза необходимо примерно 2 тысячи лет, чтобы восстановить весь кислород в атмосфере.
Из кислорода состоят многие вещества органического происхождения. Вещество входит в компонентный состав всех живых клеток. По числу атомов в живых клетках кислород составляет около 25 %, по массовой доле — около 65 %. В 2016 году исследователи из Дании представили доказательства наличия свободного кислорода в составе атмосферы уже 3,8 млрд лет назад.
Химические и физические свойства
Кислород в объеме 1 л при нормальных условиях весит 1,429 г. Вещество несколько тяжелее, чем воздух. Кислород обладает низкой степенью растворимости в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C), однако хорошо растворяется в расплавленном серебре (22 объема O 2 в 1 объеме Ag при +961 °C) и в перфторированных углеводородах (20—40 об %).
Межатомное расстояние составляет 0,12074 нм. Кислород относят к парамагнетикам. В жидком агрегатном состоянии кислород способен притягиваться магнитом. В процессе нагрева газообразный кислород вступает в реакцию диссоциации на атомы, которая является обратимой. Концентрация диссоциированных атомов в смеси при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %. Кипение жидкого кислорода можно наблюдать в условиях давления 101,325 кПа (1 атм.) при температуре −182,98 °C. В этом случае вещество имеет вид бледно-голубой жидкости. Критическая температура кислорода 154,58 К (-118,57 °C), критическое давление 4,882 Мпа.
Физические свойства кислорода:
- атомная масса 15 , 99903 ; 15 , 99977 а . е . м . ( г / м о л ь ) ;
- термодинамической фазой при обычных условиях является газ;
- плотность вещества при нормальных условиях равна 0 , 00142897 г / с м 3 ;
- температура плавления 54 , 8 К ( — 218 , 35 ° C ) ;
- температура кипения 90 , 19 К ( — 182 , 96 ° C ) ;
- удельная теплота плавления 0 , 444 к Д ж / м о л ь ;
- удельная теплота испарения 3 , 4099 к Д ж / м о л ь ;
- молярная теплоемкость 29 , 4 Д ж / ( K · м о л ь ) ;
- молярный объем 14 , 0 с м 3 / м о л ь ;
- теплопроводность ( 300 K ) 0 , 027 В т / ( м · К ) .
Кислород является сильным окислителем, вторым после фтора. Вещество способно формировать бинарные соединения (оксиды) со всеми элементами, за исключением гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, по причине высокого значения электроотрицательности у фтора, которое выше аналогичного показателя для кислорода).
Наиболее часто встречающаяся степень окисления кислорода в соединениях с другими элементами −2. В распространенных случаях реакция окисления веществ кислородом сопровождается выделением тепла и ускоряется при нагреве.
Пример реакций окисления, которые протекают в условиях комнатной температуры:
4 L i + O 2 → 2 L i 2 O
2 S r + O 2 → 2 S r O
Кислород окисляет соединения, содержащие элементы с не максимальной степенью окисления:
2 N O + O 2 → 2 N O 2 ↑
Кислород способен окислять большинство органических соединений в реакциях горения:
2 C 6 H 6 + 15 O 2 → 12 C O 2 + 6 H 2 O
C H 3 C H 2 O H + 3 O 2 → 2 C O 2 + 3 H 2 O
При определенных условиях представляется возможным провести мягкое окисление органического соединения:
C H 3 C H 2 O H + O 2 → C H 3 C O O H + H 2 O
Кислород вступает в химические реакции непосредственно (при нормальных условиях, при нагреве и/или наличии катализаторов) со всеми простыми веществами, за исключением A u и инертных газов ( H e , N e , A r , K r , X e , R n ) . Взаимодействие кислорода с галогенами возможно при пропускании электрического разряда или под ультрафиолетом.
Косвенным путем получены оксиды золота и тяжелых инертных газов (Xe, Rn). В каждом из двухэлементных соединений с другими элементами кислород имеет отрицательную степень окисления, за исключением соединений со фтором.
Кислород формирует пероксиды со степенью окисления атома кислорода, формально равной −1.
Получение пероксидов в процессе сгорания щелочных металлов в кислороде:
2 N a + O 2 → N a 2 O 2
Поглощение кислорода определенными оксидами:
2 B a O + O 2 → 2 B a O 2
Согласно теории горения, авторами которой являются А. Н. Бах и К. О. Энглер, окисление протекает в два этапа, что сопровождается формированием промежуточного пероксидного соединения. Данный продукт реакции выделяют, к примеру, при охлаждении пламени горящего водорода льдом. Кроме воды, образуется пероксид водорода:
H 2 + O 2 → H 2 O 2
В надпероксидах кислород формально имеет степень окисления − ½ . Таким образом, один электрон приходится на два атома кислорода (ион ( O 2 ) — ). Получают надпероксиды взаимодействием пероксидов с кислородом в условиях высокого давления и температуры:
N a 2 O 2 + O 2 → 2 N a O 2
Калий K , рубидий R b и цезий C s вступают в химическое взаимодействие с кислородом, что приводит к образованию надпероксидов:
В состав неорганических озонидов входит ион ( O 3 ) — со степенью окисления кислорода, формально равной − ⅓ . Получают озониды действием озона на гидроксиды щелочных металлов:
3 K O H + 3 O 3 → 2 K O 3 + K O H * H 2 O + 2 O 2 ↑
Кислород может проявлять восстановительные свойства.
В ионе диоксигенила ( O 2 ) + кислород характеризуется формально степенью окисления + ½ . Получают такие соединения по реакции:
P t F 6 + O 2 → O 2 P t F 6
Дифторид кислорода, O F 2 , степень окисления кислорода +2, получают, пропуская фтор через разбавленный раствор щелочи:
2 F 2 + 2 N a O H → 2 N a F + H 2 O + O F 2 ↑
Монофторид кислорода (диоксидифторид), O 2 F 2 является нестабильным соединением. Степень окисления кислорода равна +1. Получают вещество из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
F 2 + O 2 → O 2 F 2
Путем пропускания тлеющего разряда через смесь фтора с кислородом при определенных показателях давления и температурном режиме, получают смеси фторидов кислорода O 3 F 2 , O 4 F 2 , O 5 F 2 и O 6 F 2 .
Кислород поддерживает процессы дыхания, горения, гниения.
Способы получения, для чего это нужно, применение
Одним из промышленных методов получения кислорода является перегонка жидкого воздуха. Основной способ — криогенная ректификация. Активно применяют кислородные установки, которые функционируют по принципу мембранной технологии и адсорбции.
В лабораторных условиях используют кислород промышленного производства. Вещество поставляют в баллонах из стали, давление внутри которых достигает 15 МПа.
Получение кислорода в лаборатории основано на разложении кислородсодержащих веществ.
В небольших количествах вещество синтезируют путем нагрева перманганата калия K M n O 4 :
Реакция каталитического разложения пероксида водорода H 2 O 2 при наличии оксида марганца(IV):
Получение кислорода с помощью каталитического разложения хлората калия (бертолетовой соли) K C l O 3 :
Разложение оксида ртути(II) (при t = 100 °C) является первым изобретенным способом получения кислорода:
Другим лабораторным способом получения кислорода является электролиз водных растворов.
Уравнение получения кислорода с помощью электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
В лабораторных условиях кислород синтезируют также в процессе реакции перекисных соединений с углекислым газом.
Распространенным вариантом получения кислорода на подводных лодках и орбитальных станциях является реакция пероксида натрия и углекислого газа, который выдыхают люди:
Сбалансировать объемы углекислого газа, который был поглощен, и выделившегося кислорода можно путем добавления к нему надпероксида калия. В космических кораблях с целью уменьшения веса в некоторых случаях используют пероксид лития.
Кислород в промышленных масштабах начали активно использовать в середине ХХ столетия. Причиной этому стало создание турбодетандеров, которые представляли собой установки по сжижению и разделению жидкого воздуха.
Вещество нашло широкое применение в металлургическом производстве. Изготовление стали конвертерным методом или переработка штейнов связаны с использованием кислорода. Многие модели металлургического оборудования более эффективно сжигают топливные ресурсы за счет замены воздуха в горелках на кислородно-воздушную смесь. Кислород в баллонах голубого цвета необходим для осуществления газопламенной резки и сварки металлов.
Жидкий кислород играет роль окислителя в ракетном топливе, наряду с пероксидом водорода, азотной кислотой и другими соединениями. Смесь из жидкого кислорода и жидкого озона является одним из самых сильных окислителей ракетного топлива. Удельный импульс смеси из водорода и озона больше, чем удельный импульс для пары водород-фтор и водород-фторид кислорода.
Медицинский кислород хранят в металлических газовых резервуарах. Вещество в баллонах находится под высоким давлением. Тара характеризуется голубым цветом и может отличаться по объему: от 1,2 до 10,0 литров. Давление внутри резервуара достигает 15 МПа (150 атм). С помощью такого кислорода обогащают дыхательные газовые смеси, используемые:
- в наркозной аппаратуре;
- при нарушении дыхательных процессов;
- с целью купирования приступа бронхиальной астмы;
- для устранения гипоксии какого-либо генеза;
- при декомпрессионной болезни;
- в лечении патологии желудочно-кишечного тракта в виде кислородных коктейлей.
Крупные предприятия сферы здравоохранения в определенных случаях заменяют сжатый кислород в баллонах на сжиженное вещество в сосуде Дьюара большой емкости. Для индивидуального использования медицинский кислород перекачивают из баллонов в специальные прорезиненные приборы в виде кислородных подушек.
С помощью кислородных ингаляторов осуществляется подача кислорода или кислородо-воздушной смеси в одно и то же время одному или двум пострадавшим в полевых или стационарных условиях. Данный аппарат бывает разных модификаций и обладает рядом преимуществ, в том числе, наличием конденсатора-увлажнителя газовой смеси, который использует влагу выдыхаемого воздуха.
Определить остаток кислорода в баллоне в литрах можно путем умножения величины давления в баллоне в атмосферах (по манометру редуктора) на величину емкости баллона в литрах. К примеру, в двухлитровом резервуаре, согласно показаниям манометра, давление кислорода равно 100 атм. Объем кислорода в данном случае составит 100 × 2 = 200 литров.
На предприятиях пищевой промышленности кислород используют в качестве пищевой добавки Е948. Также вещество играет роль пропеллента и упаковочного газа. Кислород активно применяют в сфере химической промышленности, как реактив-окислитель во многих синтезах, к примеру:
- окисление углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты);
- окисление диоксида серы в триоксид серы;
- окисление аммиака в оксиды азота в производстве азотной кислоты.
В процессе окисления достигаются высокие температуры. В связи с этим многие перечисленные реакции протекают в режиме горения — реакций окисления с выделением большого количества тепла и света. Кислород также используют в сфере сельского хозяйства. С его помощью изготавливают кислородные коктейли, которые применяют в тепличных комплексах. Кислородные добавки способствуют приросту веса у животных. Кислородом обогащают водную среду в рыболовстве.
http://himi4ka.ru/arhiv-urokov/urok-17-poluchenie-kisloroda.html
http://wika.tutoronline.ru/himiya/class/8/variant-polucheniya-kisloroda—kakie-nuzhny-usloviya-dlya-reakczii