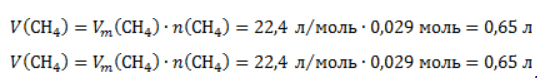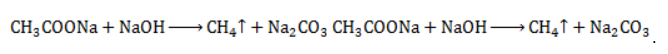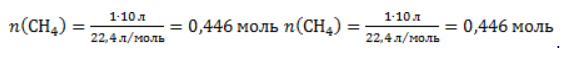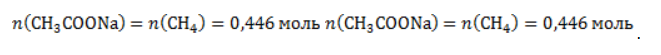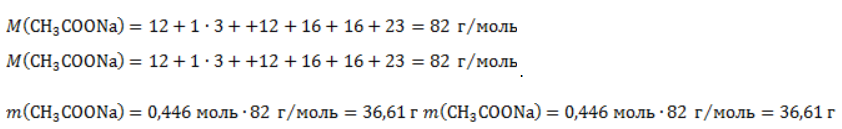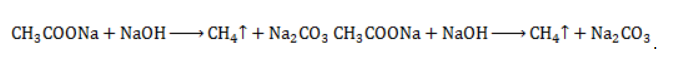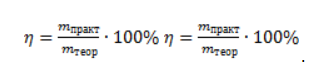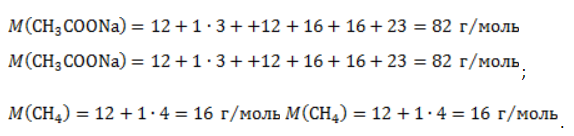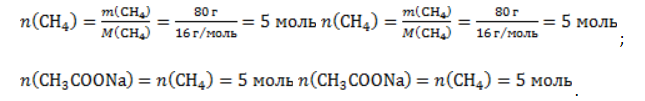Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
Например. При нитровании метана образуется преимущественно нитрометан:2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. 3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Получение метана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. 2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: 5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. АлканыОрганическая химияМы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ. По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉 В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей. Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2. Номенклатура алкановНоменклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д. Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2 Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный). Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже. В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода. Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия). Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах. В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера. Некоторые данные, касающиеся алканов, надо выучить:
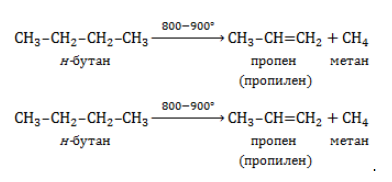
Природный газ и нефтьАлканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения. В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы. Получение алкановВ промышленности алканы получают путем:
В ходе крекинга нефти получается один алкан и один алкен. Гидрогенизацией угля (торфа, сланца) Гидрированием оксида углерода II В лабораторных условиях алканы получают следующими способами:
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан. Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена. В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца). На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже. В результате электролиза солей карбоновых кислот может происходить образование алканов. В результате разложения карбида алюминия образуется метан и гидроксид алюминия. Гидрированием ненасыщенных углеводородов Химические свойства алкановАлканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного. Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода. Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму. Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2. Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды. В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты. Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода. В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3. Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Получение метана в лаборатории и промышленностиПростейшее углеводородное соединение – метан – используется в промышленности, на транспорте, в быту, находя широкое применение и как сырье для органического синтеза, и в качестве конечного продукта. Потребность в метане испытывают многие отрасли хозяйства, и его производство постоянно расширяется. Общая характеристика метанаМетан представляет собой легкий бесцветный горючий газ без запаха. Распространен в природе как основной компонент природного газа и попутных нефтяных газов. Химическая формула – В атмосферу метан поступает в составе вулканических газов, а также является продуктом жизнедеятельности ряда микроорганизмов. В форме газогидратов в значительных количествах содержится на дне океанов и в многолетней мерзлоте. Является одним из важнейших парниковых газов. Как представитель ряда предельных углеводородов проявляет низкую химическую активность. Вследствие малой растворимости в воде и химической инертности метан считается малотоксичным веществом (класс опасности – IV), но при высокой концентрации в воздухе (4,4 — 17%) взрывоопасен, а дальнейшее повышение содержания метана приводит к удушью от недостатка кислорода. Физические свойстваОсновные физические характеристики метана при нормальном атмосферном давлении приведены в таблице. Получение метанаПромышленное производство и получение метана в лаборатории проводятся разными методами. Существуют также способы получения газа в домашних условиях, например, в частном хозяйстве для удовлетворения потребности в топливе. Промышленные методы получения метанаПоскольку газ в больших количествах поступает при добыче нефтегазового сырья, способы его производства нацелены не на искусственный синтез, а на выделение в процессах переработки нефти и газа. Кроме того, метан может быть получен при технологической обработке каменноугольного сырья. Очистка и переработка природного газаМетан – главный компонент такого важного вида горючих полезных ископаемых, как природный газ. Содержание метана в газе различных месторождений составляет 70-98%. После очистки от твердых частиц и примесей (сероводород, азот, углекислый газ, гелий) и осушки (отделения водяных паров) природный газ подвергается низкотемпературному фракционированию. Более тяжелые углеводородные компоненты газа – этан, пропан и бутан – переходят в жидкую фазу при более высоких температурах, чем метан, и последовательно отделяются от него в конденсационной колонне. Переработка нефти и попутного газаВ процессах термического разложения (пиролиза) высокомолекулярных алканов, входящих в состав нефти, в числе продуктов получают метан: Метан входит в состав газа, отделяемого от сырой нефти в процессе крекинга (разложения при высоком давлении и температурах около 450 — 550 ℃ либо с использованием катализатора). Кроме того, метан составляет значительную долю попутных газов, от которых его отделяют методом сепарации. Переработка каменного угля
Лабораторный синтез метанаВ лабораторной практике используются два основных способа получения метана:
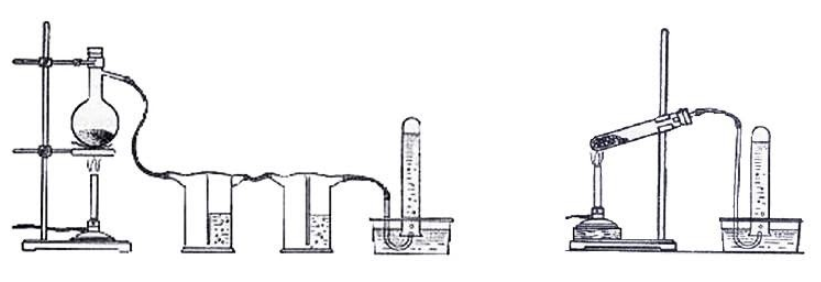
Взаимодействие карбида алюминия с водой (метод Муассана)Неорганическое бинарное соединение Реакция необратима и служит простым и удобным способом получения газа в лабораторных условиях. Взаимодействие ацетата натрия с щелочью (метод Дюма)Еще один простой лабораторный способ получения метана – прокаливание натриевой соли уксусной кислоты Подробное рассмотрение лабораторного процесса показывает, как с помощью щелочи получить метан из ацетата натрия. Присутствие воды препятствует этой реакции, поэтому уксуснокислый натрий должен быть обезвожен, а гигроскопичный гидроксид натрия – смешан с негашеной известью (оксидом кальция). Такая смесь носит название натронной извести. В реакционной смеси она должна присутствовать с избытком 1:3, чтобы обеспечить полное использование ацетата натрия. Порошки реагентов хорошо перемешиваются и помещаются в колбу с отводной трубкой или в пробирку. Выделяющийся газ собирают по методу вытеснения воды в пробирку. При нагревании колбы на пламени горелки используется асбестовая сетка. Пробирку нагревают на открытом пламени. Для улавливания примесей может использоваться промывная склянка с раствором щелочи. Для проверки результата опыта газ в пробирке поджигается. Варианты сборки прибора для получения метана в лаборатории изображены на рисунке. Получение метана в домашних условияхМетан можно получать и как продукт биологических процессов. Он выделяется в ходе обмена веществ особыми анаэробными микроорганизмами – бактериями-метаногенами. Они широко распространены в органических отходах животного и растительного происхождения. Поскольку метан может применяться в качестве горючего для водонагревательных установок, печей и кухонного оборудования, в частных хозяйствах, располагающих большим количеством отходов, становится выгодным самостоятельное получение из них метана и его использование. Получение из органических отходов животноводстваМетаногены обитают в кишечном тракте позвоночных и принимают участие в пищеварительном процессе. Поэтому в хозяйствах, занимающихся разведением крупного рогатого скота, свиней или домашней птицы, отходы жизнедеятельности животных могут быть переработаны с помощью биогазовых установок. Неразложимый остаток служит органическим удобрением. Технология получения биогенного метана состоит из нескольких этапов:
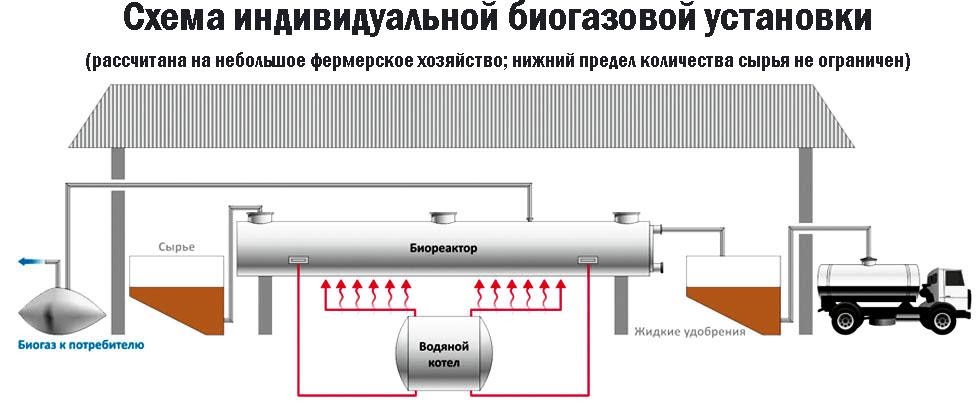
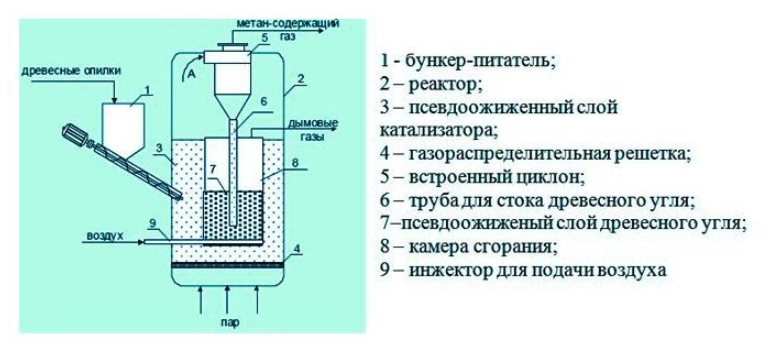
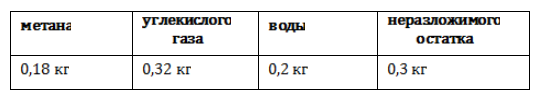
В некоторых установках предусмотрена система очистки биогаза от примесей – углекислого газа и сероводорода. Получение из древесиныВ качестве сырья для биогазовой технологии могут использоваться и растительные отходы, такие как древесная щепа. Пригодна для использования в биореакторе некондиционная древесина (например, пораженная вредителями или пострадавшая от пожаров), а также отходы лесозаготовок – ветки, кора и пр. Так как древесина содержит смолы, в установках по ее переработке нужно применять катализаторы для очистки газа. В качестве катализатора подходят шлаки металлургических производств, особенно эффективны мартеновские шлаки. Эффективность синтеза биометанаВ среднем переработка 1 кг биомассы, разложимой на 70%, дает: Эффективность выработки биогаза зависит от поддержания нужной температуры ферментации, поэтому в холодных регионах работа биогазовой установки потребует дополнительных затрат на подогрев и устройство надежной теплоизоляции. Большую роль играет биохимическое равновесие: выход газа снижается при возрастании кислотности. В этом случае требуется добавление нейтрализующего агента. Крупные фермерские хозяйства могут позволить себе привлечение специалистов, установку полностью автоматизированных биореакторов с большим выходом газа и получать дополнительный доход от его продажи. Для эффективной работы установки необходимо бесперебойное поступление сырья, поэтому хозяйствам с малым количеством животных невыгодно заниматься производством биометана. Если количество биомассы позволяет наладить синтез газа в небольшом хозяйстве, мини-установку для его производства можно сделать собственными силами. Следует помнить, что ее сооружение потребует серьезных вложений, составления технологической схемы, оформления документации, согласования с СЭС, пожарной и газовой инспекциями. Если хозяйство имеет возможность установить биогазовый реактор, оно получает существенные выгоды:
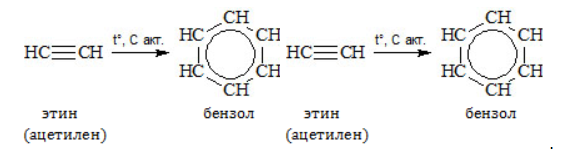
Метан в органическом синтезеМетан широко используется для получения многих востребованных соединений, таких как ацетилен, метанол или анилин. Получение ацетилена из метанаВ лабораторной практике проводится дегидрирование метана. Реакция требует сильного нагревания: В промышленности используются такие методы, как:
В этой реакции используется теплота частичного сгорания сырья, благодаря которой реакционная смесь разогревается до 1600 ℃ . Получение метанола из метанаМетиловый спирт может быть получен:
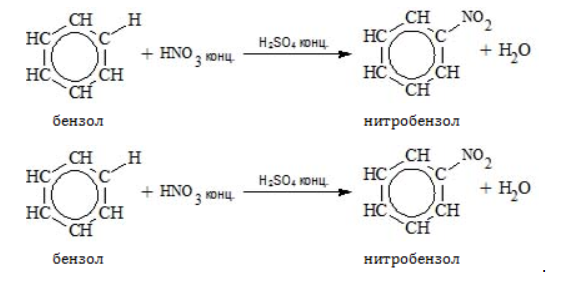
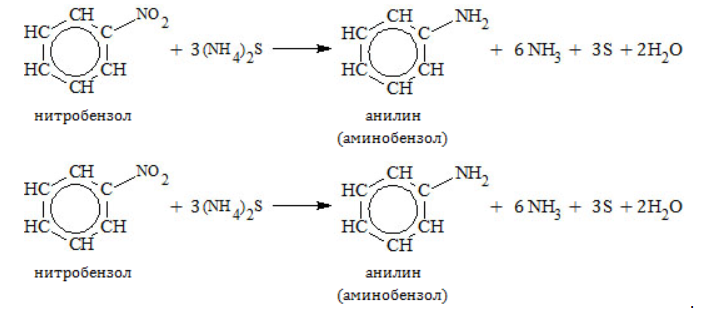
Получение анилина из метанаАроматическое соединение анилин получают в несколько стадий:
ЗаключениеМетан востребован во многих областях. Росту объемов его производства для различных нужд способствует достаточно высокая распространенность в природе. Однако метан производится не только на крупных промышленных предприятиях. Простота его получения с использованием биологических отходов стимулирует производство индивидуальными хозяйствами, что идет на пользу экологической обстановке, снижая бесконтрольное гниение отходов и выброс ценного продукта в атмосферу. Примеры решения задач1. Каков объем метана, выделяющегося при гидролизе карбида алюминия массой 12.5 г.? Запишем уравнение реакции: Найдем количество карбида алюминия, вступающего в реакцию, по формуле Из уравнения реакции видно, что Молярный объем газа Vm при нормальных условиях составляет 2. Какова масса ацетата натрия, необходимого для получения 10 л метана? Запишем уравнение реакции: Используя знание молярного объема газа, составим пропорцию: Вычислим количество получаемого метана: Из него следует, что количество ацетата натрия равно количеству метана: Рассчитаем массу ацетата натрия по формуле m=nM. 3. Сколько граммов ацетата натрия затрачено на получение 60 г метана при выходе продукта реакции 75%? Запишем уравнение реакции: Выход продукта равен отношению массы вещества, полученной на практике, к массе, рассчитанной по уравнению: Вычислим расчетную массу метана: Рассчитаем молярные массы ацетата натрия и метана: Уравнение показывает, что количества вещества ацетата натрия и метана равны. Вычислим их: Вычислим массу ацетата натрия: источники: http://studarium.ru/article/181 http://allinchemistry.ru/organicheskaya-himiya/poluchenie-metana-v-laboratorii-i-promyshlennosti |



































 .
.

 с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия:
с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия: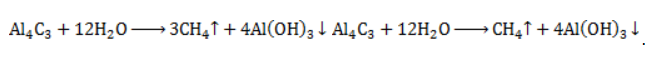
 с едким натром
с едким натром  :
: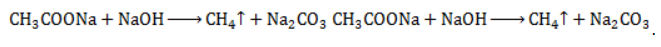
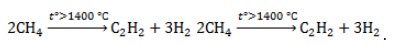


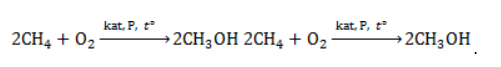
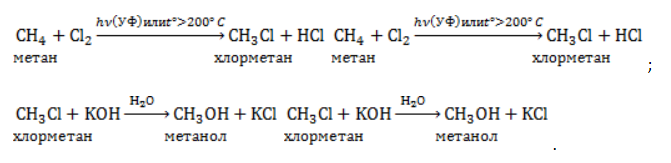
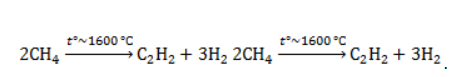

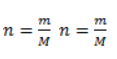 , где – n количество вещества, m– масса, M – молярная масса.
, где – n количество вещества, m– масса, M – молярная масса.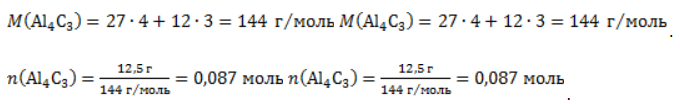
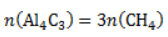 . Следовательно, количество метана равно:
. Следовательно, количество метана равно: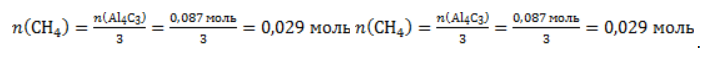
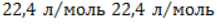 . Следовательно, объем метана будет равен:
. Следовательно, объем метана будет равен: