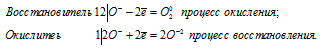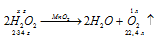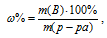Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
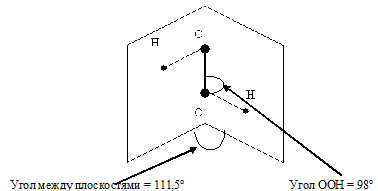
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Производство перекиси водорода и надсернокислых соединений
Производство перекиси водорода

Надсернокислые соединения — персульфаты калия и аммония — являются промежуточными продуктами при производстве перекиси водорода и имеют самостоятельное значение как твердые окислители. Первый из них применяется также в качестве катализатора.
В настоящее время нашли промышленное применение способы получения перекиси водорода электролизом и через органические соединения: этилантрахинон, n -азотолуол и некоторые другие.
Получения перекиси водорода электролизом
Образование перекиси водорода в кислой среде возможно в результате как восстановительной, так и окислительной реакции:
Наличие двух электрохимических процессов образования перекиси водорода открывает принципиальную возможность непосредственного ее получения как на катоде, так и на аноде. Действительно, если ртутный или амальгамированный медный, или серебряный катод, погруженный в кислоту, омывать газообразным кислородом, то на нем образуется перекись водорода по реакции. Стандартный потенциал этой реакции φ°=+0,69 в.
Если бы электрохимическое восстановление на катоде ограничивалось только этой реакцией, то мы имели бы весьма экономичный и простой способ получения перекиси водорода.
Однако на катоде возможно дальнейшее восстановление перекиси водорода по реакции
со стандартным потенциалом φ °= + 1,77 в, а также непосредственное восстановление кислорода до воды:
Стандартный потенциал последней реакции φ°= +,23 в.
Как видно из сопоставления величин стандартных потенциалов, наиболее отрицательным потенциалом обладает реакция образования перекиси водорода. Следовательно реакция может протекать лишь в том случае, если перенапряжение реакции велико. Реакция тоже должна быть в максимальной степени заторможена, ибо в противном случае вся образующаяся перекись водорода будет успевать восстанавливаться до воды.
Увеличить скорость образования перекиси водорода можно, повысив концентрацию растворенного кислорода путем повышения давления кислорода в газовой фазе. Но вместе с повышением концентрации перекиси водорода скорость ее восстановления до воды возрастает и поэтому катодным восстановлением удается получать лишь разбавленные растворы перекиси водорода. Чтобы избежать высоких давлений и уменьшить потери образовавшейся перекиси водорода, Берль предложил применять полый угольный катод, обработанный гидрофобными веществами, например парафином. Наружная поверхность катода покрывается тонким слоем активированного угля, сильно адсорбирующего кислород. Через внутреннюю полость такого катода подается кислород или воздух. При катодной плотности тока 500 а/м 2 , напряжении от 2 до 3 в и 5° С можно получать 5% раствор Н202 с выходом по току
Непосредственное получение значительных количеств перекиси водорода на аноде по реакции или в щелочной среде по реакции 2ОН — — 2е → Н2О2 не удается. Это происходит, по-видимому, потому, что на платиновом аноде идет интенсивное каталитическое разложение перекиси водорода.
Промышленное значение процесс анодного окисления получил только после того, как было установлено, что некоторые производные перекиси водорода, такие как надсерная кислота или пер сульфат аммония, значительно устойчивее в контакте с платино вым анодом, чем перекись водорода.
Существует три промышленных способа косвенного получения перекиси водорода, разработанных в Австрии и Германии. По способу Тейхнера (1905 г.) электролизом серной кислоты получают надсерную кислоту и затем ее разложением — перекись водорода. По способу Питча и Адольфа (1910 г.) электролизу подвергают кислый раствор бисульфата аммония и получают персульфат аммония. Затем его переводят в труднорастворимый персульфат калия, который отделяют от раствора. Перекись водорода получают разложением персульфата калия.
Риделю и Левенштейну в 1927—1930 гг. удалось преодолеть трудности непосредственного получения перекиси водорода из персульфата аммония и создать процесс по схеме — электролиз бисульфата аммония и разложение персульфата аммония на перекись водорода.
Электролитическое получение надсерной кислоты

Непосредственный разряд ионов SO 2- 4 с образованием SO — 4 ионов и дальнейшей их димеризацией.
Рис. 2. а — Относительное содержание:
Образование надсерной кислоты как вторичный процесс окисления серной кислоты перекисью водорода, образовавшейся электрохимически на аноде (Глесстон и Хиклинг):
Вторичное образование надсерной кислоты за счет окисления серной кислоты атомарным кислородом, образующимся на аноде:
Механизм образования надсерной кислоты, предложенный Глесстоном и Хиклингом, следует признать маловероятным, так как в сильнокислых растворах, применяемых при электролизе и дающих наиболее высокие выходы надсерной кислоты, активность
воды резко понижена и разряд молекул воды в значительных количествах едва ли возможен. Кроме того, платиновые аноды, которые только и применяются в ванных, являются очень сильными катализаторами распада перекиси водорода.
Образование надсерной кислоты в условиях электролиза за счет атомарного кислорода, по-видимому, также не имеет места. Опытами А. Н. Фрумкина и сотрудников по электролизу раствора сульфата калия в воде, обогащенной тяжелым изотопом кислорода О 18 , было показано, что после электролиза образовавшийся персульфат калия не обогащается тяжелым изо разных концентраций; б — Зависимость активности воды и удельной электропроводности раствора H2SО4 от концентрации H2SО4.
Наоборот, если вести электролиз сульфата калия, обогащенного изотопом О 18 в обычной воде, то в персульфате калия обнаруживается изотоп О 18 . Это свидетельствует о том, что на аноде вероятнее всего происходит реакция непосредственного разряда анионов серной кислоты. К таким же выводам пришли Н. А. Изгарышев, А. И. Бродский, Брайтер, Цу Юн-Цао с сотрудниками.
Эта диаграмма, полученная с помощью метода спектров комбинационного рассеяния света, показывает, что в разбавленных растворах серной кислоты, в основном, диссоциация происходит с образованием ионов SO 2- 4 . По мере повышения концентрации равновесие резко сдвигается в сторону ионов HSO — 4 . Так, уже при 2—2,5 моль/л серной кислоты концентрация SO 2- 4 оказывается
5%, примерна столько же в растворе недиссоциированных молекул, а остальное приходится на HSO — 4 Образование надсерной кислоты происходит только при высокой концентрации серной кислоты, когда концен трация SO 2- 4 становится уже очень малой. На рис. 2 область концентраций, наиболее благоприятных для получения надсерной кислоты, заштрихована. Следовательно, вероятно, что в образовании надсерной кислоты, при электролизе серной кислоты участвуют ионы HSO — 4.
Равновесный потенциал реакции
Вероятность протекания реакции образования персульфата тем больше, чем меньше положительное значение примет равновесный потенциал. Из уравнения (выше) видно, что это произойдет при максимальном увеличении концентраций HSO — 4 т. е. в интервале концентраций серной кислоты 5—7 н. Этот интервал является оптимальным для получения надсерной кислоты, что подтверждает предположение об участии HSO — 4 в электродном процессе.
На аноде наряду с образованием надсерной кислоты возможен разряд молекул воды, приводящий к выделению кислорода.
Судя по значению стандартных потенциалов, на аноде в первую очередь и исключительно должен идти процесс выделения кислорода. Для максимального подавления этого процесса следует вести электролиз из концентрированных растворов кислоты, в которых; максимально возможно снижена активность воды и повышена кислотность (рис. 2, б) и, следовательно, равновесный потенциал сдвинут в электроположительную сторону. Одним сдвигом равновесного потенциала не удается добиться преимущественного проте кания реакции образования S2O 2- 8 . Необходимо еще выбрать материал анода, на котором перенапряжение выделения кислорода было бы возможно большим.
Таким материалом является гладкая платина. Выделение кислорода на гладкой платине в концентрированной серной кислоте сопровождается окислением поверхности платины — образованием поверхностных, и фазовых окислов, что видно из изменения анодного потенциала.
Состав окисных соединений платины, образующихся при разных потенциалах, различен. В области выделения кислорода на аноде образуются низшие окислы платины. При высоких потенциалах и концентрациях серной кислоты получаются окисные соединения иного характера, богатые кислородом и с большой энергией связи металл — кислород.
На электроде, покрытом такого рода окислами, перенапряжение выделения кислорода резко повышено, что благоприятствует протеканию реакции образования S2O 2- 8.
Предположение о разной природе поверхностных окислов подтверждается измерениями емкости двойного слоя на электродах, длительно работавших анодно при низких потенциалах и при высоких потенциалах в условиях получения надсерной кислоты. Действительно, кривые емкости 1 и 2 резко различны. На правой ветви кривой 1 имеется характерный пик десорбции, свидетельствующий о восстановлении адсорбированного кислорода. На кривой 2 такого пика практически нет, т. е. десорбция кислорода при этих потенциалах не происходит и, следовательно, прочность связи металл — кислород велика. Подъем в анодной области на кривой 2 начинается при потенциалах почти на 0,5 в более положительных, чем на кривой 1. Это непосредственно доказывает наличие торможений для реакции выделения кислорода на высших окислах платины.
Таким образом, условия, благоприятствующие получению надсерной кислоты, следующие: высокая концентрация серной кислоты, низкая температура и высокая плотность тока, материал анода с высоким перенапряжением выделения кислорода. На катоде надсерная кислота легко восстанавливается, поэтому необходимо отделять анодное пространство от катодного диафрагмой.
Исследования показали, что наивысшие выходы по току получаются при электролизе растворов серной кислоты с плотностью 1,3—1,45 г/см 3 (содержащих соответственно 510—800 г/л H 2SО4). Применение растворов с плотностью 1,3—1,35 г/см 3 наиболее целесообразно, так как при дальнейшем увеличении концентрации (в указанных пределах) выходы по току остаются практически неизменными, а удельная электропроводность электролита падает (рис. 2).
Существенным фактором, влияющим на ход электролиза, является анодная плотность тока. Наивысшие выходы по току получаются при анодной плотности тока 5000—10000 а/м 2 , на практике чаще применяют—6000—7000 а/м 2 . Более высокие анодные плотности тока существенно не улучшают выход по току, но в то же время способствуют повышению напряжения на ванне. Что касается катодных плотностей тока, то желательно в пределах конструктивных возможностей работать с пониженными плотностями тока. Обычно катодная плотность тока находится в пределах 500— 600 а/м 2 . Материалом для анодов, при всех вариантах электролитического получения надсернокислых соединений, является платина. С целью экономии платины применяют тонкую фольгу (толщиной 0,05 мм) или проволоку, а также комбинированные аноды из тантала или титана (пассивного при анодной поляризации) с приваренными к нему листочками платины (комбинированные аноды позволяют применять более тонкие платиновые листочки).
Проводились исследовательские работы по замене платиновых анодов на аноды из электролитически осажденной РbO2, но достаточно надежных результатов не получено. В качестве материалов для катодов применяют свинец и графит. Свинец более удобен в конструктивном отношении, но на графите более низкое перенапряжение для водорода, что позволяет снизить напряжение на ванне на 0,3—0,4 в.
Получение перекиси водорода из надсерной кислоты и персульфата аммония
Электролит, вытекающий из ванн так называемый анолит,— подается в гидролизное отделение для выделения перекиси водорода.
Разложение надсерной кислоты и выделение из нее перекиси водорода осуществляется нагреванием раствора. При этом полезными являются как раз те реакции, которые приводили к наибольшим потерям тока и электролизных ваннах. При нагревании раствора надсерной кислоты идут реакции гидролиза.
Для уменьшения потерь необходимо с наибольшей возможной скоростью вести процесс и быстро удалять нары образовавшейся перекиси водорода. Применение вакуума позволяет вести гидролиз при более низкой температуре и уменьшить благодаря этому потери активного кислорода. Использование чистых растворов и соблюдение правильного режима гидролиза позволяет вести этот процесс с выходом 75—80% от теоретического. С увеличением концентрации H2S 2О8 в растворе выход перекиси водорода возрастает.
Гидролиз протекает при остаточном давлении 110— 140 мм. рт. ст. Пары воды и перекиси водорода отделяются в сепараторе от раствора серной кислоты и конденсируются в виде 30% раствора Н2О2 в фарфоровых колоннах. Серная кислота частично, с целью очистки, подается в кварцевые дистилляционные аппараты. Остальная часть серной кислоты разбавляется водой до необходимой (исходной) концентрации и возвращается на электролиз.
Процесс осуществляют в свинцовом трубчатом гидролизере, имеющем форму змеевика, обогреваемого паром, либо в трубчатых аппаратах с трубками из стекла «пирекс», при больших масштабах производства используют аппараты типа «труба в трубе» . Поверхности аппарата, соприкасающиеся с рабочим раствором, покрыты кислотоупорной эмалью.
Гидролизер представляет собой вертикальный стальной сварной аппарат, состоящий из отдельных царг, снабженных паровыми рубашками. Внутрь аппарата вставляется стакан, который крепится к верхней крышке. Обогрев осуществляется паром давлением 6 ата, поступающим как в паровую рубашку, так и во внутренний стакан. Поверхность эмалирования 8,5 м 2 , высота 3085 мм. Электролит, содержащий надсерную кислоту, подают снизу. Пары перекиси водорода и воды вместе с серной кислотой отсасываются сверху.
Гидролиз растворов персульфата аммония ведут при 105— 115° С и остаточном давлении 50 мм рт. ст. Первая ступень гидролиза происходит в двух параллельно работающих гидролизерах; после разделения паровой и жидкой фаз раствор дополнительно проходит через гидролизер второй ступени.
Пары перекиси водорода и. воды конденсируют в конденсационных колоннах. Так как перекись водорода обладает меньшим давлением насыщенного пара, чем вода, то при частичной конденсации паров перекиси водорода и воды конденсат будет обогащен перекисью водорода, а паровая фаза — водой. Поэтому в первой конденсационной колонне удается получить наиболее концентрированный раствор Н 2О2 (30—25% ). Паровая смесь, выходящая из первой колонны и содержащая еще значительные количества перекиси водорода, конденсируется во второй колонне, где получается более разбавленный раствор перекиси водорода. При необходимости включают третью колонну, в которой происходит улавливание последних остатков перекиси водорода и получаются ее разбавленные растворы,
Хранение перекиси водорода
Получаемая электролизом 30—35%-ная перекись водорода либо является конечным продуктом, либо поступает на дальнейшее концентрирование («укрепление»).
«Укрепление» перекиси водорода, т. е. превращение 30—35% раствора Н2О2 в продукт, содержащий 85—95% Н2О2, осуществляют перегонкой в специальных ректификационных аппаратах при 66—77° С и остаточном давлении 55 мм рт. ст. Устойчивость растворов перекиси водорода сильно уменьшается при наличии примесей. Следы платины, железа, меди, марганца, свинца (в виде ионов) и многих других веществ ускоряют процесс разложения. Совершенно чистая 90%-ная Н2О2 при 30°С теряет за год около 0,5% активного кислорода, т. е. является вполне стойким продуктом.
Устойчивость реальных растворов перекиси водорода значительно ниже, так как трудно достичь идеальных условий для обеспечения высшей чистоты продукта. Для обеспечения приемлемой стабильности перекиси водорода и получения высоких выходов при электролизе и гидролизе необходимо обеспечение определенных условий. Конструкционные материалы не должны сами каталитически ускорять процесс разложения перекиси и не должны загрязнять электролит веществами, способными вызывать каталитическое разложение. Исходные продукты, применяемые в процессе, должны быть тщательно очищены — вода и серная кислота—дистилляцией, соли — перекристаллизацией и т. д.
Несмотря на все принимаемые меры, перекись водорода, полученная в производственных условиях, разлагается с заметной скоростью. Чтобы повысить стойкость Н 2О2, добавляют в растворы различные стабилизирующие вещества, например, 0,5 г/л Na 4P 2О7 • 10Н2О и 0,4 г/л салициловой кислоты. Для этой цели используют также фосфорную и бензойную кислоты, 8-оксихинолин и др.
Скорость разложения перекиси водорода возрастает с повышением температуры.
Растворы перекиси водорода хранят в алюминиевой таре. Алюминий— наилучший материал, практически инертный в отношении процесса разложения перекиси водорода и коррозионно-стойкий в растворах ее любой концентрации. Наличие в растворах перекиси водорода ничтожных количеств хлора вызывает интенсивную коррозию алюминия. Однако это явление можно полностью уничтожить введением в раствор ингибитора — нитрата аммония. Количество ингибитора, необходимого для подавления, коррозии, зависит от концентрации хлора в растворе. Сосуды для хранения растворов перекиси водорода должны иметь выход для выделяющегося при разложении кислорода.
С 85—95% -ной Н2О2 следует обращаться с большой осторожно стью. Недопустимо соприкосновение ее с органическими вещества ми. Необходим тщательный надзор при ее хранении, так как возможно самопроизвольное разложение со взрывом.
Получение перекиси водорода через персульфат калия
Способ получения перекиси водорода через персульфат калия отличается от других способов тем, что из цикла электролиза выводится твердый продукт K2S2О8. При кристаллизации персульфата калия практически все примеси остаются в электролите. Твердый продукт оказывается весьма чистым и дальнейшее разложение его происходит с высоким выходом перекиси водорода. Электролит же для получения персульфата калия может содержать несколько большие количества примесей, чем в остальных двух способах.
Другой отличительной чертой способа является применение электролизеров без разделения анодного и катодного пространств диафрагмами. Необходимость применения таких ванн (одно растворные ванны) обусловлена тем, что электролит после выделе ния K2S2O8 содержит еще значительные концентрации S2O 2- 8 Если такой электролит направлять в катодные пространства диафраг менных ванн, то все ионы S2O8 будут восстановлены и произойдет значительная потеря перекисного кислорода. Если же оборот ный электролит подавать в анодные ячейки, то тогда нужно организовывать специальную ветвь циркулирующего электролита, который проходит только через катодные пространства ванн. Оборачивание же электролита в простой схеме с бездиафрагменными ваннами затруднений не вызывает.
В бездиафрагменных ваннах для подавления процесса катодного восстановления персульфата аммония графитовые катоды, в виде круглых стержней, снабжаются защитной обмоткой — шнуром из кислотостойкого асбеста. Анод представляет собой алюминиевый гуммированный стержень с платиновыми штырьками, на которых натянут пучок платиновых проволок.
Для охлаждения ванна имеет стеклянные холодильники. Температура электролита 35—38° С. Объемная плотность тока 12—17 а /л. Напряжение на ванне 5,5—6,5 в, нагрузка 4500а. Кор пус ванны керамический размерами 950x700x950 мм.
Электролизные ванны расположены каскадом и раствор в них последовательно поступает из одной в другую. Последовательно соединяются одиннадцать ванн, из которых одна резервная.
Электролит (оборотный) поступает в верхнюю ванну каскада. Он содержит 275—300 г/л (NH4)2SО4, 70—90 г/л H2SО4, 40 г/л K2SO4 и 75—80 г/л (NH4)2S2О8. В результате электролиза концен трация персульфата аммония повышается до 160—170 г/л. Средний выход по току составляет около 85%. Электролит, вытекающий из нижней ванны каскада, проходит через фильтр и охлаждается в вакуумном холодильнике. После охлаждения электролит поступает в бак, в котором проводят конверсию при температуре около 15° С. В этот реактор на каждый литр раствора вводят 100—110 г KHSO4. В результате обменной реакции образуется персульфат калия, который выпадает в осадок. Таким образом, удается вывести из цикла около 50% перекисного кислорода.
Персульфат калия отделяют на центрифуге, а раствор корректируют и, после добавления NH4SCN (0,1 мг/л) возвращают на электролиз. Гидролиз твердого K2S2O8 проводится периодически в специальном аппарате с добавлением серной кислоты. Образующийся при гидролизе бисульфат калия используют при конверсии персульфата аммония.
250 г/л) расход пара находится в пределах 28—29 кг/кг Н2О2. Наивысший расход пара, достигающий 40 кг/кг Н2О2, происходит при гидролизе растворов персульфата аммония (
Способ получения перекиси водорода гидролизом К2S2О8 более сложен в аппаратурном оформлении. При организации производства перекиси водорода через H2S2O8 необходимо располагать достаточным количеством охлаждающей воды с температурой 7— 8° С, что может потребовать в летнее время наличия холодильной установки.
В способе с персульфатом калия можно допустить работу с несколько более загрязненным электролитом, так как при осаждении персульфата калия все примеси остаются в растворе, а в твердую фазу переходит чистый продукт. Таким образом, при гидролизе получается высокий выход, достигающий 91%. Несмотря на это, сложность аппаратурного оформления процесса и большое число операций в схеме делают метод получения перекиси водорода через персульфат калия малоперспективным.
Статья на тему Производство перекиси водорода
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Пероксид водорода — строение, формула и основные свойства
Строение молекулы и физические свойства
Перекись водорода относится к простейшим представителям группы пероксидов. Её получают в промышленности и лаборатории несколькими способами. Структурная формула перекиси водорода обозначается H2O2. Степень окисления у атомов кислорода -1.
Молекула вещества представлена двумя OH-группами, которые связаны пероксидным -О-О-мостиком и лежат в разных плоскостях. Угол между ними меняется в зависимости от температуры, концентрации раствора и других условий.
Пероксид представлен в виде бесцветной жидкости с «металлическим» вкусом и специфическим запахом. Вязкая консистенция обусловлена развитой системой водородных связей в молекулярной структуре.
Основные физические свойства перекиси водорода:
- Температура кипения: 150,2°C.
- Температура замерзания: -0,432°C.
- Плотность: 1,46 г/см3.
Молекула вещества является полярной, поскольку её строение несимметричное. Соединение может неограниченно растворяться в воде, эфире и спирте. Чистое вещество неустойчиво и способно самопроизвольно разлагаться со взрывом.
Химические особенности
Поскольку оба атома кислорода находятся в промежуточной степени окисления -1, антисептическое средство может проявлять как окислительные, так и восстановительные свойства. Оно участвует в реакциях окисления нитритов до нитратов и выделении иодов из иодидов металлов. Также вещество может расщеплять ненасыщенные соединения.
Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
Вещество по степени кислотности немного сильнее H2O. Некоторые пероксиды металлов можно рассматривать как его соли. В кислой среде перекись служит окислителем, а в щелочной — восстановителем.
Реагируя с более сильными окислителями, например, с солями серебра и золота, водород служит восстановителем и окисляется до атомарного кислорода. В реакции с нитритом калия вещество выступает окислителем. Если молекула принимает электрон на внешний уровень, тогда степень окисления кислорода меняется на -2; если она его отдаёт, тогда соединение становится восстановителем. Окисление органических веществ пероксидом обычно проводят в уксусной кислоте.
Способы получения вещества
Сначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в H2SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота.
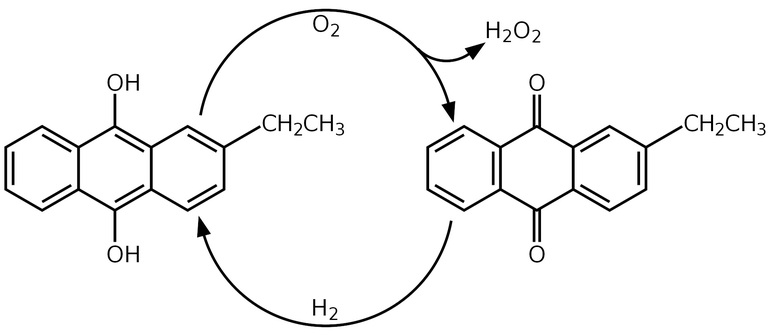
В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении.
В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+H2O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта.
В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта.
Меры предосторожности
Во время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов.
Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Упаковку с аптечным средством необходимо хранить в тёмном месте. При транспортировке нужно избегать встряхивания вещества и других механических воздействий, которые могут привести к его разложению.
Сферы использования
Пероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
- Вещество применяется при создании бумаги, дезинфицирующих средств и в текстильном производстве в качестве отбеливателя.
- За окислительные свойства пероксид водорода используют как ракетное топливо.
- В аналитической химии при изготовлении пористых материалов средство применяют в качестве пенообразователя.
- В промышленности простейший представитель пероксидов зарекомендовал себя как катализатор и гидрирующий агент.
- В аквариумистике 3%-й раствор помогает очистить резервуары для воды, бороться с паразитами, а также способен оживить задохнувшихся рыб.
- В пищевой промышленности пероксид используется для дезинфекции упаковок для различных напитков и поверхностей оборудования, с которым контактируют продукты.
- В сфере быта средство помогает вывести пятна марганцовки на предметах мебели и текстиле, а также в качестве домашнего антисептика.
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином.
Применение в области медицины
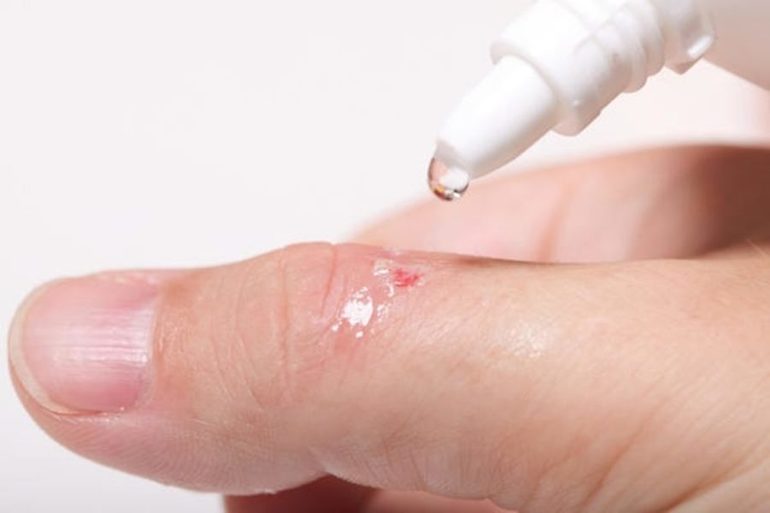
Широкое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству.
Формы выпуска пероксида водорода:
- Раствор разведённый 1−3%. Применяется для полоскания полости рта и в качестве препарата местного действия.
- Раствор концентрированный 27−31%. Это средство используется редко и только по назначению специалиста. Обычно для обработок его разводят до 3%-го раствора. Лекарство предназначено для лечения заболеваний кожного покрова.
- Гидроперит. Лекарство представлено соединением 35%-го раствора пероксида с карбамидом. Выпускается в форме таблеток. В таком виде препарат легче перевозить и хранить. Чтобы сделать раствор, необходимо растворить в воде 2 таблетки на 100 мл жидкости.
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий.
При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором.
Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий.
http://znaesh-kak.com/x/e/%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%B2%D0%BE%D0%B4%D1%81%D1%82%D0%B2%D0%BE-%D0%BF%D0%B5%D1%80%D0%B5%D0%BA%D0%B8%D1%81%D0%B8-%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%B0
http://nauka.club/khimiya/peroksid-vodoroda.html