Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1da42c4f4300a5 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
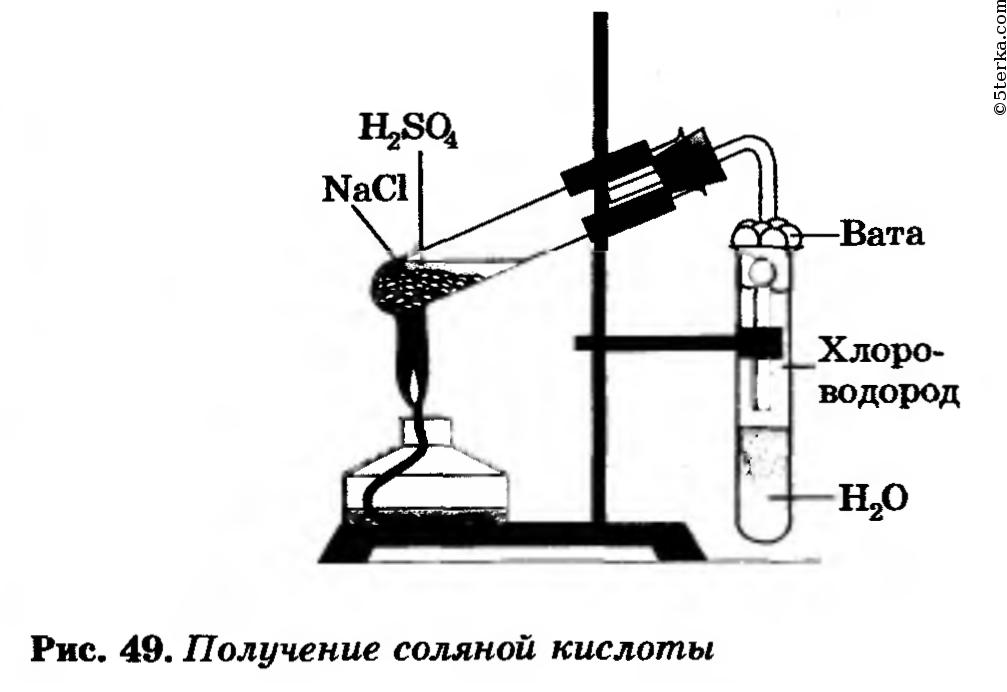
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
Fe + 2HCl = FeCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Практическая работа № 5(c). Получение соляной кислоты и изучение ее свойств
Получение соляной кислоты
Соберите прибор, как показано на рисунке 49.
В пробирку насыпьте 2—3 г хлорида натрия и прилейте столько концентрированной серной кислоты (2:1), чтобы она смочила всю соль. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с водой так, чтобы он был примерно на расстоянии 0,5—1 см от поверхности воды. Затем смесь в первой пробирке осторожно нагревайте в течение 5—6 мин (следите, чтобы кислоту не перебросило во вторую пробирку с водой!).
1. Напишите уравнения химических реакций, протекающих между концентрированной серной кислотой и хлоридом натрия при обычных условиях и при сильном нагревании.
2. Чем вызвано появление во второй пробирке тонких опускающихся вниз струек?
3. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды?
Изучение свойств соляной кислоты
Полученную соляную кислоту разлейте поровну в шесть пробирок. В первую пробирку опустите лакмусовую бумажку. Во вторую пробирку положите кусочек цинка или магниевые стружки, а в третью — кусочек меди. В четвертую пробирку внесите немного оксида меди(П) и нагрейте раствор. В пятую пробирку поместите немного свежеприготовленного гидроксида меди(П), в шестую — немного мела или другого карбоната.
1. Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций, протекающих между соляной кислотой и указанными металлами.
2. Как объяснить образование в четвертой и пятой пробирках растворов синего цвета, а в шестой — выделение газа? Составьте уравнения соответствующих реакций.
3. Проведите реакции по распознаванию соляной кислоты и ее солей. Для этого в одну пробирку налейте 1—2 мл разбавленной соляной кислоты, во вторую — столько же раствора хлорида натрия, а в третью — раствор хлорида кальция. Во все пробирки добавьте по нескольку капель раствора нитрата серебра. Проверьте, растворяется ли выпавший осадок в концентрированной азотной кислоте.
Напишите уравнения проведенных вами реакций и укажите, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей, в) растворы хлоридов от соляной кислоты.
Почему вместо раствора нитрата серебра(1) можно также использовать раствор нитрата свинца(П)?
Ответы:
Получение соляной кислоты (HCl):
Изучение свойств соляной кислоты:
Для изучения свойств соляной кислоты проведем несколько характерных для нее реакций.

задача №5
к главе «Практические работы».
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-19-%D1%81%D0%BE%D0%BB%D1%8F%D0%BD%D0%B0%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0-%D0%B8-%D0%B5%D1%91-%D1%81%D0%BE%D0%BB%D0%B8
http://5terka.com/node/10692