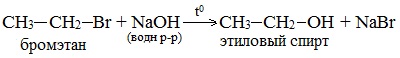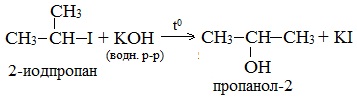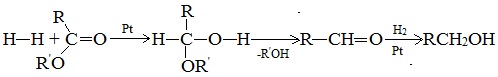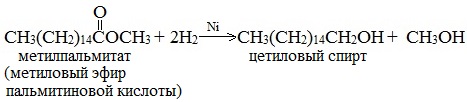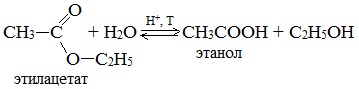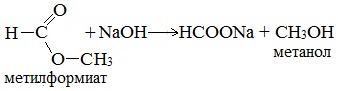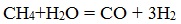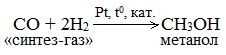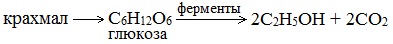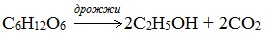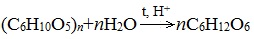Получение спирта из алкена уравнение
К наиболее часто используемым химическим способам получения спиртов относятся:
1.Гидратация алкенов (промышленный способ получения этанола для технических целей)
(t, Р, кислая среда (катализатор))
2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
3.Восстановление альдегидов и кетонов (лабораторный способ получения)
(t, катализатор –Ni)
Особые способы получения метанола и этанола
1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
2.Получение этанола ферментативным брожением глюкозы (получение этилового спирта для пищевых и медицинских целей)
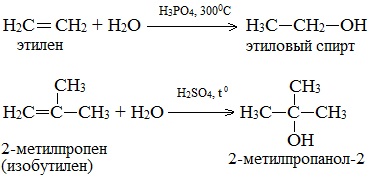
1. Гидратация алкенов
Гидратация алкенов используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение воды к алкенам происходит в присутствии разбавленной серной или фосфорной кислот. Эта реакция протекает в соответствии с правилом Марковникова, поэтому первичный спирт можно получить только из этилена, а остальные алкены дают вторичные или третичные спирты:
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
2. Гидролиз галогеналканов в водном растворе щелочи
В лабораторных условиях спирты получают действием водного раствора щелочи на алкилгалогениды при нагревании, при этом атом галогена в галогеналкане замещается группой –ОН:
С помощью этой реакции можно получать первичные, вторичные и третичные спирты.
При действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена.
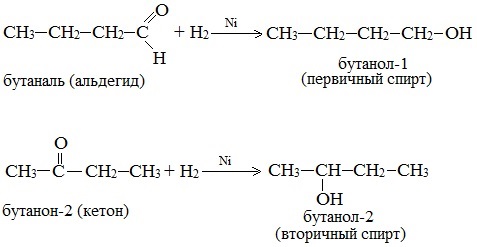
3. Восстановление карбонильных соединений (альдегидов и кетонов)
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов, кетонов и эфиров карбоновых кислот – является, таким образом, их восстановлением.
При действии водорода в присутствии катализаторов (Ni, Pt, Pd) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов:
4. Восстановление эфиров карбоновых кислот
Гидрирование сложных эфиров проходит через стадию образования альдегидов:
Этим методом в промышленности из метиловых эфиров высших кислот получают высшие первичные спирты, например:
5. Гидролиз сложных эфиров карбоновых кислот в щелочной среде
Гидролиз сложных эфиров карбоновых кислот протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2, Ba (OH)2, Ca (OH)2). Однако к образованию спиртов приводит гидролиз, протекающий необратимо в щелочной среде:
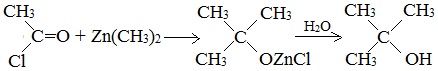
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Этим способом можно получать как первичные спирты, так и вторичные и третичные:
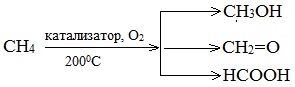
7. Окисление алканов
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов образуются метанол, формальдегид или муравьиная кислота:
Специфические способы получения метанола и этанола
Производство метанола крупнотоннажное, т.к. метиловый спирт является исходным веществом для получения других продуктов органического синтеза.
В промышленности
1. Получение метанола из синтез-газа (водяной газ, генераторный газ)
а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома, температуру поддерживают в интервале 200-300 о С, а давление – от 40 до 150 атм.
Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
Ранее метанол получали сухой перегонкой древесины без доступа воздуха (отсюда его название «древесный спирт»).
2. Получение этанола спиртовым брожением глюкозы
Ферментативный гидролиз крахмала – наиболее древний синтетический процесс, используемый человеком – до сих пор имеет огромное значение для получения этилового спирта.
Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные опилки):
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Получение спиртов. ПрименениеПолучение спиртов I. В промышленности 1. Из водяного газа (получение метанола – древесный спирт) 2. Брожение глюкозы (получение этанола) C 6 H 12 O 6 дрожжи → 2C 2 H 5 OH + 2CO 2 3. Гидратация алкенов II. В лаборатории Взаимодействие галогеналканов R-Г с водными растворами щелочей CH 3 Cl + NaOH t, водн.р-р.→ CH 3 OH + NaCl (р. обмен) ПРИМЕНЕНИЕ Метанол СН 3 ОН – используют как растворитель, в производстве муравьиной кислоты, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл. Этанол С 2 Н 5 ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство. источники: http://acetyl.ru/f/o264.php http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/10-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D1%82%D1%80%D0%B5%D1%82%D0%B8%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D0%BF%D0%BE%D0%BB%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D0%B5-%D1%81%D0%BF%D0%B8%D1%80%D1%82%D0%BE%D0%B2-%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5 |