Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
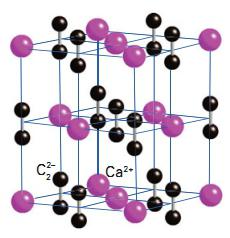
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Карбид кальция: свойства и применение. Получение ацетиленаКарбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже. История полученияКарбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом: Физические свойстваПо своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 о С. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого. Химические свойстваКарбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой. ПолучениеПроизводство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 о С. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии. Транспортировка и хранениеПо причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода. ПрименениеОбласть применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы. Производство ацетиленаОдной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓. На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер. Лабораторный опыт получения ацетиленаМногим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот. Способ получения карбида кальцияИзобретение предназначено для химической промышленности и может быть использовано при получении ацетилена и выплавке стали. Коксозольный остаток термической переработки окисленных бурых углей состава, маc.%: CaO — 47,5, C — 35,4, Fe2O3 — 6,6, SiO2 — 5,0, Mg — 3,3, Al2O3 — 1,6, S — 0,1, остальное — 0,5 смешивают с 12,9 — 28,3% от массы смеси карбоната кальция в виде известняка, подвергают высокотемпературной плавке при 2000-2100 o С, охлаждают, разделяют CaC2 и ферросилиций. Способ не требует дорогостоящих продуктов, литраж CaC2 275-285 л/кг, содержание ферросилиция 0,1-0,2 мас.%. 1 з.п.ф-лы. Изобретение относится к химической технологии, в частности к получению карбида кальция. Известен способ получения карбида кальция /Кузнецов Л.А. Производство карбида кальция. М., 1954, с. 32, 33/, включающий плавление шихты, состоящей из извести и углерода, при этом к свежей извести добавляют до 30% термически переработанного отхода производства — шлама «сухих» ацетиленовых генераторов, являющегося источником оксида кальция, кремния и железа, что снижает себестоимость карбида кальция и улучшает экологическую обстановку, так как часть вредных отходов, идущих на свалки, перерабатывается. Недостатком известного способа является использование дорогостоящих продуктов /металлургического кокса, антрацита, обожженной извести/ в составе основной шихты /70%/, а также затраты антрацита, электроэнергии, пара при термопереработке шлама. Известен способ получения карбида кальция /авторское свидетельство СССР N 664476, C 01 B 31/32, кл. C 01 B, 1976/, путем электротермической плавки извести и углеродистого восстановителя с периодической подачей корректирующего материала, в качестве которого используют коксозольный остаток термической переработки карбонатсодержащих горючих сланцев в количестве до 10% от веса шихты, при этом коксозольный остаток является источником оксидов кальция /24,0 — 31,0%/, кремния /14 — 20%/, железа /2,3 — 3,5%/ и углеродистого восстановителя /16 — 18%/. Это снижает себестоимость карбида кальция, повышает содержание основного вещества в продукте и позволяет использовать отходы производства /коксозольный остаток/. Недостатком известного способа является расход дорогостоящих продуктов /электродного графита, обожженной извести/ в основной части шихты /90 — 99%/. Известен способ получения карбида кальция /авторское свидетельство СССР N 1168508, кл. C 01 B 31/32, 1983/, включающий плавление шихты, состоящей из извести и углерода, охлаждение плава и разделение продуктов реакции — карбида кальция и ферросилиция, при этом плавление шихты ведут в присутствии известняка или сланцевого кокса зольного в количестве 12,9 — 28,3% от массы шихты. Для корректировки соотношения кремния к железу в шихте вводят недостающее количество железа в виде стружки, обеспечивающее весовое соотношение кремния к железу 1: 2, получая при этом карбид кальция со знаком качества /литраж ацетилена — до 300 л/кг карбида/. Недостатком известного способа является использование дорогостоящих продуктов в основном составе шихты /извести и углеродистого материала/. В основу изобретения положена задача получения карбида кальция с использованием отходов угледобывающей промышленности в основном составе шихты, что снижает себестоимость карбида кальция и улучшает экологическую обстановку за счет переработки отвалов. Поставленная задача решается тем, что в способе получения карбида кальция, включающем плавление шихты из материала, содержащего оксиды кальция, кремния, железа и углерод, охлаждение плава и разделение продуктов реакции — карбида кальция и ферросилиция, при этом плавление шихты ведут в присутствии известняка в количестве 12,9 — 28,3% от массы шихты, согласно изобретению в качестве указанного материала используют отходы угледобычи, в частности коксозольный остаток термической переработки окисленных бурых углей состава, мас.%: окись кальция 47,5; углерод 35,4; окись железа 6,6; окись кремния 5,0; окись магния 3,3; окись алюминия 1,6; сера 0,1; фосфор — следы, остальное 0,5. Использование отходов угледобычи — коксозольного остатка термической переработки окисленных бурых углей с усредненным составом, приведенным выше, позволяет снизить себестоимость карбида кальция, так как эти отходы перевозят в отвалы, занимая при этом пахотные земли. В настоящее время под отвалами только в Канско-ачинском угольном бассейне находится 6000 га пахотных земель, дающих до этого урожай зерновых по 25 ц с гектара /Гаврилин К.В., А.Ю. Озерский. Канско-ачинский угольный бассейн. М.: Недра, 1996, с. 93, 152, 154/, при этом сырьевая база только по Березовскому разрезу Кабасса составляет 1 млрд. тонн забалансовых углей с высоким содержанием окиси кальция в коксозольном остатке /до 50%/. Получение карбида кальция из отходов угледобычи снижает его себестоимость на 30%, так как сырьевая составляющая себестоимости составляет до 1/3 стоимости карбида кальция (Производство карбида кальция в СССР и за рубежом. Серия «Производство фосфора и карбида кальция». -М.: НИИТЭХИМ, 1973). При этом термическая переработка отходов не требует дорогостоящих продуктов /антрацита, пара, электроэнергии/, так как коксозольный остаток термической переработки окисленных бурых углей является продуктом неполного их сгорания с использованием тепловой энергии этого процесса. Готовят шихту из коксозольного остатка термической переработки окисленных бурых углей состава, мас.%: окись кальция 47,5; углерод 35,4; окись железа 6,6; окись кремния 5,0; окись магния 3,3; окись алюминия 1,6; сера 0,1; остальное 0,5; /фосфора — следы/. Весовое соотношение кремния к железу в шихте равно 1:2. Средняя крупность частиц шихты 2 — 3 мм. Полученную шихту подвергают высокотемпературной плавке в графитовом тигле при 2000 — 2100 o C в течение 15 мин, затем плав охлаждают до комнатной температуры. Образующийся плав состоит из 96,5 мас.ч. карбида кальция /содержащего 75% CaC2/ и 3,5 мас.ч. ферросилиция в виде самостоятельных несмешивающихся фаз. Литраж карбида кальция составляет 275 л/кг. Содержание ферросилиция в карбиде кальция составляет 3,4%. Готовят шихты из коксозольного остатка термической переработки окисленных бурых углей /такого же состава, как в примере 1/ и вводят карбонат кальция в виде известняка /содержащего 96 — 98% CaCO3/ в количестве 12,9% от массы шихты. Крупность частиц смешиваемых компонентов 2 — 3 мм. Полученную шихту подвергают высокотемпературной плавке при 2000 — 2100 o C в течение 15 минут, затем плав охлаждают до комнатной температуры и разделяют продукты плавки. После разделения фаз образуется 93,3 мас.ч. карбида кальция и 6,7 мас. ч. ферросилиция. Литраж полученного карбида составляет 284 л/кг, при содержании в нем ферросилиция 0,2%. Готовят шихту из коксозольного остатка термической переработки окисленных бурых углей /такого же состава, как в примере 1/ и вводят карбонат кальция в виде известняка /содержащего CaCO3 96 — 98%/ в количестве 28,3% от массы шихты. Крупность частиц смешиваемых компонентов 2 — 3 мм. Полученную шихту подвергают высокотемпературной плавке при 2000 — 2100 o C в течение 15 минут, затем плав охлаждают до комнатной температуры и разделяют продукты плавки. После разделения фаз образуется 93,2 мас.ч. карбида кальция и 6,8 мас. ч. ферросилиция. Литраж полученного карбида составляет 285 л/кг, при содержании в нем ферросилиция 0,1%. Применение предлагаемого способа позволяет получить карбид высокого качества из отходов угледобычи, идущих в отвал. Ферросилиций также используется для раскисления сталей в черной металлургии. Наличие незначительных количеств серы и следов фосфора позволяет использовать промышленные печи для получения карбида этим способом, а неограниченная сырьевая база /17% от всего добываемого открытым способом бурого угля/ предполагает возможность крупнотоннажного производства, что исключает рост отвалов, так как отходы угледобычи могут перерабатываться в ценный продукт, себестоимость которого в настоящее время оценивается в 500 долларов за тонну и его не хватает. 1. Способ получения карбида кальция, включающий плавление шихты из материала, содержащего оксиды кальция, кремния, железа и углерод, охлаждение плава и разделение продуктов реакции — карбида кальция и ферросилиция, при этом плавление ведут в присутствии карбоната кальция в виде известняка в количестве 12,9 — 28,3% от массы шихты, отличающийся тем, что в качестве указанного материала используют коксозольный остаток термической переработки окисленных бурых углей. 2. Способ по п.1, отличающийся тем, что коксозольный остаток термической переработки окисленных бурых углей имеет следующий состав, мас.%: Окись кальция — 47,5 Углерод — 35,4 Окись железа — 6,6 Окись кремния — 5,0 Окись магния — 3,3 Окись алюминия — 1,6 Сера — 0,1 Остальное — 0,5 источники: http://www.syl.ru/article/150446/mod_karbid-kaltsiya-svoystva-i-primenenie-poluchenie-atsetilena http://findpatent.ru/patent/212/2129093.html |