Порядок реакции: понятие, виды
В химической кинетике одной из важных задач является нахождение порядка реакции. Хоть эта величина и формальная, но позволяет наилучшим образом отразить экспериментальную зависимость скорости какой-либо реакции от концентрации. Как правило, для нахождения скорости реакции используют концентрации исходных соединений, взятых в степенях, соответствующих их стехиометрическим коэффициентам. Но это справедливо лишь для очень простых реакций.
Порядком химической реакции по веществу является значение степени n, в которой концентрация этого соединения входит в формулу для нахождения скорости реакции, полученную опытным путем. А вот общий порядок составляет сумму всех порядков по веществам: n = n1 + n2. Значения n1 и n2 соответствуют стехиометрическим коэффициентам в уравнениях одностадийных реакций. Фактически, они могут иметь положительные или отрицательные значения, быть целыми или дробными числами.
Например, для уравнения взаимодействия H2+ Ι2 ― > 2HΙ, которому соответствует формула для определения скорости v=kCHCI, порядки по веществам равны nH=1 и nI=1, общий порядок реакции n=nH+nI=1+1=2.
Нулевой порядок
Некоторые реакции имеют нулевой порядок реакции. Как правило, на них не влияют концентрации исходных соединений. Происходит это в следующих случаях:
- если какое-либо исходное вещество взято в существенном избытке;
- если скорость регулируется энергией активации молекул, участвующих в реакции, например, в фотосинтезе.
В качестве примера рассмотрим реакцию взаимодействия этилуксусного эфира с водой, т.е. его омыления.
Поскольку взаимная растворимость исходных веществ крайне мала, то основная их масса находится в разных фазах. При расходовании эфира в химической реакции из эфирного слоя своевременно поступает новая его порция, то есть концентрация его в растворе не уменьшается.
Реакции первого порядка
Такое взаимодействие веществ можно условно записать уравнением: А―>В. Примером может послужить разложение диметилового эфира:
Для которого скорость реакции определяется как v=kCС2Н6О. В данном случае порядок по веществу и общий порядок совпадают и равны единице.
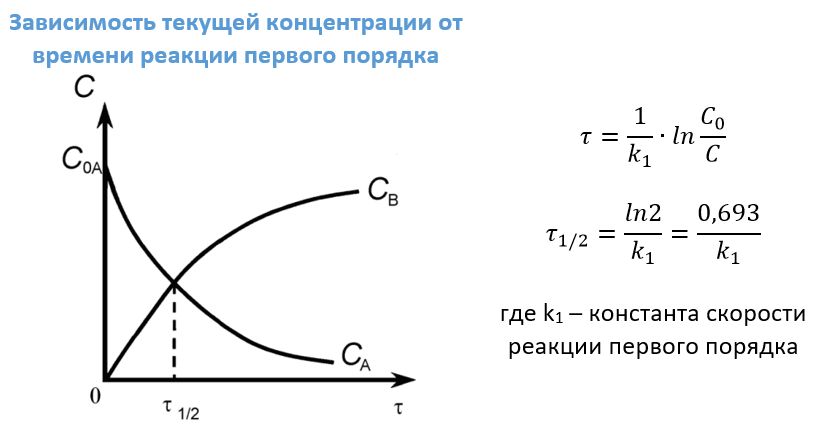
Практическое значение для реакций первого порядка имеет время (τ) определения некой заданной концентрации С, если известна начальная концентрация Со, а также период полураспада τ1/2, это время, в течение которого успевает прореагировать половина исходного вещества.
Реакции второго порядка
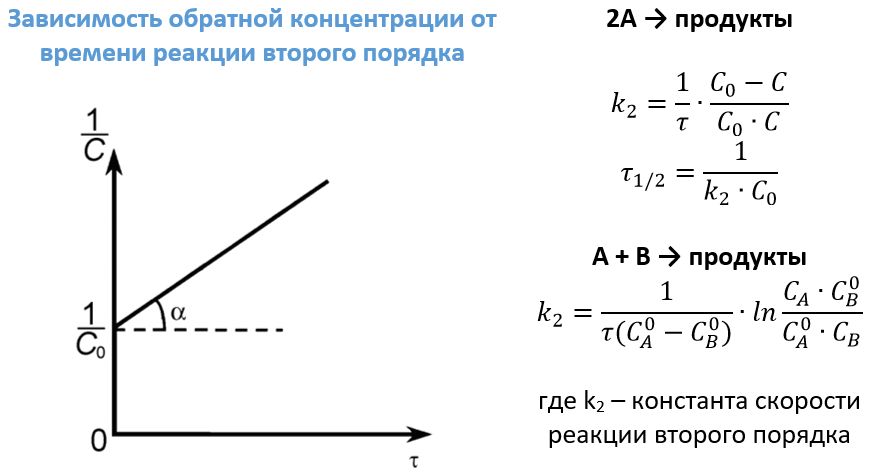
К таким взаимодействиям можно отнести реакции типа А + В ―> продукты. Примером может послужить уже приводимая выше реакция получения йодоводорода или щелочное омыление этилацетата:
Также (к) второй порядок имеют отдельные реакции разложения типа: 2А ―> продукты. В качестве примеров можно привести следующие:
Последующие реакции
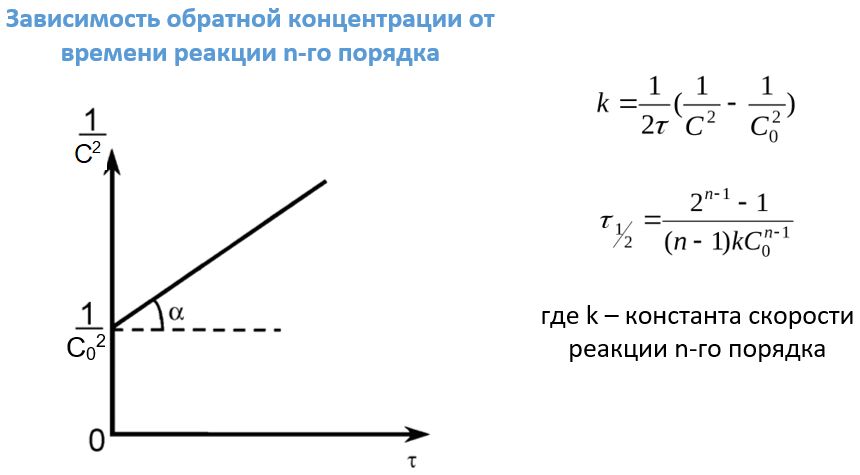
Реакции третьего и последующего порядков встречаются реже, чем предыдущие варианты. Это объясняется низкой вероятностью одновременной встречи в пространстве трех и более частиц. Тем не менее, примером таких взаимодействий может послужить образование диоксидов азота и углерода из их монооксидов:
Для таких реакций также существует своя зависимость концентраций реагентов от времени ее протекания. Формулы для нахождения периода полупревращения и констант скоростей реакций унифицированы за счет введения индекса n, равного порядку этих самых реакций.
Молекулярность реакции
Не нужно путать порядок реакции с ее молекулярностью, которая определяется именно числом молекул, которые совершают акт химического превращения. В отличие от порядка, который определяется экспериментально, молекулярность химической реакции имеет теоретическую основу. Для ее определения нужно понимать суть процесса, как именно взаимодействуют молекулы между собой, через какие стадии превращения они проходят.
| Порядок | Молекулярность |
| Формальная величина | Есть физический смысл, показывает число реагирующих молекул |
| Может принимать различные числовые значения | Принимает только одно из трех значений: 1,2,3 |
| Применяется к реакциям любой сложности и многостадийности | Применяется только к элементарным одностадийным реакциям |
Существует несколько причин, по которым не совпадает для одной и той же реакции порядок и молекулярность:
- если один из реагентов взят в большом избытке, о чем уже говорилось выше;
- для многих гетерогенных реакций порядок может изменяться в ходе их осуществления, особенно если при этом меняются условия их протекания;
- каталитические реакции имеют многостадийный механизм, суть которого не всегда отражается стехиометрическим уравнением;
- в сложных многостадийных реакциях на суммарное значение скорости может повлиять только одна из промежуточных, которая в результате и будет определять порядок всего превращения.
К мономолекулярным относят реакции распада молекул:
В бимолекулярных реакциях сталкиваются две молекулы. Причем это могут быть молекулы как разных веществ, так и одного и того же:
Тримолекулярными называют такие реакции, для осуществления которых нужны три молекулы исходных веществ:
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
ПОРЯДОК РЕАКЦИИ
Химические реакции редко протекают в одну стадию, как их принято записывать в учебниках химии. В обычной одностадийной записи уравнений химических реакций указывается только начальное и конечное состояние системы, что является, по существу символическим выражением материального баланса (закона сохранения вещества). В действительности реакция обычно протекает через ряд промежуточных стадий, причем скорость реакции определяется скоростью наиболее медленной стадии.
В тех случаях, когда реакция протекает в одну стадию (такая реакция называется элементарным химическим процессом), порядок реакции ni по данному веществу i совпадает со стехиометрическим коэффициентом данного вещества в химическом уравнении. Алгебраическая сумма показателей степеней n = n1 + n2 есть суммарный порядок реакции.
Общий порядок элементарной химической реакции равен сумме стехиометрических коэффициентов веществ, вступающих в реакцию, или, другими словами, числу молекул, участвующих в реакции.
Например, рассмотрим распад перекиси водорода, согласно уравнению реакции,
должен протекать как реакция второго порядка, на самом деле порядок этой реакции изменяется в зависимости от условий ее проведения и может быть первым или дробным. Последнее, таким образом, указывает на то, что реакция протекает через различные промежуточные стадии.
В применении к гетерогенным процессам различают истинный и кажущийся порядок реакции. Истинный порядок – порядок реакции относительно концентрации компонента участвующего на поверхности твердой фазы. Кажущийся порядок – порядок реакции зависит от соотношения между объемной и поверхностной концентрациями. Кинетическому уравнению с этой точки зрения отвечает кажущийся порядок. Величина наблюдаемого (кажущегося) на опыте порядка реакции может зависеть от условий эксперимента.
Например, если опыт проводится в избытке одного из компонентов, таким образом изменение его концентрации и влияние на скорость будет незаметным. Тогда nкаж = 0 по данному компоненту.
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/
http://helpiks.org/1-122494.html