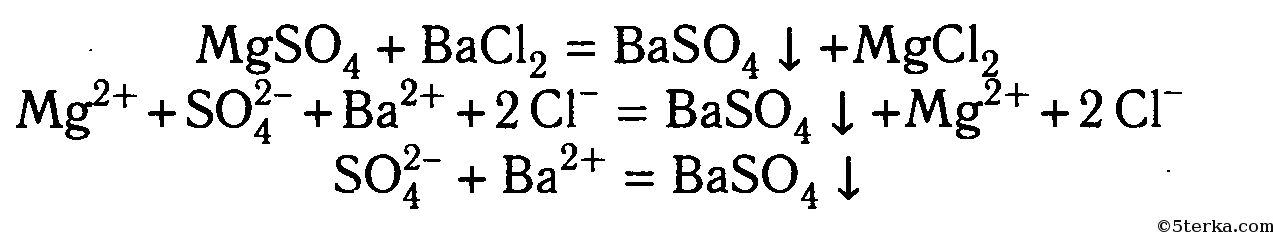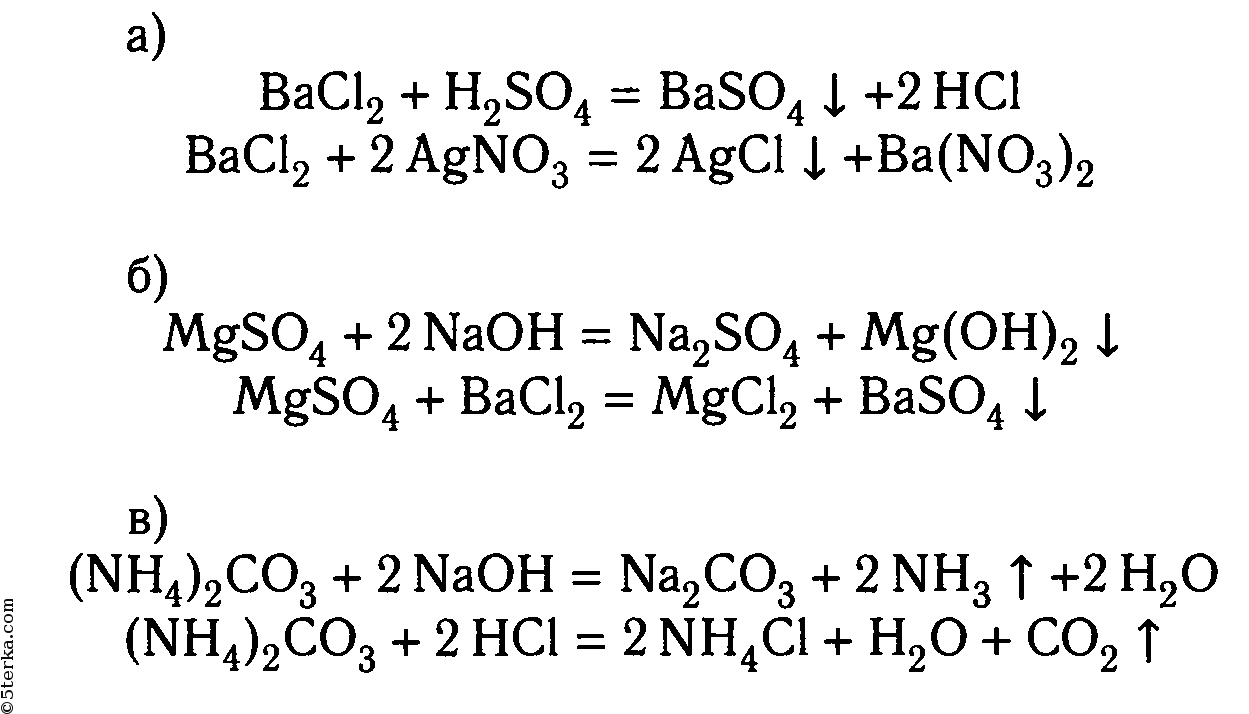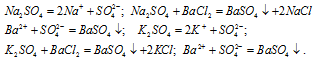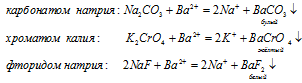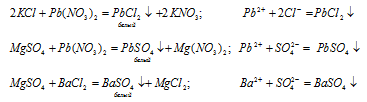Практическая работа № 6. Ионные реакции
Обнаружение сулъфат-ионов SO4 2-
В одну пробирку налейте 1—2 мл раствора сульфата натрия, а в другую — 1—2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращенное ионные уравнения реакции.
Какие соединения могут служить реактивом на ионы бария Ва 2+ ?
В чем сущность обнаружения ионов с помощью реактива?
Сущность обнаружения ионов с помощью реактива заключается в том, что реакции с ними обнаруживаемого иона, избирательна для данного иона. Такая реакция называется аналитической. Аналитическая реакция сопровождается выделением газа, выпадением осадка или изменением цвета раствора.
Обнаружение хлорид-ионов Cl
По таблице растворимости выясните, какие соли, содержащие хлорид-ион Cl — , нерастворимы (малорастворимы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращенные ионные уравнения проведенных реакций.
Обнаружение сульфат-ионов SO4 2- и хлорид-ионов Cl —
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой — раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую — раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей — KCl или MgSO4 — содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведенных вами реакций и полные и сокращенные ионные уравнения реакций обнаружения ионов.
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.

задача №1
к главе «Глава 7. Свойства электролитов».
Практическая работа №6. Ионные реакции.
Обнаружение сульфат-ионов SO4 2- .
В одну пробирку налейте 1-2 мл раствора сульфата натрия, а в другую – 1-2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращённое ионные уравнения реакции. Какие соединения могут служить реактивом на ионы бария Ba 2+ ?
В чём сущность обнаружения ионов с помощью реактива?
Обнаружение хлорид-ионов Cl — .
По таблице растворимости выясните, какие соли, со держащие хлорид-ион Cl — , нерастворимы (малорастворимы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращённые ионные уравнения проведённых реакций.
Обнаружение сульфат-ионов SO4 2- и хлорид-ионов Cl — .
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой – раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую – раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей – KCl или MgSO4 – содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведённых вами реакций и полные и сокращённые ионные уравнения реакций обнаружения ионов.
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.
Опыт 1. Обнаружение сульфат-ионов SO4 2- .
При добавлении раствора хлорида бария в раствор сульфата натрия, образуется белый осадок сульфата бария:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na + + SO4 2- + Ba 2+ + 2Cl — ⟶ 2Na + + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
При добавлении раствора хлорида бария в раствор сульфата калия, также образуется белый осадок сульфата бария:
K2SO4 + BaCl2 ⟶ 2KCl + BaSO4↓
2K + + SO4 2- + Ba 2+ + 2Cl — ⟶ 2K + + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Растворимые сульфаты, сульфиты, карбонаты и фосфаты могут служить реактивом на ионы бария Ba 2+ , которые образуют нерастворимые соли с катионом бария.
Опыт 2. Обнаружение хлорид-ионов Cl — .
По таблице растворимости видно, что нерастворимым является хлорид серебра (I) и малорастворимым является хлорид свинца (II).
Для того, чтобы обнаружить хлорид-ионы в растворе хлорида натрия, прильем нитрат серебра (I), в результате реакции должен образоваться белый творожистый осадок:
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
Na + + Cl — + Ag + + NO3 — ⟶ Na + + NO3 — + AgCl↓
Ag + + Cl — ⟶ AgCl↓
Опыт 3. Обнаружение сульфат-ионов SO4 2- и хлорид-ионов Cl — .
Чтобы доказать, что в пробирке находится раствор хлорида калия, можно использовать раствор растворимой соли серебра (I) или свинца (II). Осадок выпадет в той пробирке, где добавили нитрат свинца (II) к хлориду калия:
2KCl + Pb(NO3)2 ⟶ 2KNO3 + PbCl2↓
2K + + 2Cl — + Pb 2+ + 2NO3 — ⟶ 2K + + 2NO3 — + PbCl2↓
Pb 2+ + 2Cl — ⟶ PbCl2↓
Чтобы доказать, что в пробирке находится раствор сульфата магния, можно использовать раствор растворимой соли бария. Осадок выпадет в той пробирке, где добавили раствор хлорида бария к сульфату магния:
MgSO4 + BaCl2 ⟶ MgCl2 + BaSO4↓
Mg 2+ + SO4 2- + Ba 2+ + 2Cl — ⟶ Mg 2+ + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Опыт 4.
а) хлорид бария
Для подтверждения того, что в хлориде бария содержится катион бария, необходимо к его раствору добавить раствор сульфата натрия, в результате реакции образуется белый осадок:
BaCl2 + Na2SO4 ⟶ 2NaCl + BaSO4↓
Ba 2+ + 2Cl — + 2Na + + SO4 2- ⟶ 2Na + + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
Для подтверждения того, что в хлориде бария содержится хлорид-анион, необходимо к его раствору добавить раствор нитрата серебра (I), в результате реакции образуется белый осадок:
NaCl + AgNO3 ⟶ NaNO3 + AgCl↓
Na + + Cl — + Ag + + NO3 — ⟶ Na + + NO3 — + AgCl↓
Ag + + Cl — ⟶ AgCl↓
б) сульфат магния
Для подтверждения того, что в сульфате магния содержится катион магния, необходимо к его раствору добавить раствор гидроксида натрия, в результате реакции образуется белый осадок:
MgSO4 + 2NaOH ⟶ Na2SO4 + Mg(OH)2↓
Mg 2+ + SO4 2- + 2Na 2+ + 2OH — ⟶ 2Na + + SO4 2- + Mg(OH)2↓
Mg 2+ + 2OH — ⟶ Mg(OH)2↓
Для подтверждения того, что в сульфате магния содержится сульфат-анион, необходимо к его раствору добавить раствор нитрата серебра (I), в результате реакции образуется белый осадок:
MgSO4 + BaCl2 ⟶ MgCl2 + BaSO4↓
Mg 2+ + SO4 2- + Ba 2+ + 2Cl — ⟶ Mg 2+ + 2Cl — + BaSO4↓
Ba 2+ + SO4 2- ⟶ BaSO4↓
в) карбонат аммония
Для подтверждения того, что в карбонате аммония содержится катион аммония, необходимо к его раствору добавить раствор гидроксида натрия, после протекания реакции будет чувствоваться запах аммиака:
(NH4)2CO3 + 2NaOH ⟶ Na2CO3 + 2NH4OH
2NH4 + + CO3 2- + 2Na + + 2OH — ⟶ 2Na + + CO3 2- + 2NH4OH
NH4 + + OH — ⟶ NH4OH
Для подтверждения того, что в карбонате аммония содержится карбонат-анион, необходимо к его раствору добавить раствор соляной кислоты, в результате реакции образуется газ:
(NH4)2CO3 + 2HCl ⟶ 2NH4Cl + H2O + CO2↑
2NH4 + + CO3 2- + 2H + + 2Cl — ⟶ 2NH4 + + 2Cl — + H2O + CO2↑
2H + + CO3 2- ⟶ H2O + CO2↑
Ионные реакции. Обнаружение сульфат-ионов и хлорид-ионов
Опыт 1. «Обнаружение сульфат-ионов SO4 2– ».
Выполнение работы:
В одну пробирку налили раствор сульфата натрия, в другую — раствор сульфата калия и прибавили в каждую раствор хлорида бария. В обеих пробирках выпал белый мелкокристаллический осадок:
Для обнаружения ионов бария можно воспользоваться следующими реактивами:
Сущность обнаружения ионов с помощью реактива заключается в специфичности некоторых реакций, когда они сопровождаются разливными аналитическими сигналами: выделением газа или выпадением осадка определенного цвета.
Опыт 2. «Обнаружение хлорид-ионов Cl – »
Выполнение работы:
Уравнения диссоциации солей нитрата серебра и хлорида натрия:
AgNO3 ⇔ Ag + + NO3 – ;
NaCl ⇔ Na + + Cl – .
Нерастворимые хлориды серебра и свинца. Присутствие ионов Cl – в растворе хлорида натрия можно доказать при помощи нитрата серебра:
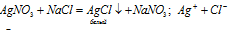
образуется белый творожистый осадок.
Опыт 3. «Обнаружение сульфат ионов SO4 2– и хлорид ионов Cl – »
Выполнение работы:
Для обнаружения в пробирках хлорида калия и сульфата магния воспользуемся следующим планом: Раствор из одной пробирки отлили в другую пробирку так, чтобы в каждой было примерно одинаковое количество раствора. В одну пробирку прильем немного раствора нитрата свинца (II), в другую раствор хлорида бария. Смотрим, в какой из пробирок выпал осадок, если в одной, то значит, здесь был раствор хлорида калия, если в двух — сульфат магния.
В пробирку, где был второй исходный раствор, прильем немного раствора нитрата свинца и убедимся в правильности наших рассуждений, что если тогда выпали осадки ВаSO4 и РbSO4 и в пробирке находится MgSO4, то сейчас выпал осадок PbCl2 и в этой пробирке находится КСl. Или наоборот. Тогда выпал осадок РbCl2, а сейчас выпал осадок РbSO4.
Опыт 4. Качественный состав хлорида бария, сульфата магния и карбоната аммония.
Выполнение работы:
а) Проделаем реакции, подтверждающие качественный состав ВаCl2.
Раствор из пробирки разделим пополам и перельем в 2 пробирки.
Докажем присутствие ионов Ва 2+ — прильем в одну пробирку разбавленную серную кислоту, выпадает белый осадок:
Докажем присутствие ионов Cl – — прильем в другую пробирку раствор нитрата серебра, выпадет белый осадок:
б) Проделаем реакции, подтверждающие качественный состав MgSO4.
Раствор из пробирки разделим пополам и перельем в 2 пробирки.
Докажем присутствие ионов Mg 2+ — прильем в одну пробирку раствор NаОН, выпадает белый осадок:
Докажем присутствие нонов SO4 2– — прильем в другую пробирку раствор хлорида бария, выпадет белый осадок:
в) Проведем реакции, подтверждающие качественный состав (NH4)2CO3.
Раствор из пробирки разделим пополам и перельем в две пробирки. Докажем присутствие ионов NH4 + прильем в пробирку раствор NаОН, почувствуем запах аммиака:
Докажем присутствие ионов СО3 – — прильем в пробирку раствор НСl, будет выделяться газ:
http://gomolog.ru/reshebniki/8-klass/gabrielyan-2013/prakt/6.html
http://buzani.ru/khimiya/o-s-gabrielyan-8kl/514-prakticheskaya-rabota-6-8-ionnye-reaktsii