Презентация по физике в 10 классе Уравнение состояния идеального газа
презентация к уроку физики (10 класс) по теме
Презентация по физике в 10 классе. Урок изучения нового материала по теме » Уравнение состояния идеального газа»
Скачать:
| Вложение | Размер |
|---|---|
| 49._ur-ie_sost._gaza_mend-klapeyrona.ppt | 860.5 КБ |
Предварительный просмотр:
Подписи к слайдам:
Урок 49. Уравнение состояния идеального газа. п.70 французский физик и инженер. Родился 26 января 1799 в Париже. Окончил Политехническую школу (1818). Работал в Институте инженеров путей сообщения в Петербурге (1820–1830). По возвращении во Францию стал профессором Школы мостов и дорог в Париже. Клапейрон Бенуа Поль Эмиль (1799–1864 )
Уравнение состояния идеального газа в форме Клапейрона Уравнение состояния идеального газа в форме Клапейрона
Обобщив уравнение Клапейрона, в 1874 вывел общее уравнение состояния идеального газа Менделеев Дмитрий Иванович (8.II.1834–2.II.1907)
Уравнение состояния идеального газа в форме Менделеева- Клапейрона Уравнение состояния идеального газа в форме Менделеева- Клапейрона
Практическое применение уравнения состояния: 1. В термометрах… Уравнение позволяет определить одну из величин, характеризующих состояние, если известны две другие величины Это используют в термометрах
2. В газовых законах… Зная уравнение состояния, можно сказать, как протекают в системе процессы при определённых внешних условиях
3. В молекулярной физике… Зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел
Df . Изотермический процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре Т= const Закон Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. Э. Мариотт Р. Бойль
графическое изображение изотермического процесса в различных системах координат. Графики изотермического процесса называют изотермами
Df . Изохорный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме V = const Закон Шарля: Для газа данной массы отношение давления газа к температуре постоянно, если объем газа не меняется. Ж. Шарль
Графики изохорного процесса называют изохорами. графическое изображение изохорного процесса в различных системах координат. V = const V = const V 1 Мне нравится
Презентация по физике «Уравнение состояния идеального газа,изопроцессы», 10 класс
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
«Посев научный взойдет для жатвы народной!» (Дмитрий Иванович Менделеев)
план Уравнение состояния идеального газа. (Клапейрона) Уравнение Менделеева — Клапейрона Понятие «ИЗОПРОЦЕССЫ» 4. Виды изопроцессов 5. Газовые законы 6. Графическое представление газовых законов
Вопросы: Как называется модель на которой рассматривают состояние газообразных тел (идеальный газ) Какими параметрами характеризуется состояние идеального газа ( давление, объём, температура)
Как называются эти параметры (макроскопические) Как термодинамический параметр давление связан с микроскопическими параметрами? (основное уравнение МКТ) Как объём связан с микроскопическими параметрами? (объём обратно пропорционален концентрации)
Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа . Выведем уравнение, устанавливающее зависимость между этими параметрами.
Клапейрон Бенуа Поль Эмиль (26.I.1799–28.I.1864) Французский физик, член Парижской АН (1858). Окончил Политехническую школу в Париже (1818). В 1820–30 работал в Петербурге в институте инженеров путей сообщения.
Менделеев Дмитрий Иванович (8.II.1834–2.II.1907) Русский ученый-энциклопедист.. В 1874 вывел общее уравнение состояния идеального газа, обобщив уравнение Клапейрона(уравнение Клапейрона-Менделеева).
Уравнение состояния — первое из замечательных обобщений в физике, с помощью которых свойства разных веществ выражаются через одни и те же основные величины. Именно к этому стремиться физика — к нахождению общих законов, не зависящих от тех или иных веществ. Газы, существенно простые по своей природе, дали первый пример такого обобщения.
Процесс изменения состояния идеального газа при неизменном значении одного из макроскопических параметров — изопроцесс
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС T=const Процесс изменения состояния идеального газа при постоянной температуре m=const рV=const T=const закон Бойля — Мариотта
К этому выводу пришёл английский учёный Роберт Бойль в 1662 г. и французский физик Э.Мариотт в 1676г.
Закон Бойля -Мариотта Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется
График изотермического процесса изотерма V,м3 Т=const, рV=const р,Па изотерма V,м3
ИЗОБАРНЫЙ ПРОЦЕСС р=const Процесс изменения состояния идеального газа при постоянном давлении m=const р= const закон Гей — Люссака
Этот закон экспериментально был открыт в 1802г. Французским учёным Гей-Люссаком
Закон Гей-Люссака Для газа данной массы отношение объёма к температуре постоянно, если давление не меняется.
График изобарного процесса V,м3 P=const, изобара T,К
ИЗОХОРНЫЙ ПРОЦЕСС V=const Процесс изменения состояния идеального газа при постоянном объёме m=const V=const закон Шарля
Эту зависимость экспериментально установил в 1787г. французский физик Шарль
Закон Шарля Для данной массы газа отношение давления к температуре постоянно, если объём не меняется
График изохорного процесса р,Па V=const, изохора Т,К
Эти законы справедливы для любых газов, а так же для смесей газов(например воздуха)
Задачи: 1. Почему баллон с любым сжатым газом представляет большую опасность при пожаре? 2. В двух сосудах одинакового объема при одинаковых температуре и давлении находится водород и азот. Масса какого из газов больше и во сколько раз? 3. Иногда из бутылки, наполненной газированной водой, вылетает пробка, если бутылка поставлена в теплое место. Почему?
Задачи: 4. Какой объём будет занимать газ при температуре 77◦С, если при 27◦С его объём равен 0,006 м3,при постоянном давлении.
V1-? «СИ» t1=77◦С Т1=77+273=350К t2=27◦С Т2 = 300К V2=0,006м3 Ответ: 0,007 м3.
6. Какие процессы изображены на графике. Представьте эти процессы в координатах р-Т и V-T р,Па 1 2 3 V,м3
На участке 1-2 график изобарного процесса (р=const), на 2-3 график изохорного процесса (V=const) р,Па 1 2 3 Т,К
(т.к. 1-2 – р=const, а 2-3 – V=const) V,м3 3 2 1 T,К
Домашнее задание: §70, 71; упражнение 13(2,3,11) – 2005 §68, 69 ; упражнение 13(1,2,8) — 2008
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 949 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 48 человек из 28 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 568 206 материалов в базе
Другие материалы
- 23.09.2015
- 608
- 0
- 23.09.2015
- 914
- 1
- 23.09.2015
- 1291
- 0
- 23.09.2015
- 2297
- 3
- 23.09.2015
- 598
- 0
- 23.09.2015
- 3742
- 5
- 23.09.2015
- 10028
- 25
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 23.09.2015 10561
- PPTX 2.8 мбайт
- 1073 скачивания
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Еремичева Наталья Михайловна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 9 месяцев
- Подписчики: 0
- Всего просмотров: 47481
- Всего материалов: 11
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
В России могут объявить Десятилетие науки и технологий
Время чтения: 1 минута
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Презентация «Уравнение состояния идеального газа»
Презентация «Уравнение состояния идеального газа»
Просмотр содержимого документа
«Презентация «Уравнение состояния идеального газа»»
Уравнение состояния идеального газа
это модель газа, удовлетворяющая следующим условиям:
1) молекулы газа можно считать МТ, которые хаотически движутся;
2) силы взаимодействия между молекулами идеального газа практически отсутствуют;
3) при столкновениях молекулы идеального газа ведут себя, как абсолютно упругие шарики.
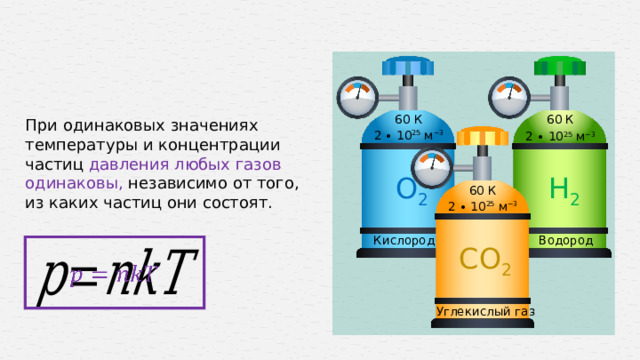
При одинаковых значениях температуры и концентрации частиц давления любых газов одинаковы, независимо от того, из каких частиц они состоят.
Макроскопические параметры состояния идеального газа —
физические величины, которые характеризуют некоторое количество идеального газа как макроскопическую систему ().
Уравнение состояния идеального газа
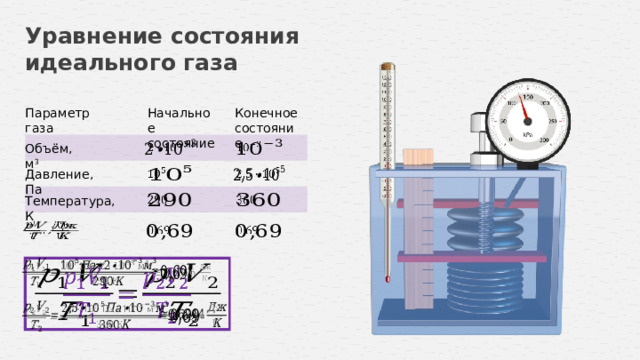
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называют уравнением состояния идеального газа.
Основное уравнение МКТ:
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называется уравнением состояния идеального газа.
При неизменной массе и неизменном химическом составе газа отношение произведения его давления и объёма к абсолютной температуре является величиной постоянной.
Уравнение состояния идеального газа
Уравнение состояния применимо
к реальным газам, если:
1) давление газа таково, что собственный объём всех молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2) температура газа такова, что значение Е п межмолекулярного взаимодействия пренебрежимо мало по сравнению с Е к теплового движения молекул.
Уравнение состояния идеального газа
Основное уравнение МКТ:
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называется уравнением состояния идеального газа.
Уравнение состояния идеального газа
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называют уравнением состояния идеального газа.
— уравнение Клапейрона — Менделеева
При равных давлениях и температурах
в одинаковых объёмах любых газов содержится одинаковое число молекул.
Общее число частиц газов:
давление газа, входящего в состав газовой смеси, если бы он один занимал весь объём, предоставленный смеси, при той же температуре.
Давление смеси химически не реагирующих между собой газов равно сумме парциальных давлений каждого из газов.
Баллон вместимостью 20 л, содержащий газ при давлении 3 МПа и температуре 320 К, соединили с пустым баллоном вместимостью 5 л. Определите давление газа, которое установилось в баллонах после расширения, если температура газа стала равной 285 К.
Конечный объём газа:
Конечное давление газа:
ОТВЕТ: давление газа в баллонах равно 2 МПа.
Задача 2. Определите плотность смеси, состоящей из 4 г водорода и 32 г кислорода при температуре 7 о С и давлении 95 кПа.
Уравнение Клапейрона — Менделеева:
Задача 2. Определите плотность смеси, состоящей из 4 г водорода и 32 г кислорода при температуре 7 о С и давлении 95 кПа.
http://infourok.ru/prezentaciya-po-fizike-uravnenie-sostoyaniya-idealnogo-gazaizoprocessi-klass-431757.html
http://multiurok.ru/files/prezentatsiia-uravnenie-sostoianiia-idealnogo-ga-1.html