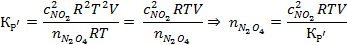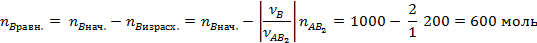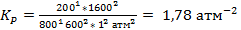При 450 градусах давление диссоциации nio по уравнению
Химическим равновесием называется такое состояние обратимой химической реакции
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
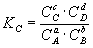
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
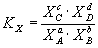
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
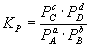
Константа равновесия связана с rG o химической реакции:
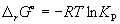
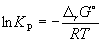
Изменение rG или rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
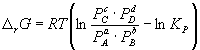
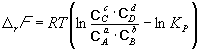
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
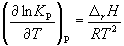
и изохоры химической реакции (изохоры Вант-Гоффа)
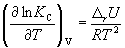
Интегрирование уравнения (9.9) в предположении, что rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
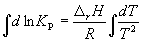
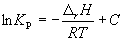
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – rH /R.
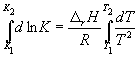
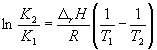
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать rH реакции. Соответственно, зная rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
Пример 9-1. Рассчитать константу равновесия для реакции
при 500 K. fG o для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж . моль –1 и –134.20 кДж . моль –1 соответственно.
Решение. G o реакции:
rG o = fG o (CH3OH) – fG o (CO) = –134.20 – (–155.41) = 21.21 кДж . моль –1 .
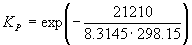
Пример 9-2. Константа равновесия реакции
равна KP = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
Решение. Пусть прореагировало моль N2. Тогда
| N2(г) | + | 3H2(г) | = | 2NH3(г) |
| Исходное количество | 1 | 1 | ||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2 ) | |
| Равновесная мольная доля: | 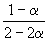 | 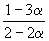 | 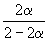 |
Следовательно, KX = 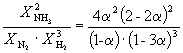
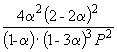
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =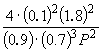
Пример 9-3. Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H2(г) | = | CH3OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N2 = 4–2 моль | ||||
| Равновесная мольная доля | 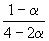 | 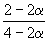 | 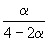 | ||
Следовательно, KX = 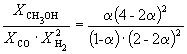
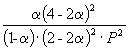
Таким образом, 6.09 10 –3 = 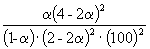
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: 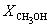
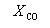
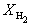
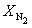
Пример 9-4. Для реакции
при 298 К KP = 6.0 10 5 , а fH o (NH3) = –46.1 кДж . моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
rH o = 2 fH o (NH3) = –92.2 кДж . моль –1 .
Согласно уравнению (9.14), 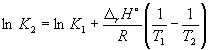
= ln (6.0 10 5 ) + 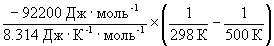
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
Указание: во всех задачах считать газы идеальными.
- При 1273 К и общем давлении 30 атм в равновесной смеси
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
Константа равновесия реакции
при 500 o C равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
Константа равновесия реакции
при 25 o C равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
при 250 o C rG o = –2508 Дж . моль –1 . При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250 o C составит 30%?
константа равновесия KP = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать rG o для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400 o C. Константа равновесия для реакции
при 400 o C равна K = 1.60 10 –4 .
При 250 o C и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
При 2000 o C для реакции
Kp = 2.5 10 –3 . В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
При 420 o C давление газов равно 5.16 10 4 Па, а при 450 o C 10.8 10 4 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
получены следующие данные по зависимости константы равновесия от температуры:
3.98 10 –4
1.41 10 –2
1.86 10 –1
Определить стандартную энтальпию реакции в этом температурном интервале.
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Рассчитать rG o , rH o и rS o реакции при 400 К.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
При 450 градусах давление диссоциации nio по уравнению
Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) — b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то 


Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
где μ i ° — стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° — a μ A ° — b μ B ° = — RTln 

Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:

Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
где
Следует обратить внимание, что в полученных соотношениях только KN зависит от общего давления. Она позволяет нам оценивать сдвиг равновесия в газовых реакциях при изменении общего давления. Следует иметь в виду, что давление в этих выражениях складывается из парциальных давлений компонентов системы и не учитывает влияние инертных газов, если они присутствуют в реакционной смеси. Естественно инертный газ «разбавляет» компоненты реакционной смеси и поэтому влияет на KN .
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для 

Дифференцируем уравнение (6 – 5)


Из уравнения (6 — 5´) получаем уравнение изобары химической реакции:

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе




В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 
Отсюда находим
В отличие от 




Для 25% 
Следовательно,
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
Семинар по теме «Химическое равновесие» № 1
Задача 1. Для реакции N2O4 → 2 NO2 при 55 ºС КР′ = 1,38 * 10 5 Н/м 2 . Сколько молей N2O4 следует поместить в сосуд ёмкостью 10 л для того, чтобы при равновесии концентрация NO2 в нём составила 0,1 моль/л.
По определению константа 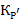
Преобразуем по уравнению Менделеева-Клапейрона:
Подставим значения, предварительно переведя значения величин в единицы системы СИ
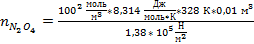
Задача 2. При смешении 1 кмоль А и 1 кмоль В в результате реакции А + 2В → АВ2 в равновесной смеси образовалось 0,2 кмоль АВ2. Определить численное значение КР при общем давлении 1 атмосфера если все вещества находятся в идеальном газообразном состоянии.
Поскольку в этой задачи даны моли веществ, проще всего будет рассчитывать КР через Кn. Тогда:
Исходя из стехиометрии легко рассчитаем равновесное количество участников реакции:
1.Константа равновесия реакции Н2 + I2 → 2HI при 717 К равна 46,7. Определить количество (в молях) разложившегося HI при нагревании 1 моль HI до 717 К.
2.Железо и водяной пар реагируют по уравнению Fe + H2O → FeO + H2. При 1000 К и 1,013 * 10 5 Па парциальное давление водорода составляет PH2 = 6,526 * 10 4 Па. Вычислите константу равновесия.
3. Вычислить константу диссоциации BaO по реакции BaO →Ba + ½ O2 при 4000 К, если известны константы реакций:
BaO → Ba + O; K1 = 0,0156
4.Константа равновесия реакции Fe3O4 + CO → FeO + CO2 при 600 ºС равна 1,15. Определите конечный состав системы, если изначально в системе присутствовали 1 моль Fe3O4, 2 моль CO, 0,5 молей FeO и 0,3 моля CO2 при общем давлении 5 атм.
Ответ: 0,07 моль Fe3O4; 1,07 моль CO; 3,29 моль FeO; 1,23 моль CO2.
lgKa = 2486/T + 1,565lgT – 0,066 * 10 -3 T – 6,93.
Вывести уравнения ∆Hº; ∆Sº; ∆Gº; ∆cPº = f (T) и вычислить значения этих величин при 400 К.
Ответ: ∆Hº = -42,54 кДж/моль; ∆Sº = — 42,55 Дж/(моль * К); ∆Gº = -25,51 кДж/моль; ∆cPº = 12,00 Дж/(моль * К)
lgKa = 10679/T + 0,736lgT + 0,114*10 -3 T – 0,354*10 5 /T 2 – 12,419
Вывести уравнения ∆Hº; ∆Sº; ∆Gº; ∆cPº = f (T) и вычислить значения этих величин при 1000 К.
Ответ: ∆Hº = -194,68 кДж/моль; ∆Sº = — 184,05 Дж/(моль * К); ∆Gº = -10,50 кДж/моль; ∆cPº = 9,13 Дж/(моль * К)
7.Равновесное давление водяного пара по реакции Ca(OH)2 → CaO + H2O равно 100 мм рт. ст. при 450 ºС и 400 мм рт. ст. при 531 ºС. Найдите среднее значение энтальпии в данном интервале температур. Найдите температуру при которой равновесное давление паров воды составит 200 мм рт. ст.
Ответ: 82,713 кДж/моль; 761,4 К
8. Степень диссоциации PCl5 при 473 К и P = 1 атм равна 0,485, а при 523 К и P = 1 атм – 0,8. Рассчитайте средний тепловой эффект реакции
PCl5 → PCl3 + Cl2 в пределе температур 473 – 523 К. Также определите значение константы равновесия при температуре 500 К.
Ответ: 73,33 кДж/моль; K473 = 0,299; K500 = 0,818; K523 = 1,778 атм.
9. Пользуясь справочными данными о приведённой энергии Гиббса и энтальпии образования веществ при 0 К рассчитать Ка реакции
| N2 | O2 | NO |
| (GºT – Hº0)/T | 197,93 | 212,08 |
| Hºf,0 | 90,15 |
10.Определить КР и КС реакции 2H2O → 2H2 + O2, если известны объём системы V, температура Т, степень диссоциации α, исходное число молей n0.
11.Выразить в общем виде КР для реакции 2CO2 → 2CO + O2, если степень диссоциации α, общее давление Р, число молей исходного вещества 2.
12.Рассчитать равновесный выход продукта в реакции димеризации оксида азота 2NO2 → N2O4, если известны КР и общее давление Р. Исходное количество NO2 1 моль.
http://www.trotted.narod.ru/physchem/lec-6.htm
http://poisk-ru.ru/s6846t21.html