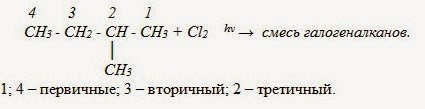Алканы
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
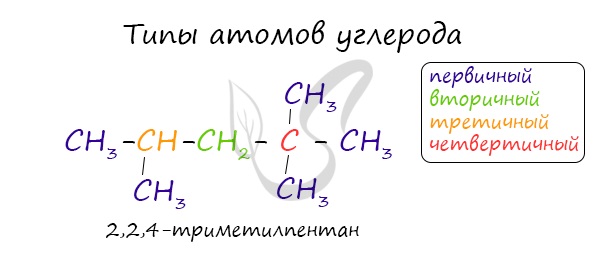
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
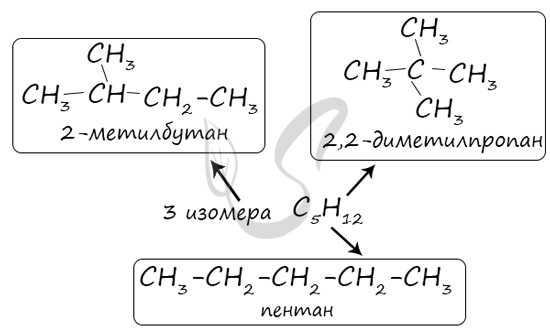
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
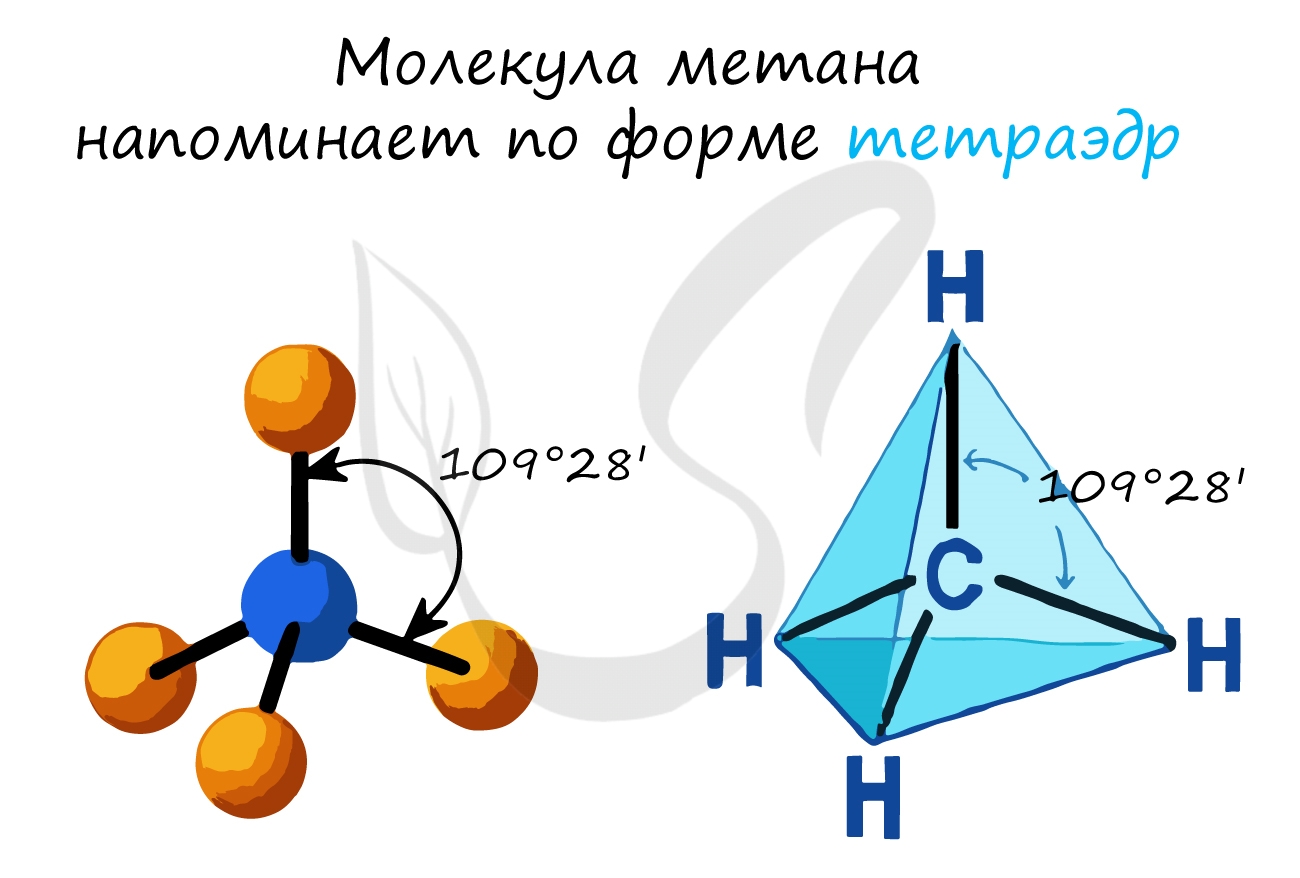
- Тип гибридизации атомов углерода — sp 3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
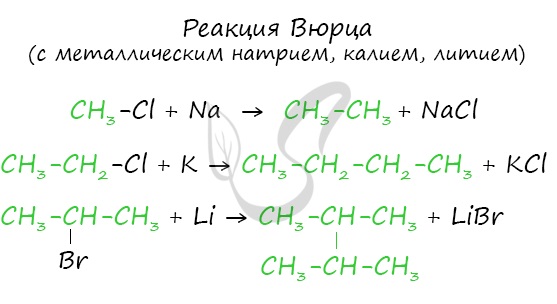
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного.
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
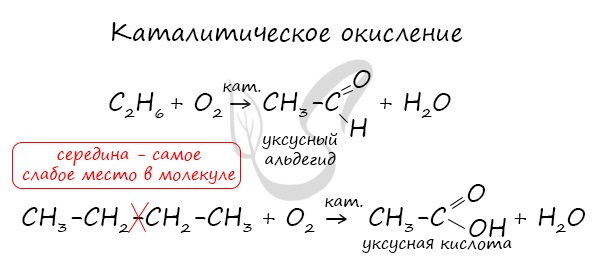
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
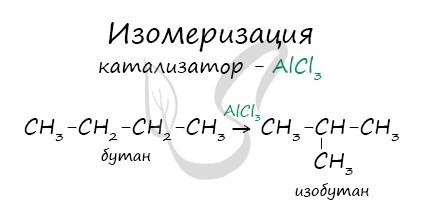
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Применение алканов
Предельные углеводороды с общей формулой CnH2n+2, основным источником которых служат нефть, газ и каменный уголь, являются сырьевой базой для химической промышленности и основными природным источником энергии.
Применение алканов
Первоначально насыщенные углеводороды использовались как топливо — в результате горения высвобождается энергия:
Области применения алканов связаны с их физико-химическими свойствами:
- Газообразные алканы (метан, пропан и бутан). Горят бледно-голубым или бесцветным пламенем, при этом выделяется большое количество тепла. Применяются для бытовых нужд – как топливо в газовых плитах, зажигалках и газовых баллончиках для туристических горелок. В промышленных объемах — как топливо для газовых электростанций, вырабатывающих тепло и электроэнергию. Метан как часть природного газа — один из лучших природных субстратов, используемых в биотехнологии.
- Жидкие алканы. Являются основной частью горючего для двигателей внутреннего сгорания – от мотоциклетных до ракетных. Изомеры линейных алканов применяют как добавку для повышения качества топлива. Смесь предельных углеводородов с длиной цепочки не более 15 атомов углерода — вазелиновое масло применяют в косметологии и медицине. В промышленности применяют гудрон (остаточный продукт после переработки нефти) для производства строительных кровельных и дорожных битумов и кокса.
- Твердые алканы. Смесь жидких и твердых углеводородов с цепочкой до 25 атомов углерода – вазелин — густая масса, используется в медицине и косметических целях. Смесь алканов С20 -С35 называют парафином и используют для производства свечей, обработки упаковочных материалов и спичек. Парафиновые углеводороды служат основным сырьем для биосинтеза.
Применение в промышленности
Парафины являются основой для производства целого ряда веществ:
- азотной кислоты HNO3;
- насыщенных одноатомных cпиртов СnH2n+1OH;
- сажа (аморфный углерод) — для типографской краски и резины;
- галогензамещенных растворителей и хладонов;
- алкенов;
- альдегидов, которые используются в производстве органических кислот и пластмасс;
- как нефтехимическое сырье для производства ПАВ.
Алканы применяются при производстве синтетических моющих средств.
Исходными веществами для этого служат парафины фракции С41-С44 .
Применение в медицине и фармации
Смесь жидких и твердых парафинов с С Значение алканов
Предельные углеводороды применяются в пищевой и химической промышленности, в энергетике, косметологии и медицине.
Алканы служат растворителями и сырьем для производства лаков, красок, мазей. Их используют в качестве топлива и компонентов для различных битумов.
Химическое производство пластика, ПАВов и синтетических тканей использует в качестве сырья алканы.
С развитием технологий сферы применения насыщенных углеводородов расширяется.
Применение алканов таблица с уравнениями
II. Химические свойства алканов
1. Реакции замещения
а) Галогенирование
При действии света — hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или С n H 2n+1 Г
(Г — это галогены F, Cl, Br, I)
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия)
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия)
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( — СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.
б) Нитрование (реакция М.И. Коновалова , он провёл её впервые в 1888 г)
2. Реакции отщепления (дегидрирование)
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
3. Реакции перегруппировки (изомеризация)
4. Реакции горения (горят светлым не коптящим пламенем)
Помните! Смесь метана с воздухом и кислородом взрывоопасна
5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
в) Конверсия метана с образованием синтез – газа (СО + Н2)
III. Получение алканов
1. Получение в лаборатории
1. Гидролиз карбида алюминия (получение метана):
2. Реакция Вюрца (взаимодействие натрия с галогенпроизводными алканов):
(R- это радикал; Г- это галоген)
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
(ацетат натрия+ едкий натр=(метан+карбонат натрия)
этилат натрия этан
4. Каталитическое гидрирование алкенов и алкинов:
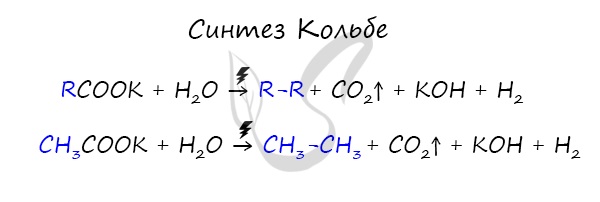
5. Электролиз растворов солей карбоновых кислот — реакция КОЛЬБЕ
Пример. Электролиз водного раствора ацетата натрия
Катод (-): H2O , Na + — Процесс восстановления: 2H 2 O + 2ē → H 2 ↑ + 2OH —
Анод (+): H 2 O, CH3COO — (анионы органических кислот активнее воды) – Процесс окисления:
2H2O + 2CH3COONa эл . ток = H2 + 2NaHCO3 + C2H6
2. Получение в промышленности
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье — нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов.
Метан называют ещё и болотным; рудничным газом.
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
бензины — т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
легкий газойль (дизельное топливо) 230-305 С (С13-С17);
тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25);
смазочные масла 405-515 С (С26-С38).
Остаток после перегонки нефти называется асфальтом или битумом.
2. Синтезом из водяного газа:
3. Синтезом из простых веществ:
IV. Применение
1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит.
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках.
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски.
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
http://allinchemistry.ru/organicheskaya-himiya/primenenie-alkanov
http://kardaeva.ru/dlya-uchenika/10-klass/94-uroki/266-alkany-fizicheskie-i-khimicheskie-svojstva-poluchenie-i-primenenie