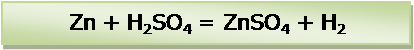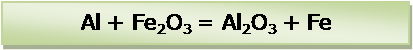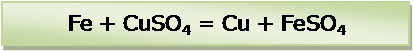Тест по химии Химические уравнения 8 класс
Тест по химии Химические уравнения 8 класс с ответами. Тест содержит 2 части. В части 1 — 15 заданий базового уровня. В части 2 — 3 задания повышенного уровня.
Часть 1
1. Верны ли следующие суждения?
А. Масса реагентов равна массе продуктов реакции.
Б. Химическое уравнение — условная запись химической реакции с помощью химических формул и математических знаков.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. В ходе химической реакции число атомов некоторого элемента
1) только увеличивается
2) только уменьшается
3) не изменяется
4) может как увеличиваться, так и уменьшаться
3. В ходе химической реакции число молекул реагентов
1) только увеличивается
2) только уменьшается
3) не изменяется
4) может как увеличиваться, так и уменьшаться
4. В ходе химической реакции число молекул продуктов реакции
1) только увеличивается
2) только уменьшается
3) не изменяется
4) может как увеличиваться, так и уменьшаться
5. Составьте уравнение реакции по схеме:
СН4 + O2 → СO2 + Н2O. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
6. Составьте уравнение реакции по схеме:
FeS + O2 → Fe2O3 + SO2.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 13
2) 15
3) 17
4) 19
7. Составьте уравнение реакции по схеме:
Nа2O + Н2O → NaOH.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
8. Составьте уравнение реакции по схеме:
Н2O + N2O5 → HNO3.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
9. Составьте уравнение реакции по схеме:
NаОН + N2O3 → NaNO2 + Н2O.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
10. Составьте уравнение реакции по схеме: Аl2O3 + HCI → AlCl3 + Н2O.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 10
2) 11
3) 12
4) 14
11. Составьте уравнение реакции по схеме:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + Н2O. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 12
2) 13
3) 14
4) 15
12. Составьте уравнение реакции по схеме:
гидроксид меди (II) + соляная кислота → хлорид меди (II) + вода.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
13.Составьте уравнение реакции по схеме:
гидроксид алюминия → оксид алюминия + вода.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
14. Составьте уравнение реакции по схеме:
оксид железа (III) + водород → железо + вода.
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
15. Составьте уравнение реакции по схеме:
карбонат кальция + соляная кислота → хлорид кальция + вода + оксид углерода (IV).
Ответ дайте в виде суммы коэффициентов в уравнении реакции.
Часть 2
1. Установите соответствие между исходными веществами и продуктами соответствующих химических реакций. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Исходные вещества
Продукты реакции
2. Установите соответствие между схемой реакции и суммой коэффициентов в уравнении реакции. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Уравнения реакций
Сумма коэффициентов
3. Закон сохранения массы вещества является частью более общего закона сохранения материи. Виды материи (энергия и вещество) взаимосвязаны по формуле Эйнштейна: ΔЕ = Δm ⋅ с 2 (где скорость света с = 3 ⋅ 10 8 м/с). Если в ходе реакции, например, выделилось ΔЕ = 90 кДж = 9 ⋅ 10 4 Дж энергии, то масса системы уменьшилась на величину: Δm = ΔЕ/с 2 = 9 ⋅ 10 4 /(3 ⋅ 10 8 ) 2 = 10 -12 кг = 10 -9 г. Эта величина меньше, чем точность аналитических весов (10 -6 г). Поэтому изменениями массы в ходе химических реакций можно пренебречь. Вычислите величину выделившейся энергии ΔЕ в кДж, если масса системы в ходе реакции уменьшилась на 2,5 ⋅ 10 -9 г. В ответе запишите величину ΔЕ без указания единиц измерения.
Ответы на тест по химии Химические уравнения 8 класс
Часть 1
1-3
2-3
3-2
4-1
5-2
6-3
7-1
8-4
9-2
10-3
11-1
12-2
13-3
14-4
15-1
Часть 2
1-2143
2-5121
3-225
Тест «Химические уравнения «
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Расставьте коэффициенты в схемах химических реакций и укажите тип реакции
B) PbO2 + H2 = Pb + H2O
Е) Fe2O3 + H2 = Fe + H2O
Расставьте коэффициенты в схемах химических реакций и укажите тип реакции
B) PbO2 + H2 = Pb + H2O
Е) Fe2O3 + H2 = Fe + H2O
I вариант
2Na + S = Na2S ( соединение)
Б) 2H2O = 2H2 + O2 (разложение)
B) PbO2 + 2H2 = Pb + 2H2O (замещение)
Г) 2NH3 = N2 + 3H2 ( разложение)
А)
IIвариант
2Ca + O2 = 2CaO (соединение)
Б) Fe2O3 + 3H2 = 2Fe + 3H2O (замещение)
B) 2Ag2O = 4Ag + O2 (разложение)
Г) 3Mg +N2 = Mg3N2 (соединение)
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 572 429 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 28. Химические уравнения
Другие материалы
- 18.02.2019
- 1877
- 68
- 27.12.2018
- 2865
- 343
- 03.12.2018
- 1478
- 12
- 01.12.2018
- 387
- 0
- 19.11.2018
- 316
- 1
- 04.11.2018
- 1545
- 4
- 11.10.2018
- 3854
- 58
- 04.08.2018
- 1143
- 12
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 27.02.2019 4891
- DOCX 36.5 кбайт
- 82 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Кучеров Владислав Владимирович. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 года и 4 месяца
- Подписчики: 0
- Всего просмотров: 419756
- Всего материалов: 103
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
В школах Хабаровского края введут уроки спортивной борьбы
Время чтения: 1 минута
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Примеры химических уравнений 8 класс тест
Проверить количество атомов (ионов) цинка и серы в левой и правой частях уравнения химической реакции. Равное количество: по 1. Проверить количество атомов (ионов) водорода в левой и правой частях уравнения. Равное количество: по 2. Последним проверить количество атомов кислорода. Равное количество: по 4.
Комментарий.
Проверить количество атомов (ионов) меди в левой и правой частях уравнения химической реакции. Равное количество: по 1. Проверить количество атомов азота в левой и правой частях уравнения. Количество разное: левая часть уравнения: 1. В правой части уравнения: 2. Уравнять количество атомов азота. В левой части уравнения перед формулой азотной кислоты (HNO3)поставить коэффициент 2. Количество атомов азота стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов (ионов) водорода. Равное количество: по 2. Последним проверить количество атомов кислорода. Равное количество: по 7. В левой части уравнения: 1 атом в оксиде меди (II) – CuO — и 6 атомов (2∙3) в двух молекулах азотной кислоты.
Комментарий.
Проверить количество атомов алюминия в левой и правой частях уравнения химической реакции. Количество атомов отличается. В левой части: 1 атом. В правой части: 2 атома. В левой части уравнения перед формулой простого вещества алюминий поставить коэффициент 2. Количество атомов алюминия стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов железа. Количество атомов отличается. В левой части: 2 атома. В правой части: 1 атом. В правой части уравнения перед формулой простого вещества железо поставить коэффициент 2. Количество атомов железа стало равным в левой и правой частях уравнения: по 2. Последним проверить количество атомов кислорода. Равное количество: по 3. В левой части уравнения: 3 атома в оксиде железа (III) – Fe2O3 и 3 атома в оксиде алюминия Al2O3.
Комментарий.
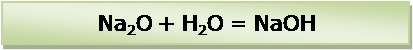
Проверить количество атомов натрия в левой и правой частях уравнения химической реакции. Количество атомов отличается. В левой части: 2 атома. В правой части: 1 атом. В правой части уравнения перед формулой гидроксида натрия (NaOH) поставить коэффициент 2. Количество атомов натрия стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов водорода. Количество атомов равное: по 2. В левой части: 2 атома в молекуле воды. В правой части: 2 атома в двух молекулах гидроксида натрия (в каждой по 1 атому). Последним проверить количество атомов кислорода. Равное количество: по 2. В левой части уравнения: 1 атом в оксиде натрия и 1 атом в оксиде водорода (H2O). В правой части уравнения: 2 атома в двух молекулах гидроксида натрия (в каждой по 1 атому).
Комментарий.
Проверить количество атомов (ионов) железа и меди в левой и правой частях уравнения химической реакции. Равное количество: по 1. Последним проверить количество атомов кислорода. Равное количество: по 4.
http://infourok.ru/test-himicheskie-uravneniya-3618382.html
http://mirhim.ucoz.ru/publ/testy/8_klass/u/41-1-0-177