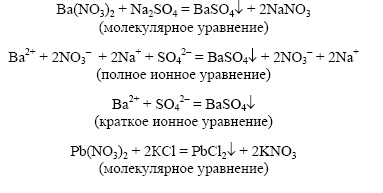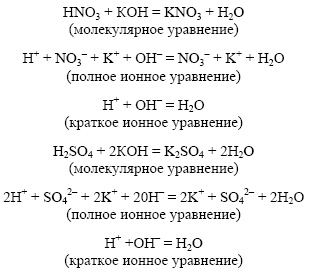При каких условиях ионные реакции протекают до конца? Приведите в каждом случае по два примера и составьте уравнения этих реакций в молекулярном, полном и сокращенном ионном виде.
Ионные реакции протекают до конца при следующих условиях:
1) Образуется осадок.
2) Выделяется газ.
3) Образуется малодиссоциированное соединение.

задача №5
к главе «Глава IV. Химические реакции».
Примеры ионных уравнений идущих до конца
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Реакции ионного обмена и
условия их протекания до конца
В курсе химии средней школы первоначальное знакомство с реакциями обмена у школьников происходит в 8-м классе. Здесь дается понятие реакций обмена как реакций, при которых два сложных вещества обмениваются своими составными частями. А уже в курсе химии 9-го класса акцентируется внимание учащихся на том, что это тип реакций, протекающих без изменения степеней окисления элементов у веществ. В нашей школе химия преподается по учебнику Ф.Г.Фельдмана и Г.Е.Рудзитиса, естественно, с дополнительным включением всех недостающих тем и вопросов в соответствии с госстандартом. Для облегчения работы с материалами курса «Химия-9» я уже в 8-м классе изучаю этот материал в полном объеме, с подробным разбором сложных примеров реакций ионного обмена. А сэкономленное время использую в 9-м классе на изучение органической химии (хотя считаю введение ее в программу на этой ступени изучения химии нецелесообразным).
Предлагаю свой вариант изложения этой темы в 8-м классе с большим числом примеров и трехуровневой проверочной работой.
Правила написания уравнений реакций в ионном виде




Условия, при которых реакции ионного обмена
протекают до конца
1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с кислотой:
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O.
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
Молекулярное уравнение реакции амфотерного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
2. Если в результате реакции выделяется нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 + 2KOH = 2KCl + Cu(OH)2
Полное ионное уравнение реакции:
Cu 2+ + 2Cl – + 2K + + 2OH – = 2K + + 2Cl – + Cu(OH)2
Cокращенное ионное уравнение реакции:
Cu 2+ + 2OH – = Cu(OH)2
Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 + 3BaCl2 = 3BaSO4 
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 + H3PO4 = FePO4 
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S
Cокращенное ионное уравнение реакции:
S 2– + 2H + = H2S
Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2 
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Запись сложных химических уравнений реакций в ионном виде
Молекулярное уравнение реакции обмена с участием воды:
2FeCl3 + 3K2CO3 + 3H2O = 6KCl + 2Fe(ОН)3 
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Данная реакция ионного обмена протекает до конца, о чем свидетельствуют сразу два признака: выделение газа и образование осадка.
Молекулярное уравнение реакции металлического цинка с водной щелочью:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции амфотерного оксида с водной щелочью:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции нерастворимого карбоната с растворимой в воде солью:
СaCO3 + CuCl2 + H2O = Cu(OH)2 
Полное ионное уравнение реакции:
СaCO3 + Cu 2+ + 2Cl – + H2O = Cu(OH)2
Cокращенное ионное уравнение реакции:
СaCO3 + Cu 2+ + H2O = Cu(OH)2 
Проверочная работа по теме «Ионный обмен»
Вариант на оценку «5»
1. Приведите полные ионные и молекулярные уравнения реакций, соответствующие сокращенным ионным уравнениям:
ZnO + 2H + = Zn 2+ + H2O,
Ag + + Cl – = AlCl
2. Приведите по одному примеру реакции ионного обмена, протекающей до конца с: а) выделением воды; б) образованием осадка; в) одновременным выделением газа и воды.
Вариант на оценку «4»
1. Напишите в молекулярном, полном и сокращенном ионных видах следующие уравнения реакций:
2. Приведите пример реакции, для которой полное ионное уравнение совпадает с сокращенным.
Вариант на оценку «3»
1. Назовите условия, при которых реакции ионного обмена протекают до конца, приведите по одному примеру на каждое условие.
2. Покажите на конкретных примерах, что реакции ионного обмена не являются окислительно-восстановительными.
ЛИТЕРАТУРА
Рудзитис Г.Е., Фельдман Ф.Г. Химия-8, 9. М.: Просвещение, 1990;
Глинка Н.Л. Общая химия. Л.: Химия, 1988;
Макареня А.А. Повторим химию. М.: Высшая школа, 1989;
Романцева Л.М. Сборник задач и упражнений по общей химии. М.: Высшая школа, 1991.
В.А.ДЕМИДОВ,
учитель химии
Синегорской средней школы
(Нагорский р-н, Кировская обл.)
http://kardaeva.ru/89-dlya-uchenika/9-klass/140-reaktsii-ionnogo-obmena-i-usloviya-ikh-protekaniya
http://him.1sept.ru/article.php?ID=200300207